基于网络药理学和实验验证探究芒果苷钠盐对动脉粥样硬化的作用机制
蒲泽江,赵川平,闫子涵,王乾,周程艳
(1.河北大学 药学院,河北省药物质量分析控制重点实验室,河北 保定 071002;2.河北大学附属医院 神经内科,河北 保定 071000)
调查数据显示,由动脉粥样硬化(atherosclerosis,AS)引起的心血管疾病死亡率占居民总死亡率的40%以上[1].AS是由于动脉血管管腔狭窄或堵塞而引起的一种心脑血管病,多见于中老年时期,由于其极大的致残率和致死率,严重危害人体健康和生活质量[2].经研究发现,AS的发生是多方面作用的结果,涉及炎症、细胞凋亡、代谢异常等,故AS的发生是一个多部位、多靶点的协同作用[3].中药具有多成分、多靶点、多种调节方式的特点,在治疗临床疾病上蕴藏巨大的开发价值,因此从传统中医药里开发多靶点的化合物治疗AS成了日益关注的新焦点.
芒果苷(mangiferin,MF)又名莞知母宁,是一种双苯吡酮类化合物,具有止咳、平喘、化痰、抗炎、抗肿瘤、降血糖、抑菌等作用[4].本课题组研究的芒果苷钠盐(MF-Na)是芒果苷的钠盐形式,MF-Na比芒果苷具有更高的水溶性和更高的生物利用度.笔者之前的研究表明芒果苷钠盐(MF-Na)具有抗炎、调节脂质代谢异常等作用[5],而AS的发展涉及炎症、代谢异常等情况,因此MF-Na在治疗AS的研究上具有很大的前景,但是MF-Na治疗AS的作用机制尚不明确.
网络药理学是把方药与疾病间相关联的分子放在一个背景网络里,以“网络靶标”为核心,进行多角度分析,从而探究药物治疗疾病的机制[6].本文以MF-Na为研究对象,运用网络药理学与分子对接的方法,对MF-Na治疗AS的作用机制进行初步探讨.巨噬细胞是调控炎症反应、调节免疫的重要角色,为许多炎症性疾病的病理标志,如肥胖、AS等,并与肿瘤预测、转移、预后有重要关系[7].巨噬细胞又是人体重要的固有免疫细胞之一,因此本文选择巨噬细胞进行了深入的实验验证研究,大大减少了后期实验的盲目性,为研究MF-Na对AS的治疗作用提供了有益的参考.
1 材料与方法
1.1 实验材料
小鼠巨噬细胞系(RAW264.7细胞)为实验室冻存库冻存细胞;芒果苷钠盐[8]、ox-LDL(批号:2021-04-15);DMEM培养基(批号:AF29449021);胎牛血清(批号:21110702);CCK-8(批号:006Z0102);大鼠酶联免疫试剂盒(ELISA): TNF-α、NF-κB、IL-6、CCL2、CXCL1(批号:202108);NF-κB p65抗体(批号:A107086414);NF-κB p50抗体(批号:A108261659);即用型SP免疫组化试剂盒(批号:20220519);质量分数4%多聚甲醛固定液(批号:22105339);载玻片(批号:19048);RIPA裂解液(批号:01408/28421);Triton X-100(批号:1109F055).
1.2 MF-Na治疗AS的网络药理学研究
1.2.1 MF-Na化学成分靶标预测及靶点PPI网络构建
选择MF作为MF-Na靶点筛选的化合物,登录Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/),通过搜索“Mangiferin”获得MF的化学结构、Smile号、InChikey号等相关信息.进一步通过四大数据库“TCMSP数据库(http://tcmspw.com/tcmsp.php)、STITCH数据库(http://stitch.embl.de/)、Swiss Target Prediction数据库(http://swisstargetprediction.ch/)、SEA数据库(http://sea.bkslab.org)”预测MF-Na的作用靶点.为了统一靶点的标准名称,则把预测出来的靶点信息利用Uniprot数据库将所有靶点统一转换为官方基因名,即Official Symbol.
STRING(https://string-db.org/)数据库是一个在线搜索已知蛋白质之间相互作用的数据库,可以对输入蛋白间的相互作用进行打分评价,连接度越大,则可信度越高.为了让MF-Na中筛选出来的蛋白相互作用关系可视化,将上述筛选出来的MF-Na潜在靶点信息上传到STRING数据库,在该网站通过设置研究物种为“Homo sapiens”,得到蛋白间的相互作用关系网络图(PPI网络图)以及相关的拓扑学分析.
1.2.2 AS疾病靶点预测
OMIM数据库(https://www.omim.org/)、Genecards 数据库(https://www.genecards.org/)、GAD数据库(https://geneticassociationdb.nih.gov/)里面提供了基因组、蛋白组、转录组和遗传上所知的全部人类基因信息.分别登录OMIM、Genecards、GAD数据库,输入关键词“Atherosclerosis”获得与AS相关的疾病靶点.登录STRING数据库,将筛选到的AS相关靶点上传,在该网站通过设置研究物种为“Homo sapiens”,得到蛋白间的相互作用关系网络图(PPI网络图)以及相关的拓扑学分析.蛋白互作网络的构建能够用于深入了解不同蛋白在复杂疾病中的作用,因此本研究构建“MF-Na的成分靶点PPI”及“AS相关靶点PPI”.
1.2.3 MF-Na作用于AS的潜在关键作用靶点
首先登陆Webtools.venn网站(http://bioinformatics.psb.ugent.be/webtools/Venn/),分别录入“1.2.1”、“1.2.2”中筛选得到的靶标,点击“Submit”得到2个靶标的交集,即药靶和疾病基因的交集,这个交集中的靶标即MF-Na治疗AS的关键作用靶点.为了进一步了解这些靶标在疾病治疗中的作用,将上述筛选出来的靶点信息上传到STRING数据库,在该网站通过设置研究物种为“Homo sapiens”,得到蛋白间的相互作用关系网络图(PPI网络图)以及相关的拓扑学分析.
1.2.4 相关靶点功能及通路分析
DAVID数据库(https://david.ncifcrf.gov/)是一个开放的多功能生物信息在线数据库,为大规模的基因或蛋白列表提供系统综合的生物功能注释信息.DAVID数据库通常用于靶基因的描述和注释,以此来探究靶基因的信号通路.登录DAVID数据库,把筛选出来的关键靶标导入,限定物种为“Homo sapiens”,P≤0.05为筛选阈值,勾选生物学过程(biological process,BP)、细胞学组分(celluar components,CC)和生物学功能(molecular function,MF)3个方面进行GO分析,预测关键靶点的相关功能.再利用DAVID对关键靶点进行KEGG通路富集分析,设置物种为“Homo sapiens”,最终得到气泡图.
1.2.5 “化合物-靶标-通路-疾病”网络的构建
Cytoscape是一个生物信息学领域的专业绘图软件,具有强大的功能,可用于信号通路与靶点分子间相互作用关系的可视化研究.以MF-Na靶标预测结果、MF-Na治疗AS关键靶标预测结果、作用的通路富集结果这几个方面的数据为节点(node),先在Excle表中建立彼此对应的关系,再导入Cytoscape软件,然后构建并分析“化合物-靶标-通路-疾病”的网络药理图.网络图中若其中某个靶标是该化合物的潜在靶标,则用线把它们连接起来.通过构建这样一个多边的、多层次的、全面的网络图来了解靶标所处的通路.
1.3 MF-Na对AS的分子对接研究
采用AutoDock Vina软件,进行分子对接.首先登陆Pubchem(https://pubchem.ncbi.nlm.nih.gov/)数据库,下载芒果苷的sdf化学结构,再使用Chemdraw画出芒果苷钠盐(MF-Na)化学结构,把MF-Na作为分子对接的配体,其次登陆RCSB PDB(https://www.rcsb.org)数据库下载MF-Na与AS对应的共同靶标蛋白质的pdb分子结构,作为分子对接的受体.打开AutoDock Vina软件,分别导入 Degree值靠前的靶标蛋白质受体与MF-Na进行分子对接.对接完成后分别得到MF-Na与每个蛋白受体的对接得分值,得分值越低,表示配体与蛋白受体的结合越稳定.
1.4 细胞实验验证
1.4.1 细胞培养
将小鼠单核巨噬细胞RAW264.7培养于含体积分数10%胎牛血清和1%抗生素(青霉素与链霉素)的DMEM高糖培养基中,然后放置于37 ℃、CO2孵育箱中培养,在倒置显微镜下观察细胞的生长状态.采用氧化性低密度脂蛋白(ox-LDL)构建炎症细胞模型.
1.4.2 CCK-8法检测细胞活性
用胰酶消化细胞,再取密度为1×104/mL的RAW264.7细胞悬液,接种到96孔板中,设好细胞分组后培养过夜,待细胞贴壁后按分组加入含不同浓度(0、10、20、40、80、160、320 μmol/L)MF-Na的DMEM培养基100 μL,置于孵育箱中培养24 h后向每个孔中加入10 μL CCK-8试剂,孵育2 h,用酶标仪测定450 nm处每个孔的吸光度(OD)值,通过计算后获得细胞活力,以对照组细胞活力为基准.计算其余各组的相对细胞活力.
1.4.3 酶联免疫吸附法检测细胞培养上清液和细胞裂解液中炎症因子水平
将细胞以1×105/mL接种于6孔板中,然后分为空白组、模型组和治疗组,治疗组中给药浓度依据CCK-8实验筛选得到.过夜贴壁后,弃去原培养基,正常组中加入DMEM完全培养基、模型组中加入含ox-LDL(50 μg/mL)的培养基、治疗组中分别加入不同浓度的MF-Na(20、40 μmol/L)和ox-LDL(50 μg/mL)的培养基,继续在培养箱中培养24 h.随后吸出细胞培养液用2 500 r/min离心20 min后收集上清液.同时,用PBS缓冲液冲洗细胞3次,加入RIPA裂解细胞,12 000g/min离心10 min,收集细胞裂解液.采用酶联免疫吸附法(ELISA)法,通过加样、加酶、温育、洗涤和显色等过程进行检测,然后于450 nm波长依序测量各孔的吸光度值(OD值),并根据标准曲线进行细胞培养上清液和细胞裂解液中的TNF-α、NF-κB、IL-6、CCL2和CXCL1的水平的计算.
1.4.4 免疫细胞化学检测NF-κB p65和NF-κB p50蛋白的表达
1.4.5 统计学分析
2 结果
2.1 MF-Na对AS的网络药理学研究结果
2.1.1 MF-Na化学成分靶标预测及靶点PPI网络构建
TCMSP、STITCH、Swiss Target Prediction、SEA几大数据库对MF-Na靶点进行筛选之后,分别预测得到2、30、72、24个靶点,整合来自各个数据库的靶点,去除重复的靶点后共得到119个靶点.119个靶标导入STRING数据库中,限定物种为“Homo sapiens”,得到各蛋白基因之间的相互作用关系,通过Cytoscape绘制PPI网络,于是得到MF-Na活性成分所作用的蛋白之间的相互作用关系网络图,结果如图1所示.图1中的每1个靶点都代表1个节点,连线表示靶点的连接度,即靶点与其他靶点相关联的程度.靶点在图中的连线越密集就说明该靶点在PPI网络图中的占比权重越大,越说明此靶点就是MF-Na的重要靶点.另外对这些排名前15的靶点进行了拓扑学分析,由拓扑学分析结果可知AKT1,TP53,EGFR,HRAS,IL-6,TNF等是MF-Na作用的重要靶点,如表1所示.
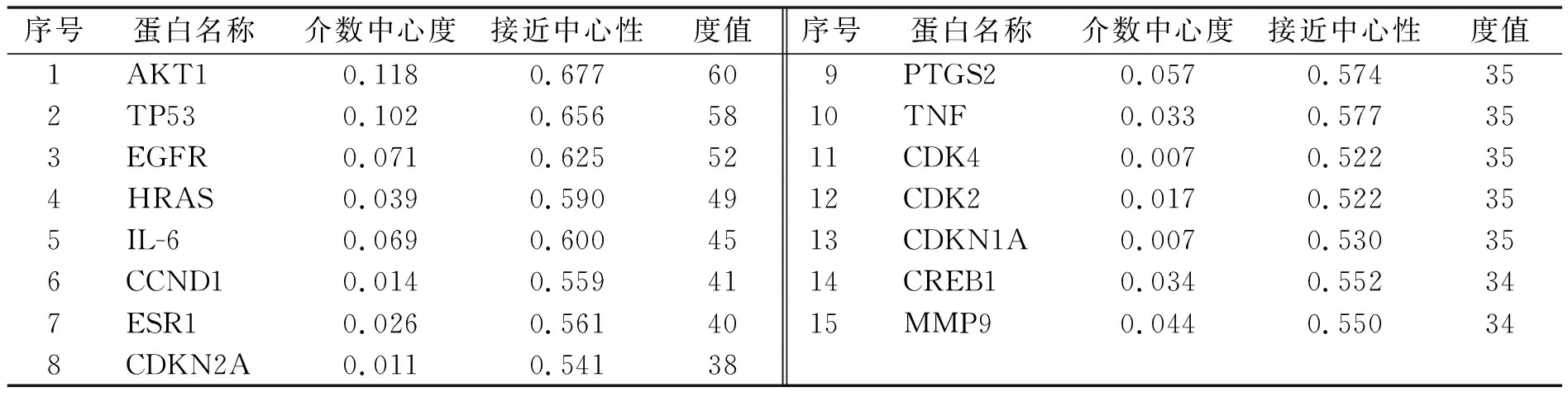
表1 MF-Na蛋白互作拓扑学分析(度值排序前15个靶点)

图1 MF-Na活性靶点蛋白-蛋白互作网络Fig.1 PPI network of MF-Na active target
2.1.2 AS疾病相关靶点数据构建
进入OMIM、GAD和Genecards 数据库,检索AS相关的靶点,输入“Atherosclerosis”获得与AS相关靶点分别为200、150、257个靶点,并删除重复后共有433个,得到在3个数据库中AS疾病重要的一些靶标基因.把得到的433个靶标导入STRING数据库中,限定物种为“Homo sapiens”,得到各蛋白基因之间的相互作用关系,然后导入Cytoscape软件,绘制PPI网络,网络中边最多、连接最密集的节点就是与疾病相关的最重要的基因,如图2所示.由拓扑学分析结果可知,IL-6、TNF、INS、ALB、AKT1、VEGFA等是治疗AS的重要靶点,结果如表2所示.
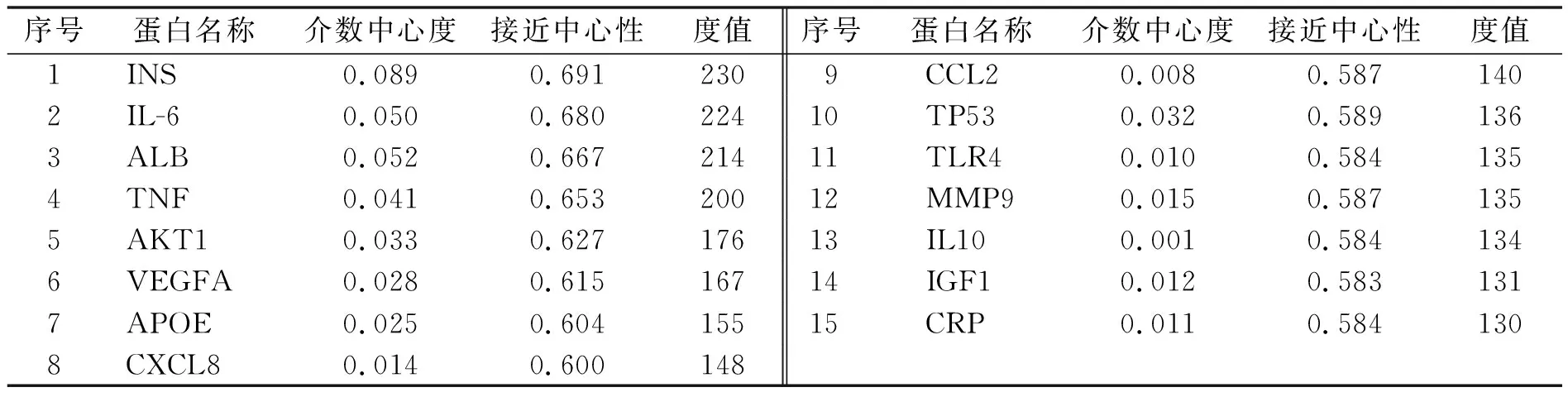
表2 AS蛋白互作拓扑学分析(度值排序前15个靶点)
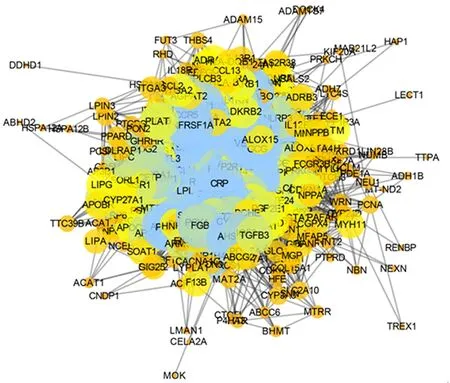
图2 AS相关疾病靶点蛋白-蛋白互作网络Fig.2 PPI network of AS related disease targets
2.1.3 MF-Na-AS共同靶点的筛选
通过对MF-Na作用靶点和AS疾病作用靶点进行筛选后,得到了MF-Na作用的119个靶点和AS疾病作用的433个靶点.登录http://bioinformatics.psb.ugent.be/webtools/venn/网站,分别输入MF-Na作用的靶点和AS的靶点,两者取交集后就得到了“药物-疾病”共同靶点23个.将交集中的靶点导入STRING数据库中,限定物种为“Homo sapiens”,得到各蛋白基因之间的相互作用关系,然后导入Cytoscape软件,得到23个主要靶点的相互作用网络,如图3所示.23个主要靶标的相互作用网络图中直观地展示了重点靶标与其他靶标之间的联系.由拓扑学分析结果(表3)可知,TNF、IL-6、AKT1、PTGS2、TP53、ESR1等靶点在网络图中的占比权重较大,可能是MF-Na治疗AS的关键靶点.
这一目标给他带来巨大的“压力”,他努力把压力化作“赶路”的动力。在这本书的前言“写在前面”中写到:“是因为几十年来,我几乎天天都在极为紧张地‘赶路’,追求专业钻研上的进展,……总之一句话,如果说我这一生有这样那样的压力,那么,‘赶路’便是主流压力。我给父亲的信,主要述说的便是在这一主流压力下我之所思所写所为。”
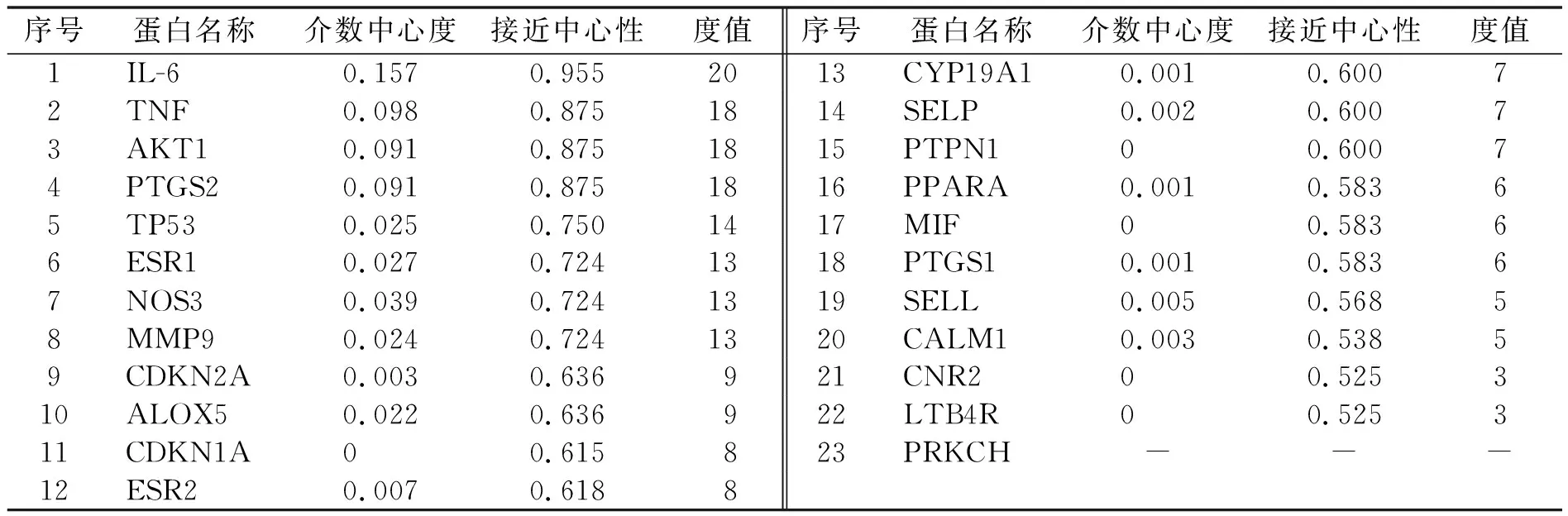
表3 MF-Na对AS作用靶点的拓扑学分析
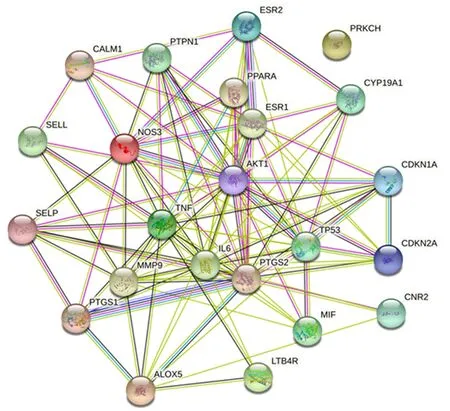
图3 MF-Na治疗AS的潜在直接作用靶点的PPI网络Fig.3 PPI network of potential direct targets of MF-Na in the treatment of AS
2.1.4 MF-Na治疗AS的靶蛋白功能和通路富集分析结果
将筛选得到的MF-Na治疗AS的23个关键靶点导入DAVID数据库,限定物种为“Homo sapiens”,进行GO分析,共得到33个富集结果(P≤0.05).其中生物学过程(BP)21个,涉及一氧化氮生物合成过程、RNA聚合酶Ⅱ启动子转录的正调控、凋亡过程的正向调控、糖皮质激素反应、蛋白激酶活性的负调控等;生物学功能(MF)9个,包括类固醇激素受体、细胞因子活性、酶的结合等;细胞学组分(CC)3个,包括蛋白质络合物、细胞外空隙、胞外区等.
KEGG通路富集分析,得到46个相关通路(P≤0.05),按照显著性P值由高到低进行排序,图4列出了排序前30条的富集结果.横轴表示靶点的得分值,纵轴是通路名称,点大小表示路径中目标的数量,点颜色反映显著性,P值越小颜色越偏红色,P值越大越呈蓝色.Rich factor越大,表示富集的程度越大,P值越接近于零,表示富集越显著.排除与本疾病关联性不大的通路,再从前30条通路中选择得分高的通路,于是得到estrogen signaling pathway(脂质代谢相关)、TNF signaling pathway(炎症相关)、hypertrophic cardiomyopathy (HCM)(炎症通路)、HIF-1 signaling pathway(缺氧诱导因子)、HTLV-I infection(炎症相关)、PI3K-Akt signaling pathway(细胞代谢)、platelet activation(血小板活化)、insulin resistance(代谢调节)等通路.

图4 前30条KEGG通路Fig.4 Top 30 KEGG pathways
2.1.5 “化合物-靶标-通路-疾病”网络分析
利用Cytoscape软件,绘制了MF-Na的“化合物-靶标-通路-疾病”网络图,直观地呈现了MF-Na、AS所对应的靶标与30条作用通路之间的关系,如图5所示.图5中蓝色圆形代表MF-Na或疾病的作用靶标、红色圆形代表两者的交集靶标、紫色倒三角形代表作用通路、蓝色三角形代表MF-Na、绿色菱形代表AS这种疾病,连线表示它们之间的相互作用.从网络图中可以看出,AKT1、TNF、IL-6是连接度较高的靶点,TNF signaling pathway、platelet activation是主要的通路途径.图5结果显示了化合物-靶标-通路-疾病之间的复杂的过程,体现了药物在体内发挥作用时复杂的生物过程,这表明MF-Na在体内主要是通过调节炎症通路、脂质代谢和血小板活化通路来发挥治疗作用的.

图5 MF-Na “化合物-靶标-通路-疾病”网络Fig.5 Network “compound-target-pathway-disease” of MF-Na
2.2 MF-Na对AS的分子对接分析结果
对23个共同靶标的PPI网络中Degree值排前10的靶标(IL-6、TNF、AKT1、PTGS2、TP53、ESR1、NOS3、MMP9、CDKN2A、ALOX5)与MF-Na进行分子对接,并且选用辛伐他汀作为对照药物与MF-Na进行对接作为参考.结果显示与MF-Na结合较好的靶点有TNF,与Glu、Ser、Met等氨基酸残基形成氢键,结合能为-38.07 kJ/mol,小于对照药物(-32.22 kJ/mol);IL-6与Gln、Asn、Lys、Thr、Tyr等氨基酸残基形成氢键,结合能为-30.12 kJ/mol,小于对照药物(-28.45 kJ/mol),结果如图6.
2.3 细胞实验验证结果
2.3.1 MF-Na对RAW264.7活性影响
细胞活力检测结果如图7所示,适量的MF-Na对Raw264.7细胞活力具有促进作用.在MF-Na浓度从10~320 μmol/L时,细胞活力呈先上升再下降趋势,当MF-Na浓度为40 μmol/L时细胞活力最大.从10~20 μmol/L时,细胞活力逐渐降低;20~40 μmol/L时,细胞活力上升;在40 μmol/L之后,随着MF-Na给药浓度增大,细胞活力逐渐下降.因此选择MF-Na 20、40 μmol/L作为低浓度和高浓度进行后续实验验证.
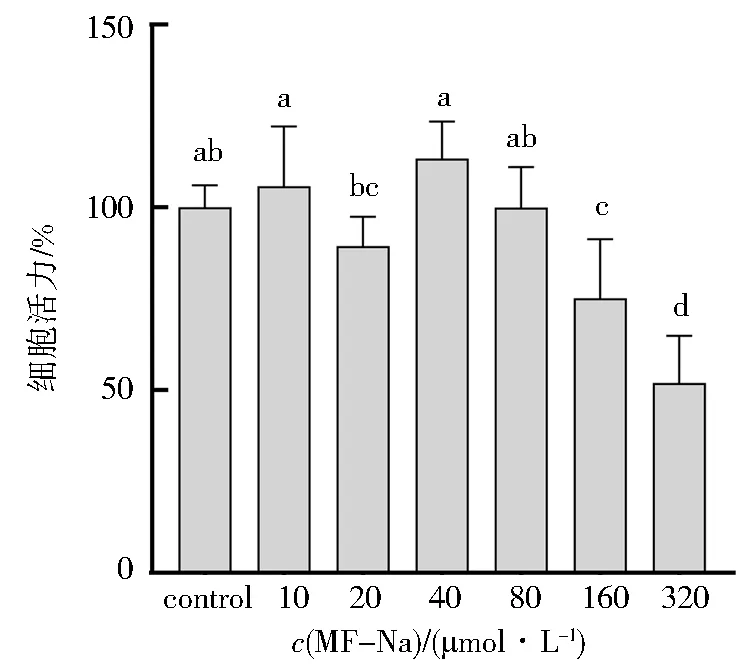
不同字母表示具有显著差异P<0.05;相同字母表示无显著差异图7 CCK-8法检测细胞活性Fig.7 Cell viability detected through CCK-8 method
2.3.2 MF-Na降低细胞培养上清液和裂解液中炎症因子的表达水平
在培养上清液中,MF-Na显著降低了TNF-α、NF-κB和IL-6炎性因子的表达水平,并且降低了CCL2、CXCL1趋化因子的水平,结果如表4所示.在裂解液中,模型组的上述炎症因子显著增加,当给予MF-Na治疗后,上述炎症因子水平明显下降,这与培养上清液的检测结果相一致.这表明MF-Na是作用于TNF-α、IL-6等靶点来减少炎症反应和CCL2等靶点来降低趋化因子,从而达到治疗效果,较好地验证了上述网络药理学预测的靶点.
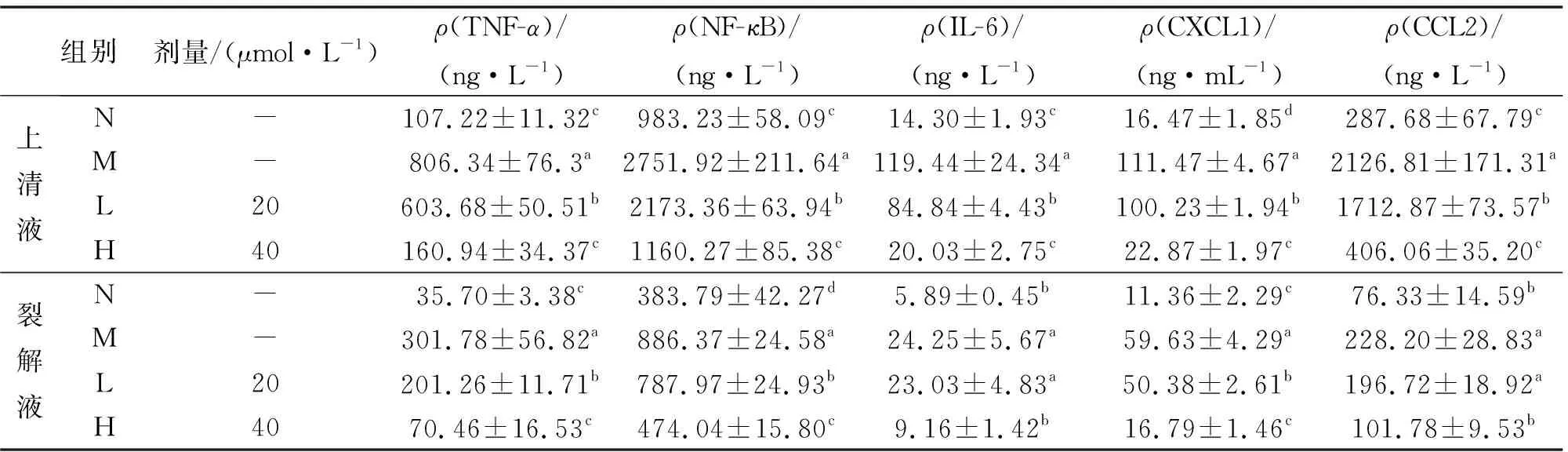
表4 细胞培养上清液和细胞裂解液中炎症因子的含量
2.3.3 MF-Na降低细胞中NF-κB p65和NF-κB p50蛋白的表达
NF-κB p65和NF-κB p50蛋白的表达结果如图8所示.NF-κB p65的表达水平,模型组较正常组高,并有显著性差异;MF-Na高剂量组,NF-κB p65表达明显降低.NF-κB p50的表达水平,正常组表达较低,而模型组中表达则显著升高;MF-Na高剂量组,p50表达明显降低.总体而言,MF-Na显著降低了细胞中NF-κB p65和NF-κB p50的表达水平,表明NF-κB可能是被调控的靶点之一.

N.正常组;M.OX-LDL处理的模型组;L.低剂量MF-Na治疗组;H.高剂量MF-Na治疗组图8 细胞中NF-κB p65、NF-κB p50的表达Fig.8 Expression of NF-κB p65 and NF-κB p50 in cells
3 讨论
本次研究利用网络药理学的方法,通过TCMSP、STITCH、SEA、Swiss Target Prediction数据库和相关的资料文献筛选出了MF-Na的119个潜在靶点,再通过OMIM、GAD和Genecards数据库筛选出AS的433个靶点,进行比对之后得到23个核心靶点基因.结果表明,TNF-α、IL-6、CCL2等是MF-Na治疗AS的重要靶点.
AS属于慢性炎症疾病,炎症的发生贯穿在整个AS的发生、发展等过程中.血脂升高等因素导致内皮损伤,内皮细胞分泌炎症因子和趋化因子,如单核细胞趋化因子(monocyte chemoat-tractant protein,MCP),单核细胞黏附、聚集并迁移至内皮下分化为巨噬细胞.巨噬细胞转变为泡沫细胞,并形成脂质条纹、粥样硬化斑块等病理改变,进而引起炎症大爆发.因此,巨噬细胞在AS的发生和发展过程中均起着直观重要的作用[9-10].TNF-α是一种显著的促炎细胞因子,参与多种炎症反应.大量炎症因子的产生会维持体内的炎症水平.当体内TNF-α水平较高时,大量巨噬细胞发生M1型活化,从而加速AS的发展[11].大量TNF-α还能促进其下游NF-κB信号的激活(图9)[12].NF-κB是介导炎症反应的关键转录因子,当其被激活时,体内炎性因子的转录翻译水平随之上调,增加活性氧自由基、促进内质网应激、加重AS[13].NF-κB的激活可以调节CCL2的表达水平.CCL2作为趋化因子配体2,可与Th2型趋化因子受体(CCR2)协同作用,促进单核细胞向动脉募集.此时,大量单核细胞聚集到动脉壁中,它们分化为巨噬细胞,这些巨噬细胞吞噬LDL后最终成为内膜中的泡沫细胞,导致管腔狭窄[14].CXCL1结合CXCR2是造成急性细胞炎症反应的原因之一,并且CXCL1-CXCR2轴促进巨噬细胞聚集,从而发生AS病变[15].此外,炎性因子IL-6可促使巨噬细胞对低密度脂蛋白(LDL)的摄取,使脂肪沉积增加,诱导形成泡沫细胞而促进AS的形成[16].由此推测,MF-Na抗AS的作用机制与炎症因子的关系十分紧密.
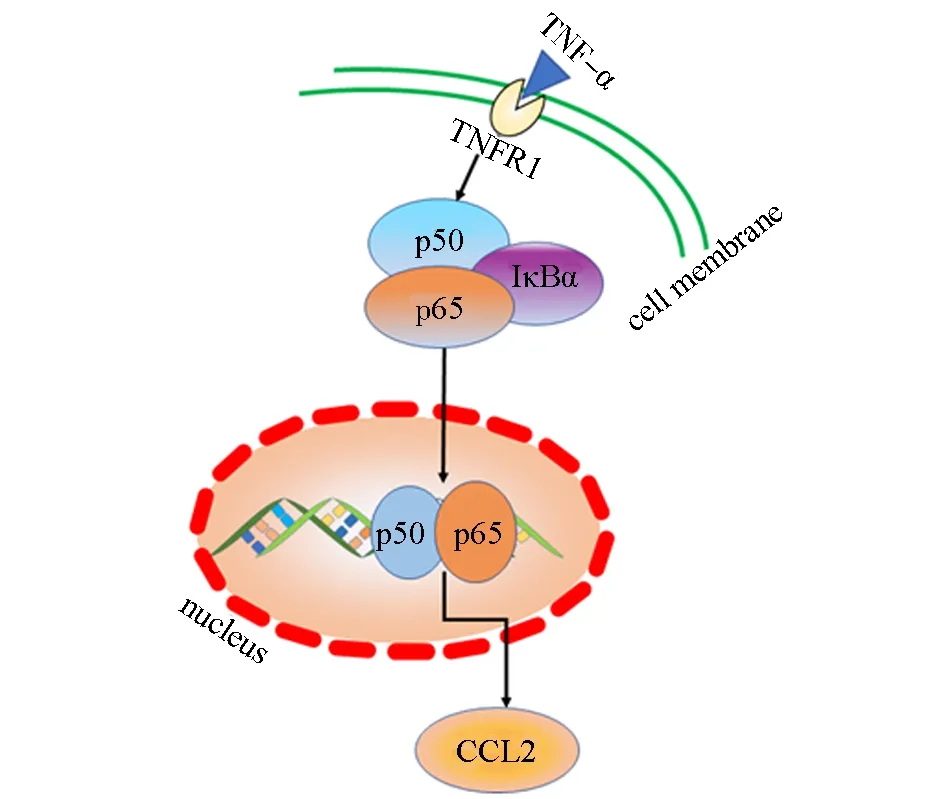
图9 TNF-α促进NF-κB的激活机制Fig.9 Mechanism of TNF-α promoting NF-κB activation
GO功能富集分析结果显示,MF-Na治疗AS涉及多个细胞进程和生物过程,并且主要生物过程均与体内炎症反应和细胞的增殖凋亡密切相关.KEGG通路富集结果显示,TNF信号通路、PI3K-Akt信号通路、Estrogen信号通路等是MF-Na发挥抗AS作用的重要信号通路.富集到TNF信号通路中的基因多以促炎症基因为主,此通路在影响巨噬细胞活化、释放炎症因子、调控免疫反应方面发挥着重要作用,从而对AS产生影响[17].此外,分子对接结果显示,TNF、IL-6等炎症因子靶标与MF-Na的结合能较低,结合关系较好.MF-Na处在对接靶点蛋白质的氨基酸组成的活性区域里,并与这些氨基酸通过氢键连接,十分稳定.因此本研究以TNF通路中的部分炎症因子为目标,验证其与MF-Na的相互作用,从而探究MF-Na抗AS的作用机制.
研究结果表明,TNF-α、NF-κB、IL-6、CCL2和CXCL1在模型组中高表达,加入MF-Na干预后它们表达水平均降低,表明MF-Na能逆转AS过程中炎症因子的升高.同时,免疫细胞化学实验发现,NF-κB p65和NF-κB p50在模型组和MF-Na高剂量组中的表达水平具有显著差异,MF-Na能显著降低细胞中NF-κB p65和NF-κB p50的表达水平.已有研究表明,TNF能激活NF-κB表达,NF-κB的激活可以调节CCL2的水平[12,14].这与本研究结果相一致,说明MF-Na可以通过TNF-α/NF-κB/CCL2途径相关基因的转录与蛋白表达来调节炎症反应,从而发挥对AS的治疗作用.
综上所述,MF-Na对AS具有多途径调节作用.MF-Na可以有效缓解细胞炎症情况,降低炎性因子TNF-α、NF-κB、IL-6的含量和降低趋化因子CCL2、CXCL1的含量,并通过TNF-α/NF-κB/CCL2通路发挥治疗作用.网络药理学结合细胞实验验证,深入阐述了MF-Na治疗AS的作用机制,为MF-Na治疗AS的进一步深入研究提供了依据.

