HDAC2基因多态性与噪声性听力损失易感性的关联
徐娅冬, 李雅丽, 黄魏宁
(1北京市东城区第一人民医院耳鼻喉科, 北京 100075; 2卫生部北京医院耳鼻喉科, 北京 100005)
噪声性听力损失(Noise-induced hearing loss,NIHL)是劳动者长期暴露于噪声环境引起的一种感音神经性听力损失性疾病,据统计全世界范围内约1/10的人口由于长期暴露于噪声作业环境存在NIHL风险[1]。研究显示,当暴露于相同的噪声作业环境时,仅部分个体发生NIHL,且听力损失的程度也表现出个体差异[2]。有学者指出,对相同环境条件下表现听力损失差异的原因可能与易感性基因突变有关[3]。组蛋白修饰是调控基因表达的重要机制之一,组蛋白去乙酰化酶(HDACs)是催化完成组蛋白修饰的重要酶,HDACs参与调控细胞增殖、迁移等多种细胞生物学过程相关基因的转录。组蛋白去乙酰化酶2(HDAC2)是HDACs成员之一,在哺乳动物多种细胞中均有表达,尤其在耳蜗组织中广泛表达[4]。研究发现[5],突发性感音神经性听力损失(Sudden sensorineural hearing loss,SSNHL)患者HDAC2呈现低表达,与患者治疗时糖皮质激素抵抗有关。另有研究发现[6],茶碱能够通过维持HDAC2表达减轻庆大霉素诱导的耳蜗毛细胞毒性,提示HDAC2与感音神经性听力损失有关。HDAC2基因存在多个基因多态性(SNP)位点,万瑾凌[7]发现HDAC2基因的rs2810164和rs538681位点基因突变与精神分裂症易感性有关;王冉等[8]研究显示HDAC2基因的3个SNP位点与男性酒精使用认知功能有关。本研究采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法探究HDAC2基因SNP位点与从事噪音作业工人发生NIHL风险的关联,现报道如下。
1 资料与方法
1.1 一般资料选取2019年6月-2022年6月北京市东城区第一人民医院耳鼻喉科确诊的246例NIHL患者为观察组,按照1∶1匹配选取同时期246例听力未损伤者为对照组。纳入标准:(1)NIHL符合2014版《职业性噪声聋的诊断》[9]中的相关标准,即双耳高频听阈>25 dB;(2)从事噪声作业者,工龄3年以上;(3)个体之间无血缘关系。排除标准:(1)中耳炎、耳膜穿孔等其他耳病病史;(2)颅脑损伤、腮腺炎、耳毒药物服用史、家族性耳聋等其他可能引起耳聋的病因者;(3)作业场所存在爆震、高温、重金属等理化因素致聋者;(4)从事噪声作业前已存在听力损失者。本研究通过北京市东城区第一人民医院伦理委员会审批(批号:19093),所有患者均签署知情同意书。
1.2 方法
1.2.1 资料的收集 采用问卷调查法收集所有研究对象的基本资料,包括:性别、年龄、吸烟史、饮酒史、近期有无耳毒药物服用史、家族耳聋病史及其他疾病史;噪声暴露情况,包括噪声暴露时间、工作中有无接触理化有害物质。共发放与回收有效问卷均492份。
1.2.2 纯音听力检测[10]测试均由同一位专业人员测量,所有研究对象测试前脱离噪声作业≥48 h,采用AD226听力计(丹麦Interacoustics)测试隔音室本底噪声<25 dB,测量双耳6个频率纯音气导听阈值(0.5、1、2、3、4、6 KHz),测试结果依据GB/T 7582-2004进行调整。
1.2.3 作业噪声测量[11]根据国家卫生健康委员会GBZ/T 189.8-2007要求,采用Noise pro多功能噪声剂量计(美国QUEST)测量,将传感器放置于工人耳部高度,对向声源方向测量,取多个采样点测量8 h等效连续A声级,计算累积噪声暴露量以评价实际的噪声暴露强度。
1.2.4 HDAC2基因多态性检测 样本采集及DNA提取:采集所有受试者空腹静脉血2 mL,置于抗凝管中混匀,3 000 r/min离心12 min获取上清液,PE管分装,采用全血基因组DNA快速提取试剂盒(美国Sigma-Aldrich公司)提取基因组DNA。基因分型:采用PCR-RFLP检测外周血HDAC2 SNP位点,按照PCR扩增试剂盒(美国Thermo Fisher公司)说明书操作进行目的基因扩增,获得PCR产物,引物序列见表1。回收PCR产物,进行RELP检测,设定反应体系:PCR产物4.0 μL,缓冲液1.0 μL,限制性内切酶(北京蓝博斯特生物技术有限公司)1.0 μL,ddH2O 9 μL,37℃水浴2 h酶切,进行琼脂糖凝胶电泳鉴定酶切产物基因型。

表1 HDAC2基因SNP位点PCR引物序列

2 结果
2.1 观察组与对照组基线资料及噪声暴露情况比较观察组与对照组在年龄、性别分布、吸烟史、饮酒史、噪声暴露时间、噪声暴露强度方面比较,差异无统计学意义(P>0.05);与对照组比较,观察组高频听阈升高,差异有统计学意义(P<0.05),见表2。
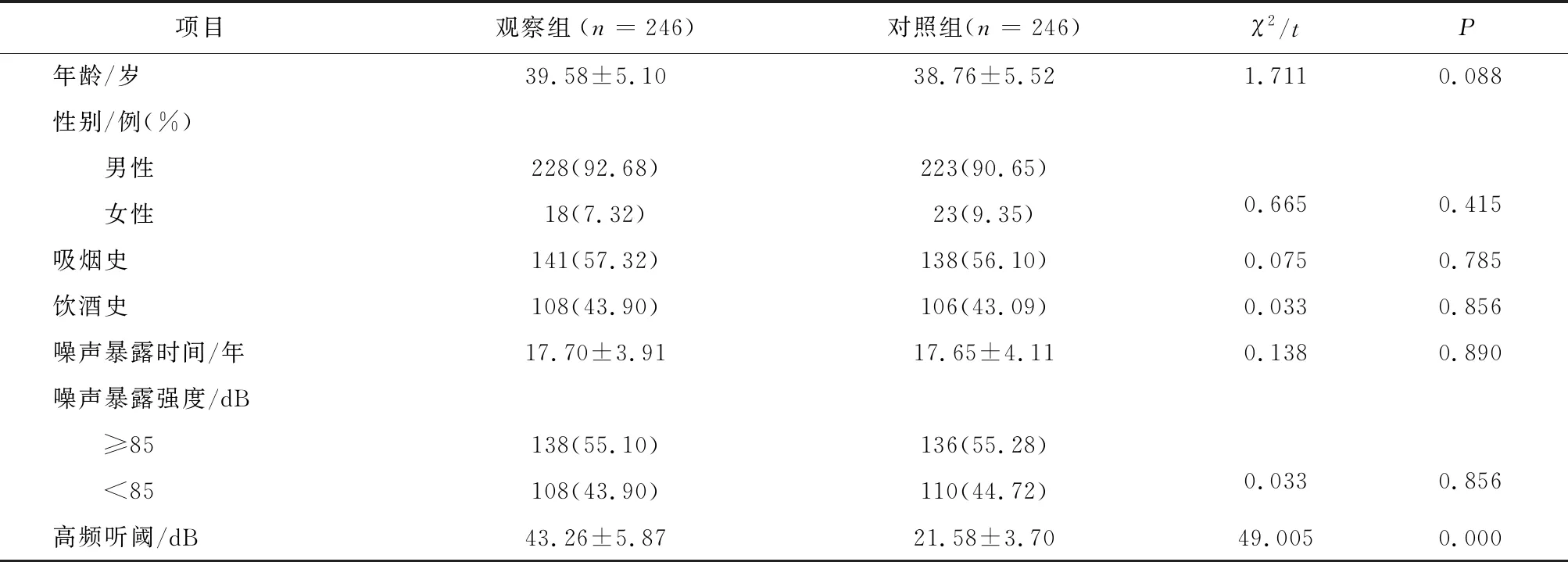
表2 观察组与对照组基线资料比较
2.2 Hardy-Weinberg平衡检验多态性测序结果显示,HDAC2基因的SNP位点(rs10499080、rs12208304、rs6568819、rs1320445和rs3757016)均存在3种基因型(野生型、杂合型及纯合型);经Hardy-Weinberg平衡检验,5个SNP位点均具有群体代表性(P>0.05),见表3。
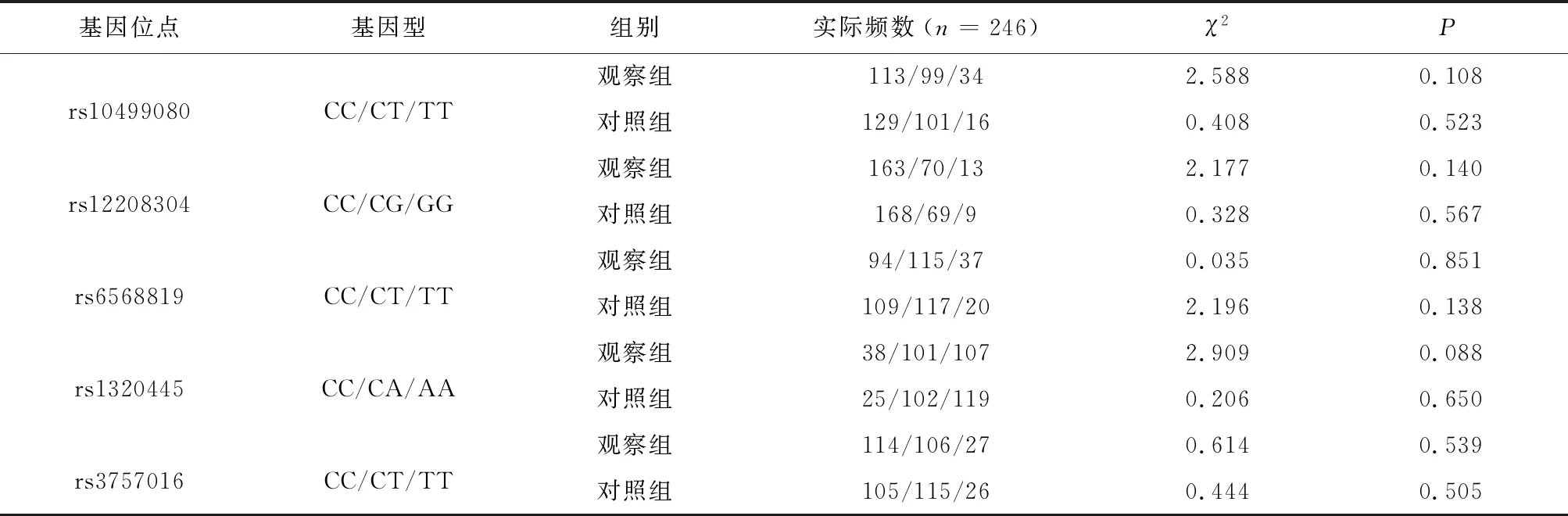
表3 PAPP-A、PPAR-γ基因多态性Hardy-Weinberg平衡检验
2.3 观察组与对照组HDAC2基因多态性比较观察组与对照组HDAC2基因rs12208304、rs1320445和rs3757016位点基因型分布及等位基因频率比较,差异均无统计学意义(P>0.05);观察组与对照组HDAC2基因rs10499080和rs6568819位点基因型分布比较,差异均有统计学差异(P<0.05);与对照组比较,观察组rs10499080和rs6568819位点T等位基因频率升高,差异有统计学意义(P<0.05),见表4。
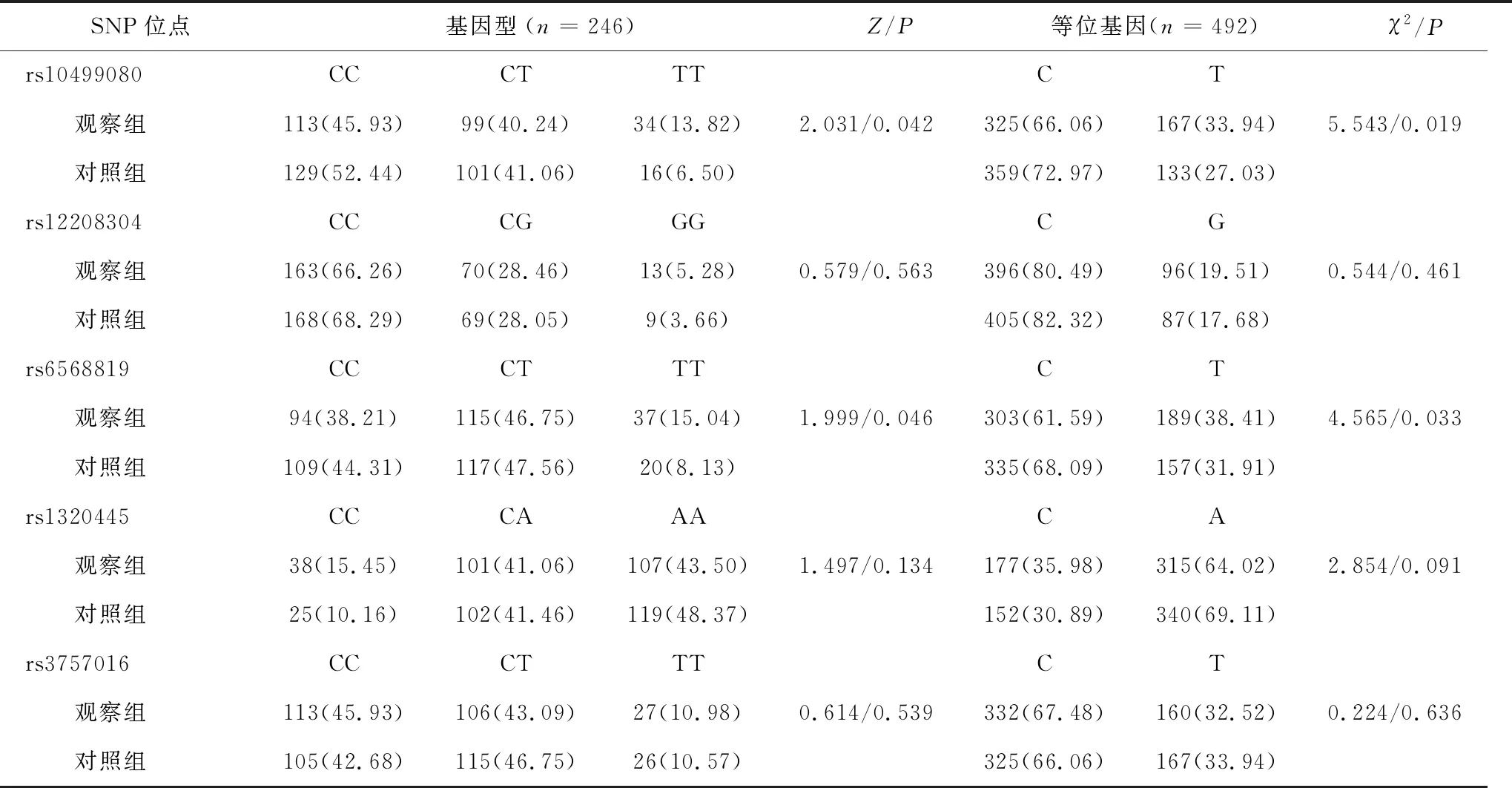
表4 观察组与对照组HDAC2基因多态性比较/例(%)
2.4 HDAC2基因多态性与NIHL易感性Logistic回归分析Logistic回归分析表明,以HDAC2基因SNP位点野生型基因为参照,rs12208304、rs1320445和rs3757016位点各基因型患者发生NIHL的风险无明显增加(P>0.05);rs10499080位点TT基因型[OR(95%CI)=1.659(1.120~2.694)]及隐性模型CT+TT基因型[OR(95%CI)=1.944(1.120~3.217)]NIHL风险增加(P<0.05);显性模型CC+CT基因型[OR(95%CI)=0.731(0.535~0.917)]NIHL风险降低(P<0.05);rs6568819位点患者TT基因型[OR(95%CI)=3.108(1.531~8.731)]及隐性模型CT+TT基因型[OR(95%CI)=1.510(1.031~2.536)]NIHL风险增加(P<0.05);显性模型CC+CT基因型[OR(95%CI)=0.892(0.420~0.954)]NIHL风险降低(P<0.05),见表5、图1。
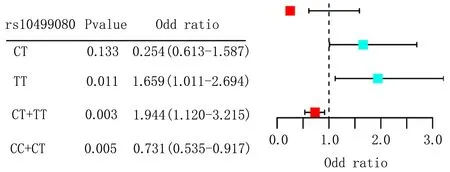
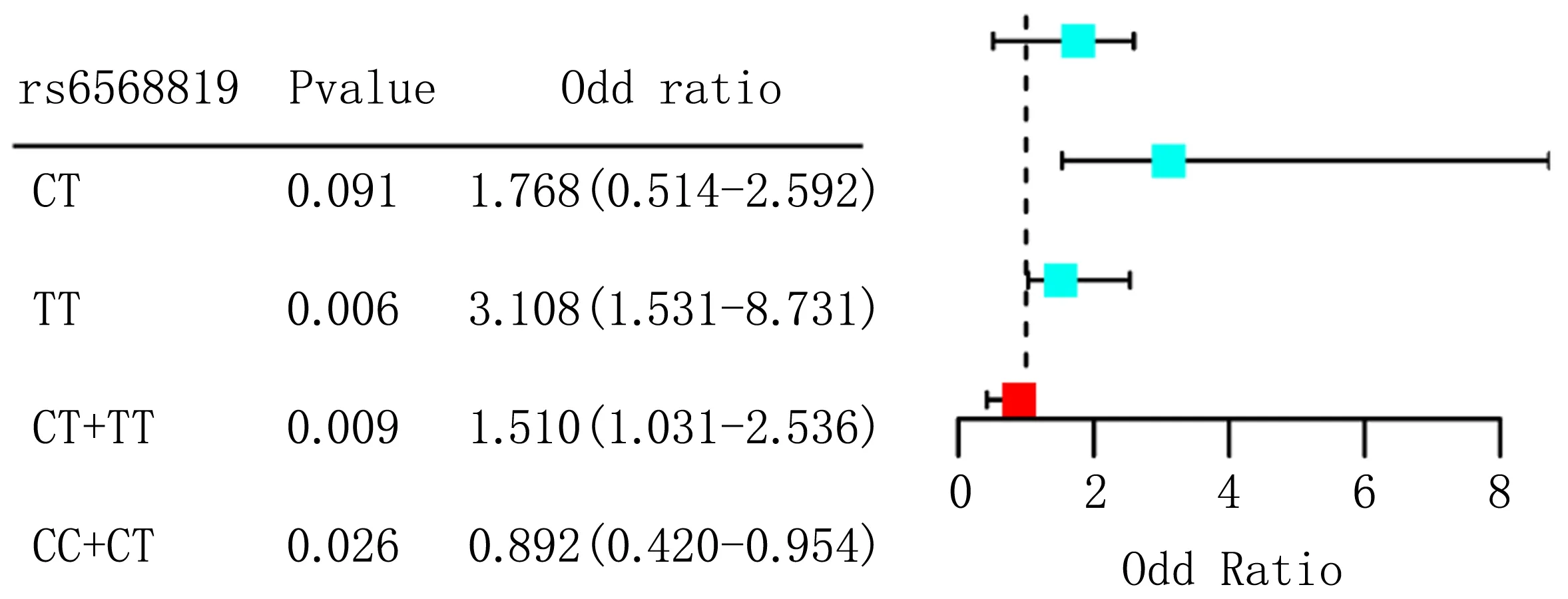
图1 HDAC2基因rs10499080和rs6568819位点Logistic回归分析森林图
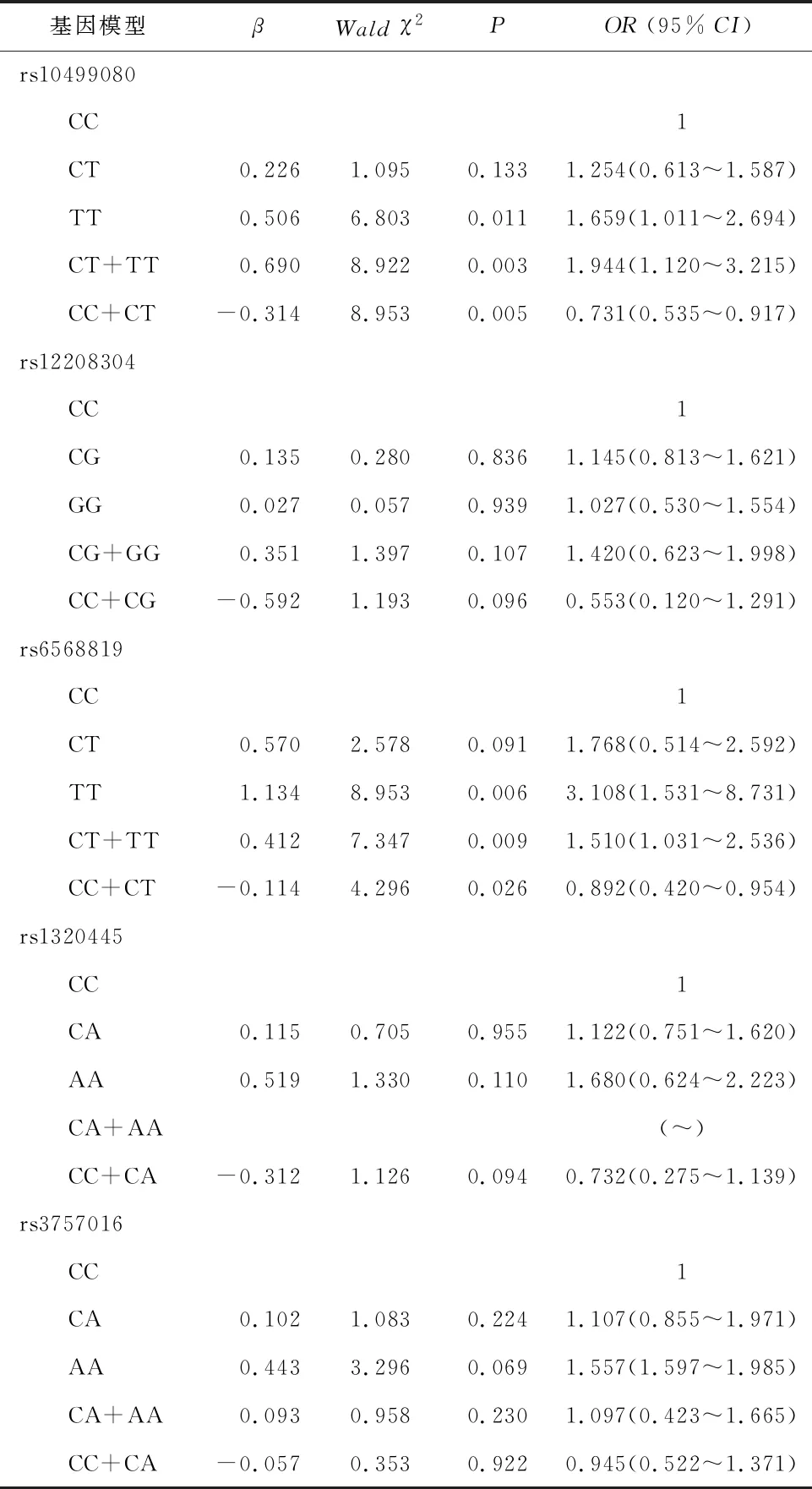
表5 HDAC2基因多态性与NIHL易感性Logistic回归分析
3 讨论
职业损害调查显示,噪声暴露不良作业环境时导致听力损伤的主要环境因素,合并基础疾病者也易发生听力损伤[12-13]。NIHL发生机制不仅与噪声暴露的环境有关,还与易感性基因突变有关,在相同噪声暴露条件下,听阈偏倚的最大与最小值相差可达70 dB,说明个体之间存在听力损失易感性的差异[14]。个体之间存在多个NIHL易感性基因,如粒状头样2(GRHL2)[15]、胱天蛋白酶激活与募集结构域8(CARD8)[16]等。关于NIHL遗传多样性的报道也逐渐增多,多态性基因涉及氧化应激、毛细胞凋亡等多种机制,如超氧化物歧化酶rs2855116位点、GRHL2基因rs1981361位点等,为探寻NIHL发病原因提供了丰富思路[17]。
研究显示,噪声暴露能够诱导工人及动物模型发生听力损伤相关基因表达变化,提示噪声与表观遗传效应存在一定关联[18]。组蛋白修饰是表观遗传改变的重要途径,HDAC2作为HDACs家族重要成员,参与组蛋白去乙酰化过程,该过程与听力损失关系密切。已有报道发现,HDAC2基因存在多个SNP位点,且证实SNP位点与强迫症、糖尿病等多种疾病的发生有关[19-20]。本研究发现,观察组与对照组HDAC2基因rs12208304、rs1320445和rs3757016位点基因多态性无差异,且经Logistic回归分析证实上述3个位点与NIHL易感性无关,说明上述3个位点碱基突变并未引起该基因功能改变,可能与细胞自我修复有关。研究发现[21],SSNHL患者HDAC2 mRNA及蛋白表达水平较健康者降低,且糖皮质激素敏感SSNHL患者治疗后HDAC2表达水平较耐药患者显著提高。周琼琼等[22]从动物实验方面证实,脂多糖诱导的急性听力损失豚鼠模型发生糖皮质激素抵抗与HDAC2有关,分析机制为,HDAC2能够被募集至炎症基因启动子区促使其去乙酰化,从而抑制促炎基因表达,说明HDAC2与听力损失关系密切。
本研究发现,HDAC2基因rs10499080和rs6568819位点均发生碱基C→T突变,NIHL患者T等位基因频率高于对照组,说明HDAC2基因的2个SNP位点(rs10499080和rs6568819)可能与NIHL有关。经Logistic分析发现,rs10499080和rs6568819位点的TT基因型及隐性模型CT+TT基因型NIHL风险增加,两位点的显性模型CC+CT基因型NIHL风险降低,提示携带隐性模型基因或T等位基因者NIHL风险较高,进一步证实HDAC2基因的两个SNP位点与NIHL存在密切关联。Wang等[23]通过构建NIHL小鼠模型发现小鼠听力阈值与耳蜗毛细胞数量有关,分析发现染色盒同源物4(CBX4)基因突变能诱导耳蜗毛细胞凋亡,从而影响小鼠听力。另有体外研究发现[24],噪声暴露可导致耳蜗毛细胞ATP耗竭,ATP耗竭能够导致组蛋白去乙酰化,最终导致毛细胞丢失。由此可分析HDAC2基因突变导致NIHL风险增加的原因为,一方面HDAC2基因突变可通过影响HDAC2表达而影响组蛋白去乙酰化,引起耳蜗毛细胞凋亡,从而导致听力损失[25];另一方面HDAC2基因突变能对炎症、氧化应激等与听力损失相关基因启动子区的去乙酰化过程产生影响,从而抑制相关基因表达,最终导致听力损失风险增加[26]。
综上所述,HDAC2基因rs10499080和rs6568819位点碱基C突变为T的噪声作业工人发生NIHL的风险较高,为临床中预测职业环境听力损失风险评估提供参考。本课题组在后续研究中会对HDACs家族其他基因之间及基因与环境之间是否存在交互作用进行深入研究,为保证职业健康提供更科学的依据。

