基于网络药理学探讨“土茯苓-川牛膝”药对治疗痛风性关节炎的作用机制∗
王玉天,朱跃兰,席雅婧
1 北京中医药大学,北京 100029; 2 北京中医药大学东方医院,北京 100078
痛风性关节炎(gouty arthritis,GA)是由于嘌呤代谢紊乱和(或)排泄异常导致血尿酸升高,进而引起尿酸盐结晶,在关节沉积并引发组织炎症和损伤的一种疾病[1],同时痛风石、痛风肾亦是其常见并发症[2]。在我国,GA 发病率呈逐年增高趋势,且以男性居多[3]。目前,现代医学治疗痛风的方法主要是消炎止痛及降尿酸等,相关治疗药物具有明显的胃肠道、心血管及肾功能不全等方面的副作用。与之相比,中医药治疗GA 具有辨证论治、安全性高等优势。
土茯苓味甘、淡,性平,归肝、胃经,具有除湿,解毒,通利关节等功效,为治疗湿浊下注及湿疮湿疹之佳品,常用于治疗GA。川牛膝味甘、微苦,性平,归肝、肾经,具有活血通经,祛风除湿,利尿通淋等功效,并可引血下行。土茯苓-川牛膝为治疗GA 的主要药对[4-6],使用频率较高,二药合用有除湿活血、通利关节之功,尤适用于湿热瘀阻型痛风。现代药理学对土茯苓、川牛膝虽有一定研究,但其作用机制及物质基础尚未完全明确,因此,本研究基于网络药理学探究土茯苓-川牛膝治疗GA的作用机制,为治疗GA提供新的思路。
1 资料与方法
1.1 茯苓-川牛膝活性成分的筛选从TCMSP(http://tcmspw.com/tcmsp.php)[7]中药数据库检索土茯苓、川牛膝的主要化学成分。药物在体内需要经过吸收(absorption)、分布(distribution)、代谢(metabolism)及排泄(excretion)过程,到达靶器官发挥药效,因此,以口服生物利用度(oral bioavailability,OB)[8]和 药 物 相 似 性(druglikeness,DL)[9]作为筛选条件对各味中药化学成分进行筛选,将其设定为OB≥30%,DL≥0.18,筛选出土茯苓、川牛膝主要活性成分。
1.2 活性成分潜在靶点的收集与筛选通过TCMSP 数据库收集主要活性成分的潜在蛋白靶点,将筛选得到的靶蛋白英文名输入到Uniprot数据库(http://www.uniprot.org/)中,筛选出物种为“人”的靶点,得到成分靶点基因,并进行标准化命名。同时,将TCMSP 数据库筛选出的主要活性成分导入Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)搜索对应SMILES 结构,将获得的SMILES 结构导入Swiss Target Prediction数 据 库(http://www.swisstargetprediction.ch/)进行靶点预测,将物种设定为Homo sapiens,以置信度阈值(Probability)评估预测结果的可靠性,并选取Probability≥0.5 的靶点作为较可靠的预测靶点。剔除无靶点活性成分,将预测靶点与TCMSP 数据库收录的靶点取并集并去重从而获得主要活性成分的所有潜在靶点。
1.3 GA 相关靶点的获取及筛选以“Gout”“Arthritis,Gouty”为检索关键词在OMIM 数据库(https://omim.org/)、TTD 数据库(http://db.idrblab.net/ttd/)、DisGeNET 数据库(https://www.disgenet.org/)以及CTD 数据库(http://ctdbase.org/)收集与GA相关的靶点,去重后得到疾病候选靶点基因。其中,CTD 数据库以Inference Score≥20为筛选限定条件。
1.4 土茯苓-川牛膝主要活性成分与GA 共同靶点的获取利用Venny 2.1 在线程序(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将土茯苓-川牛膝活性成分潜在靶点与GA 相关靶点进行匹配,绘制韦恩图并获得土茯苓-川牛膝与GA 的共同靶点,并利用Cytoscape 3.7.2 软件构建“中药-重要活性成分-疾病靶点”作用网络图。
1.5 核心靶点蛋白相互作用(protein-proteininteraction,PPl)网络构建将共同靶点导入STRING 数据库(https://string-db.org/),设定物种为“Homo snpiens”,设定最低要求互动分数为中度信度0.400,其他参数保持默认值,得到PPI网络图以及相关信息,将其中条目node1,node2和Combined score数据导入Cytoscape 3.7.2软件,借助“Network Analyzer”功能对网络进行拓扑分析,获取相关拓扑参数,以大于节点连接度(degree)、节点紧密度(closeness)和节点介度(betweenness)的中位数作为筛选依据获得关键靶点。
1.6 GO功能富集分析和KEGG通路富集分析将关键靶点导入至Metascape平台进行GO功能富集和KEGG 通路富集分析,其中设置阈值P<0.01,最小计数为3,富集因子>1.5,并对P值取负对数,-logP值越大表明富集程度越大。GO 富集依据分子功能(molecular function,MF),生物学过程(biological process,BP)及 细 胞 组 分(cellular component,CC)进行。
2 结果
2.1 土茯苓-川牛膝药效成分筛选本研究利用TCMSP 数据库检索土茯苓、川牛膝两味中药,根据口服生物利用度及类药性共筛选出19 种候选药效成分,其中土茯苓15 种,川牛膝4 种,剔除重复值及无靶点成分后,获得17 种药效成分,各药效成分详见表1。

表1 土茯苓-川牛膝药效成分筛选结果
2.2 土茯苓-川牛膝药效成分靶点预测及筛选在TCMSP 数据库中筛查药效成分靶蛋白并输入Uniprot 数据库得到靶点基因217 个;采用Pubchem 数据库搜索在TCMSP 数据库中筛查到的药效成分SMILES 结构并输入Swiss Target Prediction,得到预测靶点基因10 个。将两种方法筛选到的靶点基因取并集并删除重复靶点,共筛选出220个药效成分作用靶点。
2.3 GA 相关靶点及中药与疾病共同靶点的筛选通过OMIM、TTD、DisGeNET、CTD 等数据库分别获得GA 相关靶点1205、16、246、110 个,去重后共获得相关靶点1494 个。将“土茯苓-川牛膝”药对活性成分潜在靶点与GA 相关靶点进行匹配,获得“土茯苓-川牛膝”药对与GA 的共同靶点72 个,并绘制韦恩图,见图1,并构建“中药-重要活性成分-疾病靶点”作用网络图,见图2。
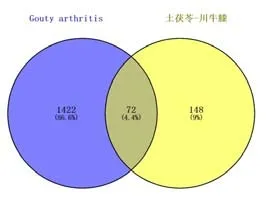
图1 土茯苓-川牛膝与GA交集靶点韦恩图

图2 土茯苓-川牛膝-活性成分-GA靶点网络图
2.4 核心靶点PPl 网络的构建分析及关键蛋白的筛选将72 个共同靶点导入数据库,得到PPI网络图,见图3。该网络包括72 个节点、1017 条边、平均节点度为28.2、平均局部聚类系数为0.699;对网络进行拓扑分析,筛选获得关键靶点28个。见表2。

图3 土茯苓-川牛膝与GA共同靶点PPI网络(节点越大,连接度越高)

表2 土茯苓-川牛膝治疗GA关键靶点信息(按degree排序)
2.5 GO 富集分析将28 个关键靶点上传至Metascape 平台,经过GO 注释富集分析共得到49个MF、872 个BP、24 个CC。富集程度居前10 位的条目见图4。分析结果显示:关键靶点主要分布于膜筏、膜微区、膜区、小窝、质膜筏、分泌颗粒腔、RNA 聚合酶Ⅱ转录因子复合物、细胞质囊泡腔、囊泡腔、转录因子复合体等细胞成分中,通过细胞因子受体结合、核心启动子结合、细胞因子活性、转录因子结合、激活转录因子结合、核心启动子序列特异性DNA 结合、肿瘤坏死因子受体超家族结合、血红素结合、四吡咯结合、受体配体活性等方式,参与细胞因子介导的信号通路、对脂多糖的反应、对细菌起源分子的反应、对活性氧的反应、对无机物的反应、对氧化应激的反应、对有毒物质的反应、对细胞外刺激的反应、细胞对氧化应激的反应、对细菌的反应等生物进程。
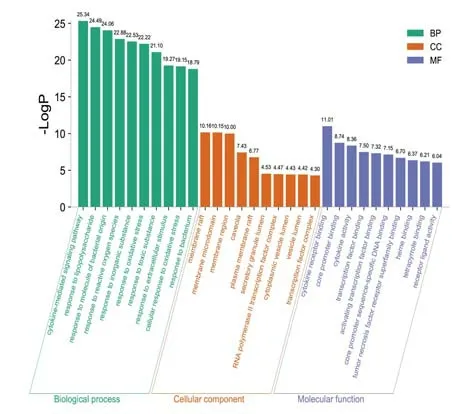
图4 关键靶点GO富集分析
2.6 KEGG 通路富集分析KEGG 通路富集分析发现,28 个关键靶点显著富集在111 条通路上。根据P值选取富集结果排名前30 的信号通路可视化,见图5。并利用Cytoscape 3.7.2 软件绘制靶点-通路网络图,见图6。

图5 土茯苓-川牛膝治疗GA前30条富集通路气泡图

图6 靶点-通路网络图
3 讨论
中国古代医家多将痛风归属于“痹证”“历节”等范畴。现代医家多认为痛风属本虚标实之证,当责之于“湿、热、瘀”等病理因素,治疗时应以清热利湿、活血通络为法[10-14]。“土茯苓-川牛膝”药对为临床治疗痛风常用中药[15],可清热除湿,利尿活血。目前尚缺乏“土茯苓-川牛膝”药对治疗GA的作用机制的相关实验研究。
本研究发现,作用于关键靶点的药效成分中,槲皮素、柚皮苷等成分作用的关键靶点个数相对较多。槲皮素可抑制黄嘌呤氧化酶活性并促进尿酸排泄,进而降低血尿酸浓度[16-17],同时其能够抑制MSU 诱导的白细胞募集、TNF-α 和IL-1β的产生、炎症反应的激活、NF-κB 的激活和炎症成分mRNA 的表达[18]。柚皮苷等类黄酮化合物具有抗氧化、抗炎症等作用[19]。因此预测“土茯苓-川牛膝”药对治疗GA 的重要药效成分可能为槲皮素、柚皮苷等。
本研究通过筛选共得到28 个关键靶点,PPI网络显示“土茯苓-川牛膝”药对治疗GA 的各靶点之间关系密切,其中自由度较高且与痛风疾病关系紧密的靶点分别为IL-6、MAPK3(mitogenactivated protein kinase 3,MAPK3)、TNF、CASP3(caspase-3,CASP3)、MAPK1(mitogen-activated protein kinase 1,MAPK1)、PTGS2(prostaglandin g/h synthase 2,PTGS2)、IL-1β、CCL2(C-C motif chemokine 2,CCL2)等。IL-6 是多功能炎症细胞因子,研究表明,痛风急性发作期患者血清及关节液中IL-6含量呈明显升高状态[20]。TNF分子有TNF-α 和TNF-β两种形式,可激活中性粒细胞,促 进 其 表 达IL-1、IL-6 等 细 胞 因 子[20-21]。MAPK1 和MAPK3 为MAPK 基因成员,为重要的炎症评价指标,可通过减少氧自由基、抑制细胞增殖及促凋亡等,降低炎性反应[22-23]。IL-1β能激活IL-1受体,可促进炎性趋化因子及其他炎症调节因子的表达,诱导中性粒细胞进入尿酸盐沉积的关节炎性部位[21,24]。CASP3 在细胞凋亡的执行阶段起着关键作用,其调控凋亡过程的关键调节位点,并进一步激活下游信号通路从而引起细胞凋亡[25]。PTGS2 属于诱导性即刻反应基因,主要参与炎症和有丝分裂过程,在炎症过程中发挥着重要作用[26]。CCL2为趋化诱导细胞因子,可趋化炎性细胞向炎症部位聚集,并诱导IL-2、IL-6 等炎性因子的表达[27]。
本研究对28 个关键靶点进行了GO 功能和KEGG 通路富集分析,富集结果显示“川牛膝-土茯苓”药对治疗GA 作用机制涉及了多种生物学过程和多条信号通路。其中,GO 富集分析结果提示关键靶点主要通过细胞因子受体结合、调节细胞因子活性、受体配体活性等方式参与细胞因子介导的信号通路、应对氧化应激、活性氧、脂多糖等生物进程。KEGG通路富集结果显示,与GA相关性高的通路为IL-17 信号通路、TNF 信号通路、Toll 样受体信号通路、NOD 样受体信号通路、Th17 细胞分化等。其中,IL-17 参与了人体内大量的炎性反应,在炎性疾病的发生及发展过程中发挥着至关重要的作用。研究发现,急性GA 大鼠IL-17 的表达水平显著增高[28]。另外,有学者发现,痛风患者血清IL-17处于高表达状态,IL-17阳性组痛风患者发病病程更长,受累关节数目更多,IL-6 水平更高[29]。TNF-α 是一种重要的免疫调节和前炎性因子,其参与的IL-1 活化过程、IL-6 介导的炎症反应,以及NF-κB 炎症信号通路等均为炎症反应的重要环节。TNF 可诱发或加重GA 的病理过程,并参与GA慢性期的骨质破坏过程,是GA发生发展的重要炎症因子[30]。研究表明,TNF-α 与GA 的发生、发展及预后密切相关[31]。杨西超等[32]研究表明,急性期痛风患者血清TNF-α 水平显著高于缓解期患者。Thl7 细胞与多种自身免疫性疾病的发病机制有关,主要分泌IL-17、IL-21、IL-6 等细胞因子,参与炎症反应的多个环节,同时,Th17 细胞的分化需要TGF-β、IL-6、IL-21、IL-23等细胞因子的参与[33]。周丽雅等[34]研究发现,药物干预GA大鼠可使Th17含量降低,炎性因子IL-17、IL-6 水平随之降低,大鼠炎症反应减轻。杨虹等[35]发现,痛风患者外周血中Th17 细胞可增多且伴随调节性T 细胞减少,提示Th17/调节性T 细胞比例失衡可能参与痛风炎症及免疫反应,在痛风免疫炎症机制中发挥重要作用。Toll 样受体信号通路是固有免疫经典信号通路,也是GA 极为重要的炎症信号通路之一。GA 发生过程中,TLR 受体识别尿酸钠,激活固有免疫并趋化中性粒细胞,释放细胞因子,产生爆发式级联扩增反应,激活炎症信号通路,最终引发痛风急性炎症[36]。近些年,NOD 样受体在固有免疫介导的炎症反应中发挥的作用越来越被重视,其中,NLRP3 炎症小体是不可忽视的重要蛋白。NLRP3 是NOD 样蛋白受体家族中的重要成员,可识别并结合如尿酸盐晶体等危险信号,通过活化caspase-1、促进炎性因子释放等促进炎症反应的进行[27]。研究发现,痛风疾病发生的必要条件是NLRP3 以及凋亡相关斑点样蛋白的参与,否则炎症不会发生,此研究进一步证明了NLRP3 在GA 发生发展过程中起到了关键的作用[37]。张志明等[38]研究表明,急性痛风患者的NLRP3 mRNA 表达水平高于缓解期痛风患者。由此可见,GA 疾病的发生过程涉及多个靶点,有多个生物学过程以及多条通路的参与,“川牛膝-土茯苓”药对可能通过IL-17 信号通路、TNF 信号通路、Th17 细胞分化、Toll 样受体信号通路、NOD 样受体信号通路等发挥抗炎、调控细胞凋亡、抗氧化应激等功能,进而起到治疗GA的作用。
综上所述,本研究利用网络药理学对“土茯苓-川牛膝”药对治疗GA 的作用机制进行预测,发现其主要通过IL-17 信号通路、TNF 信号通路、Toll 样受体信号通路、NOD 样受体信号通路、Th17细胞分化等途径发挥抗炎、调控细胞凋亡、抗氧化应激等作用治疗GA,抑制炎症反应,这体现了中医药治疗疾病多成分、多靶点、多通路的特点。同时预测结果与已知实验结果相吻合,提示本研究所预测的靶点和通路具有可行性,为进一步研究“土茯苓-川牛膝”药对治疗GA 的作用机制提供理论基础和科学依据。

