白芍总苷对腹泻型肠易激综合征大鼠5-HT 信号通路的影响∗
孙燕宁,符梅竹
1 临高县人民医院,海南 临高 571800; 2 海南医学院第一附属医院,海南 海口 570102
肠易激综合征(irritable bowel syndrome,IBS)为不伴消化道器质性改变或生化异常的胃肠功能紊乱性疾病,是以持续或间歇发作的大便性状或排便习惯改变、腹痛、腹胀等为主要表现的临床综合征[1]。根据临表现可将IBS 分为腹泻型(predominant irritable bowel syndrome,IBS-D)、便秘型、混合型以及未定型,IBS-D 约占74.1%,属于最为常见的类型。IBS在20~50岁中青年人群中多见,女性多于男性。流行病学研究发现,全世界IBS 发病率为11%~30%,我国约为5%~6%[2-3],近年来有逐年增多的趋势,严重影响患者的正常工作、生活。在临床中,西医主要采用饮食调整、解痉剂、益生菌、止泻药、益生菌等进行对症治疗。中医药从整体观念出发,在该病的治疗方面积累了丰富的临床经验。白芍总苷为中药白芍的活性成分。石君杰等[4]研究认为,高剂量白芍总苷治疗IBS 大鼠的疗效与匹维溴铵接近,但关于其治疗IBS-D 的相关研究较少。本次研究主要探讨白芍总苷对IBS-D 模型大鼠5-羟色胺(5-hydroxytryptamine,5-HT)的影响,现报道如下:
1 资料与方法
1.1 实验动物无特定病原体SPF 级健康成年Wistar大鼠68只,雌雄各半,体质量180~220 g,平均(203.26±11.29)g,购自广东省医学实验动物中心,实验动物许可证号:SCXK(粤)2018-0002。大鼠分笼饲养于温度23~27 ℃、湿度60%、安静通风的动物房内,昼夜规律为12 h,大鼠自由饮水、进食、活动,饮用水为自来水,饲料为标准颗粒饲料。实验经过医院伦理委员会批准(伦理批号:2018011004)。
1.2 药品及试剂白芍总苷(CAS 号:23180-57-6,纯度≥98%,西安立森生物科技有限公司,规格:20 mg/瓶),采用蒸馏水配制成浓度为5、10 mg/mL的白芍总苷溶液,现用现配。匹维溴铵片(法国Abbott Healthcare SAS 公司,批号:20190216,50 mg/片),使用时研碎成末,用蒸馏水配制成浓度为3.75 mg/mL 的匹维溴铵混悬液,现用现配。磷酸盐缓冲液(PBS)、含吐温20 的Tris 盐酸缓冲液(TBST)(南京赛泓瑞生物科技有限公司);5-HT免疫组化试剂盒(武汉博士德生物工程有限公司);二氨基联苯胺(DAB)显色试剂盒(北京凯瑞基生物科技有限公司);RIPA 组织裂解液(上海易汇生物科技有限公司);兔抗鼠色氨酸羟化酶1(Tryptophan hydroxylase1,TPH-1)、5-羟色胺受体3(5-HT3 receptors,5-HT3R)、5-羟色胺转运蛋白(serotonin transporter,SERT)、β-肌动蛋白(β-actin)多克隆抗体、羊抗兔IgG-HRP(辣根过氧化物酶标记抗体)(杭州昊鑫生物科技股份有限公司);十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶制备试剂盒(南京善本生物科技有限公司);ECL化学发光检测试剂盒(环亚生物科技有限公司)。
1.3 仪器TGL-16R 型离心机(珠海黑马医学仪器有限公司);ZT-12P 生物组织自动脱水机(孝感亚光医用电子技术有限公司);EM-3000 型光学显微镜(日本多美公司);TP-214 型电子分析天平(美国丹佛仪器有限公司);JS-power300 型电泳仪(上海培清科技有限公司);VE-186 型转移电泳槽(上海天能科技有限公司)。
1.4 实验方法
1.4.1 造模[5]及分组 进行为期5天的适应性饲养后,将所有大鼠随机分为正常组13 只和造模组55 只。正常组大鼠正常饲养,造模组大鼠每日用固定笼束缚1 h,同时随机给予以下刺激中的1种,而且连续2 天不给予同种刺激:禁食或禁水24 h;夹尾至大鼠发出嘶叫1 min;置于40 ℃环境内5 min;水平震荡45 min(频率每分钟150次,幅度10 cm);置于4 ℃水内游泳3 min。持续刺激21天后,若造模组大鼠体质量增长低于正常组,24 h Bristol粪便评分[6]为6~7 分,腹壁撤退反射(AWR)评分明显高于正常组,即认为成功建立IBS-D模型。
将造模成功的52 只大鼠随机分为模型组、匹维溴铵组及白芍总苷低、高剂量组,每组13 只。模型组、正常组分别给予蒸馏水0.1 mL/10 g 灌胃,每日1次;匹维溴铵组给予3.75 mg/mL匹维溴铵混悬液0.1 mL/10 g 灌胃,每日1 次;白芍总苷低、高剂量组分别给予5、10 mg/mL 白芍总苷溶液0.1 mL/10 g灌胃,每日1次。各组连续治疗14天。1.4.2 标本采集与处理 肠道敏感性测定结束后,处死大鼠,迅速打开腹腔取结肠组织,4 ℃生理盐水冲洗干净,其中1/2 段组织采用4%多聚甲醛固定24 h,经自动脱水机脱水后石蜡包埋,制备4 μm组织切片,用于免疫组化染色;剩余结肠组织采用液氮冻存,用于蛋白质免疫印迹(Western blot)检测。
1.5 观察指标
1.5.1 大鼠粪便含水量检测 末次给药后,采用代谢笼收集大鼠24 h 粪便,迅速称量湿重,然后烘干,称量干重,依据公式计算粪便含水量:
粪便含水量(%)=(1-粪便干重/粪便湿重)×100%
1.5.2 大鼠肠道敏感性测定[7]粪便含水量检测结束后,所有大鼠禁食不禁水24 h,将大鼠置于固定透明塑料盒内,使之无法转身,仅将尾部露出,采用乙醚麻醉大鼠,用石蜡油润滑肛门,将带球囊的导尿管插入5 cm,固定在尾巴上;大鼠苏醒后30 min,将导尿管与血压计袖带充气管连接、密封,挤压气囊,观察大鼠在40 mmHg(1 mm Hg≈0.133 kPa)、60 mm Hg压力下的结直肠扩张时AWR评分,每次扩张20 s,每种压力测量3 次,取平均值。结直肠扩张时AWR 评分标准[8]:大鼠无反应,计0分;头部短暂静止,计1分;腹部收缩但不抬离桌面,计2 分;腹部收缩且抬离桌面,计3 分;身体呈弓形,骨盆抬高,计4分。
1.5.3 免疫组化法检测大鼠结肠组织5-HT 表达水平[9]取“1.4.2”项中制备的组织切片,常规脱蜡水化,蒸馏水冲洗3次,每次5 min;然后置于3%过氧化氢溶液内8 min,以去除内源性过氧化氢酶,蒸馏水冲洗3 次,每次5 min;PBS 冲洗3 次,每次5 min,置于0.01 mmol/L 枸橼酸缓冲液内(PH=6.0),微波炉高火加热10 min 进行抗原修复;恢复至室温后,PBS 冲洗3 次,每次5 min,按照免疫组化试剂盒说明中的步骤,滴加兔抗鼠5-HT 一抗(1∶100稀释),4 ℃反应16 h;PBS冲洗3 次,每次3 min,滴加二抗,室温反应30 min;PBS 冲洗3次,每次3 min,采用DAB试剂盒进行显色;自来水冲洗后,采用苏木素染液复染;常规脱水、透明、中性树胶封固。在光学显微镜下观察染色结果,5-HT 阳性细胞呈棕黄色或黄色,每张切片于400×镜下随机选择5 个不重复视野,计数5-HT 阳性细胞个数,计算平均值。
1.5.4 Western Blot 法检测大鼠结肠组织TPH-1、5-HT3R、SERT 表达水平[10]取“1.4.2”项中冻存的结肠组织,加入9倍体积预冷的RIPA裂解液,电动匀浆器匀浆,冰上裂解30 min,4 ℃条件下,离心半径:15 cm,以13 000 r/min 离心20 min,用超微核酸蛋白检测仪检测上清液总蛋白浓度,采用5×还原样品缓冲液将蛋白样品浓度调整为4 mg/mL,100 ℃沸水浴5 min 后等待上样;配制SDS-PAGE12%分离胶和5%浓缩胶,灌注于电泳槽内;取蛋白样品每孔加样20 μg,应用湿转法转膜,电流300 mA,时间1 h,转印并将NC 膜浸没于3%牛血清白蛋白内,进行封闭,添加入TPH-1、5-HT3R、SERT 及β-actin 一抗、二抗内;TBST 洗涤6 次,每次3 min;ECL发光液铺于NC膜并于暗室内曝光、显影、定影。采集蛋白条带图像,用NIH Image 软件分析各蛋白条带光密度值(OD 值),计算TPH-1、5-HT3R、SERT相对于β-actin的表达量。
1.6 统计学方法采用SPSS 22.0 软件包分析,符合正态性的计量资料采用±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠粪便含水量与正常组比较,模型组大鼠粪便含水量显著升高,差异有统计学意义(P<0.05)。与模型组比较,白芍总苷低、高剂量组和匹维溴铵组大鼠粪便含水量较低,且白芍总苷低剂量组>白芍总苷高剂量组和匹维溴铵组,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠粪便含水量、AWR评分及5-HT阳性细胞数量比较(±s)
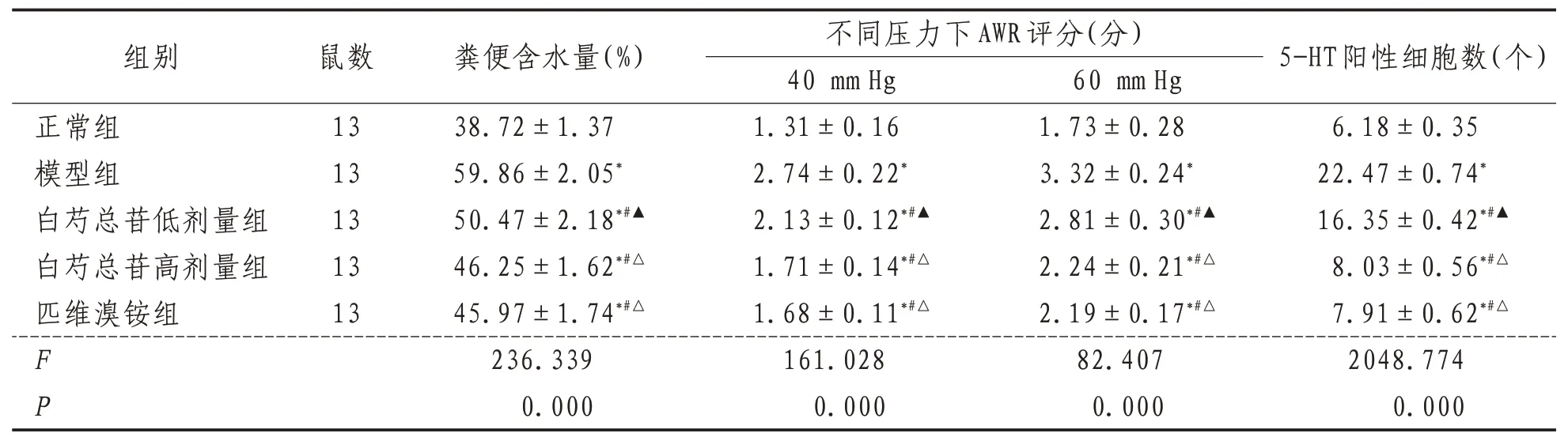
表1 各组大鼠粪便含水量、AWR评分及5-HT阳性细胞数量比较(±s)
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;△表示与白芍总苷低剂量组比较,P<0.05;▲表示与白芍总苷高剂量组比较,P<0.05
组别鼠数不同压力下AWR评分(分)40 mm Hg 粪便含水量(%)60 mm Hg 5-HT阳性细胞数(个)正常组模型组白芍总苷低剂量组白芍总苷高剂量组匹维溴铵组13 13 13 13 13 1.31±0.16 2.74±0.22*2.13±0.12*#▲1.71±0.14*#△1.68±0.11*#△161.028 0.000 38.72±1.37 59.86±2.05*50.47±2.18*#▲46.25±1.62*#△45.97±1.74*#△236.339 0.000 F P 1.73±0.28 3.32±0.24*2.81±0.30*#▲2.24±0.21*#△2.19±0.17*#△82.407 0.000 6.18±0.35 22.47±0.74*16.35±0.42*#▲8.03±0.56*#△7.91±0.62*#△2048.774 0.000
2.2 不同压力下大鼠AWR 评分与正常组比较,模型组大鼠40、60 mm Hg 压力下AWR 评分显著升高,差异有统计学意义(P<0.05)。与模型组比较,白芍总苷低、高剂量组和匹维溴铵组大鼠40、60 mm Hg 压力下AWR 评分较低,且白芍总苷低剂量组>白芍总苷高剂量组和匹维溴铵组,差异有统计学意义(P<0.05)。见表1。
2.3 大鼠结肠组织5-HT 表达水平比较免疫组化染色结果显示,5-HT 阳性细胞主要分布于结肠黏膜肌层、固有层和黏膜下层,各组阳性细胞数目及染色程度不同。半定量分析显示,与正常组比较,模型组大鼠结肠组织5-HT 阳性细胞数明显增加,差异有统计学意义(P<0.05)。与模型组比较,白芍总苷低、高剂量组和匹维溴铵组大鼠结肠组织5-HT 阳性细胞数均较低,且白芍总苷低剂量组>白芍总苷高剂量组和匹维溴铵组,差异有统计学意义(P<0.05)。见表1、图1。
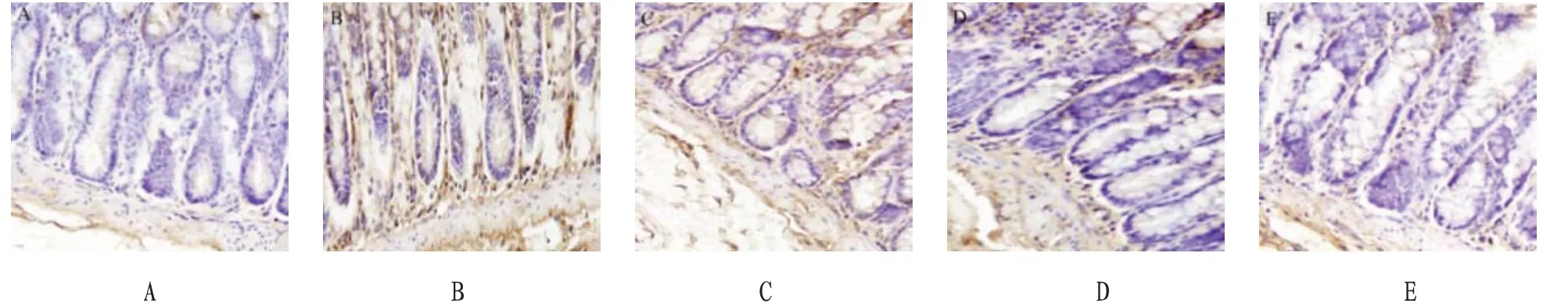
图1 各组大鼠结肠组织5-HT表达结果(免疫组化染色,×400)
2.4 大鼠结肠组织TPH-1、5-HT3R、SERT 表达水平与正常组比较,模型组大鼠结肠组织TPH-1、5-HT3R 表达水平明显升高,SERT 表达水平显著降低,差异有统计学意义(P<0.05)。与模型组比较,白芍总苷低、高剂量组和匹维溴铵组大鼠结肠组织TPH-1、5-HT3R 表达水平均较低,且白芍总苷低剂量组>白芍总苷高剂量组和匹维溴铵组,差异有统计学意义(P<0.05)。与模型组比较,白芍总苷低、高剂量组和匹维溴铵组大鼠结肠组织SERT 表达水平较高,且白芍总苷低剂量组<白芍总苷高剂量组和匹维溴铵组,差异有统计学意义(P<0.05)。见表2,图2。
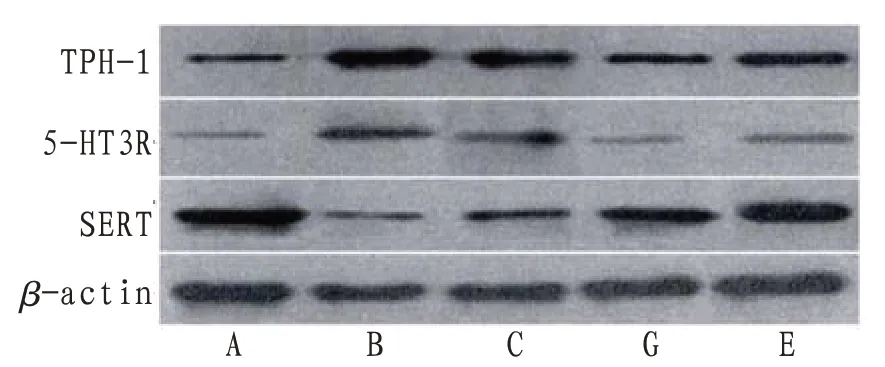
图2 各组大鼠结肠组织TPH-1、5-HT3R、SERT表达电泳图
表2 各组大鼠结肠组织TPH-1、5-HT3R、SERT表达水平比较(±s)
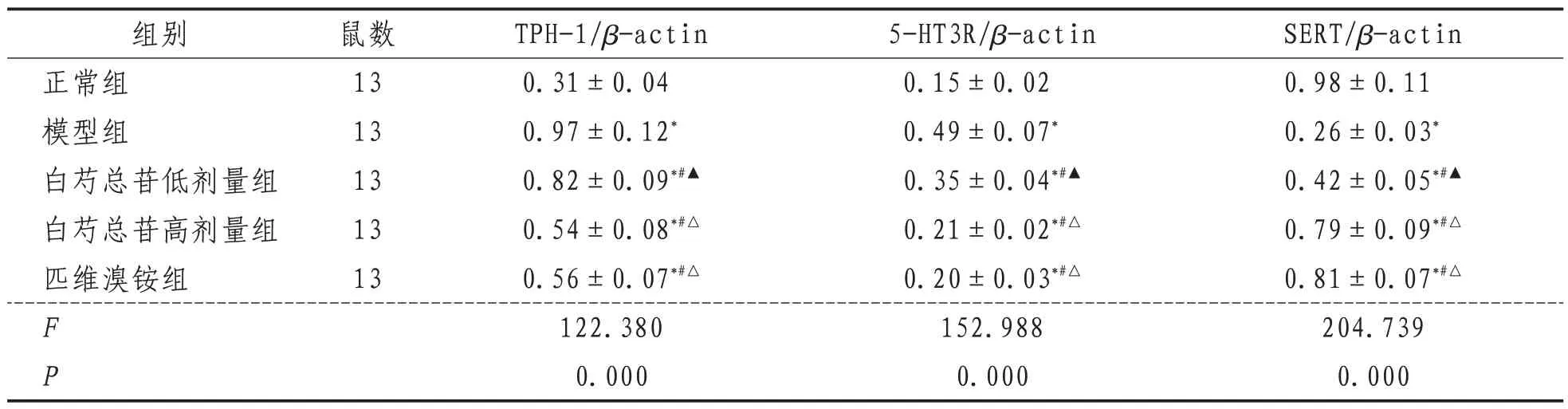
表2 各组大鼠结肠组织TPH-1、5-HT3R、SERT表达水平比较(±s)
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;△表示与白芍总苷低剂量组比较,P<0.05;▲表示与白芍总苷高剂量组比较,P<0.05
SERT/β-actin 0.98±0.11 0.26±0.03*0.42±0.05*#▲0.79±0.09*#△0.81±0.07*#△204.739 0.000组别正常组模型组白芍总苷低剂量组白芍总苷高剂量组匹维溴铵组鼠数13 13 13 13 13 F P TPH-1/β-actin 0.31±0.04 0.97±0.12*0.82±0.09*#▲0.54±0.08*#△0.56±0.07*#△122.380 0.000 5-HT3R/β-actin 0.15±0.02 0.49±0.07*0.35±0.04*#▲0.21±0.02*#△0.20±0.03*#△152.988 0.000
3 讨论
IBS-D 的发生是精神心理状态、性别、遗传、饮食习惯、社会环境等多种病理因素影响的结果,发病机制尚不明确,主要涉及胃肠动力异常、内脏高敏感性、肠道感染、脑-肠轴与胃肠激素异常等方面[11]。5-HT 属于常见的脑肠神经递质和信号分子,在胃肠动力、内脏敏感性等的调节方面均发挥着重要作用,其受体也参与IBS-D的发生发展的过程。燕李晨等[12]研究称,5-HT在IBS的发病机制中起到关键作用,将调控5-HT 信号系统作为靶点的药物为IBS防治研究提供了新的方向。
中医认为,IBS-D 属于“腹痛”“泄泻”“郁证”等范畴[13],病位在肠,主要病机为肝郁、脾虚、湿盛,肝气郁结,伐克脾土,脾虚运化失司,水湿不化,清泻而下,发为本病。研究表明,白芍是中医药治疗IBS 中使用频率较高的药物[14]。此外,白芍总苷还具有调消炎镇痛、抑制自身免疫反应、抗抑郁、肝肾保护等多种作用[15]。李祥鸿等[16]研究认为,芍药苷能通过上调紧密连接蛋白ZO-1 和核因子抑制蛋白κB 而缓解IBS。李瑜等[17]研究称,芍药苷能有效降低IBS 模型大鼠结肠频率,使结肠肌峰电位、峰面积、峰峰值等降低,降低肠道敏感性,对IBS大鼠发挥治疗作用。
本研究结果表明,与模型组比较,各用药组大鼠粪便含水量较低,40、60 mm Hg压力下AWR评分较低,且白芍总苷低剂量组>白芍总苷高剂量组和匹维溴铵组,证实了白芍总苷可改善IBS大鼠粪便性状,减轻腹泻,同时降低肠道敏感性,治疗效果与匹维溴铵相当,且白芍总苷呈现一定的量效关系。
TPH-1、5-HT3R、SERT 均为5-HT 信号通路中的重要分子。TPH-1 分布于胃肠道中,为5-HT 生物合成的限速酶,可直接影响5-HT 的代谢功能,降低其表达水平对于减少5-HT 合成有积极意义。5-HT3R 是导致内脏高敏感发生的重要机制之一[18]。SERT 为调控5-HT再摄取的跨膜转运蛋白,能促进5-HT 重新进入突触前神经末梢,使之失活,减少5-HT 堆积,进而影响肠道感觉和功能。有研究发现,IBS-D 患者结肠5-HT 含量高于对照组,SERT阳性率低于对照组,SERT表达降低或缺失可致5-HT 灭活不足,这与IBS 发病机制有关[19-22]。本研究结果显示,与模型组比较,各给药组大鼠结肠组织5-HT 阳性细胞数及TPH-1、5-HT3R 表达水平均较低,SERT表达水平较高,且白芍总苷高剂量组和匹维溴铵组改变与模型组差异最明显,表明白芍总苷能下调结肠组织TPH-1、5-HT3R 表达,上调SERT表达,降低5-HT水平,这可能是白芍总苷改善IBS大鼠肠道敏感性,治疗IBS的作用机制之一。
综上所述,白芍总苷能剂量依赖性地改善IBS-D 大鼠神腹泻症状,降低肠道敏感性,抑制结肠组织5-HT表达,其作用可能与调节5-HT信号通路中的TPH-1、5-HT3R、SERT表达有关。

