microRNA-31、Gas6和Axl在食管鳞状细胞癌中的表达及临床意义
段有升,王 路,张丽娜
(新疆巴州人民医院1.放疗科2.检验科,新疆 库尔勒 841000)
食管鳞状细胞癌(ESCC)是食管癌常见病理类型之一,且占比较大。随着人们生活方式的日益转变以及人口老龄化趋势的加剧,ESCC 的发病率正呈逐年攀升的趋势[1]。由于ESCC 患者发病早期症状相对隐匿,从而使得大多数患者首次确诊便已是中晚期,失去了治疗的最佳时机,导致预后不良[2]。如何有效预测ESCC 患者的预后是广大医务工作者共同关注的热点。微小RNA(miRNA)是近年来人类新发现的一类非编码单链RNA[3],在细胞增殖、分化、凋亡等过程中发挥着至关重要的调控作用,可能与肿瘤的发生和进展息息相关。microRNA-31 是miRNA 家族的重要成员之一[4],可能参与了肿瘤恶性生物学行为的调控过程。Gas6 和Axl 已被证实在多种肿瘤组织以及细胞中高表达[5],上皮- 间质转化(epithelial mesenchymal transition,EMT)的一些转录因子可被Gas6/Axl 复合物激活,Gas6 与 Axl 的绑定(Gas6/Axl复合物)可能通过调控上皮- 间质转化有关转录因子的活性,进一步参与肿瘤细胞侵袭、转移等过程[6]。癌胚抗原(CEA)、鳞状细胞癌相关抗原(SCC)、细胞角蛋白19 片段抗原21-1(CYFRA21-1)作为肿瘤预后的有效生物学监测指标,目前已被广泛应用于临床肿瘤预后预测中。本文主要是研究microRNA-31、Gas6 和Axl 在ESCC 中的表达及其与患者预后和CEA、SCC、CYFRA21-1 的相关性。
1 资料与方法
1.1 一般资料
回顾性分析新疆巴州人民医院2017 年1 月至2017 年8 月收治的80 例ESCC 患者的病历资料。其中男性47 例,女性33 例;年龄41 ~78 岁,平均(62.34±6.28)岁;接受文化教育年限6 ~16 年,平均(10.49±1.38)年;体质指数19 ~32 kg/m²,平均(23.15±1.22)kg/m²;TNM 分期:Ⅰ~Ⅱ期31 例,Ⅲ~Ⅳ期49 例。入组标准:(1)受试者经病理检查确诊;(2)入组前并未接受相关治疗;(3)临床资料完整;(4)可正常交流沟通。排除标准:(1)合并其他恶性病变;(2)心、肺、脑等脏器发生重大病变;(3)存在精神障碍;(4)治疗期间因故退出或失访。所有患者或患者家属均已签署同意书,研究获得医院伦理委员会批准。无菌条件下收集癌组织及癌旁正常食管组织(距离癌组织>3 cm),各80 例。
1.2 研究方法
(1)microRNA-31 检测:分别于患者手术后采集癌组织以及癌旁正常组织,根据miRNA easy 迷你试剂盒说明书完成总RNA 的提取,并以紫外分光光度计完成RNA 浓度、纯度的测量,光密度值A260/A280 >1.8 为最佳。随后使用Prime Script miRNA cDNA 合成试剂盒完成cDNA 合成,一应操作均遵循试剂盒说明书完成。之后开展PCR 扩增,借助ABI 7500 PCR 仪完成扩增,反应体系20 μL,所有样本重复测量3 次,以平均值作为最终结果。反应参数:50 ℃ 5 s,60 ℃ 34 s,共40 个循环。然后制作溶解曲线,参数如下:95 ℃ 15 s,60 ℃ 60 s,85 ℃ 15 s,60 ℃15 s。根据2-△△Ct法计算相对表达量。引物序列如下:上游:5'-TGTTTTGAGCGGGGGTCAAGAGC-3',下 游:5'-CTCTCATTTGCTATATTCA-3'。(2)Gas6、Axl 表达检测:检测方式选用免疫组织化学法,首先取切片完成石蜡包埋处理,之后进行脱水、抗原修复、血清封闭,滴加鼠抗人Gas6(1:200)、Axl(1:250)以及二抗孵育观察。依次放入梯度酒精及二甲苯。显微镜100 倍视野下随机选取10 个视野。染色结果取染色强度( 0: 无染色,1: 轻度,2: 中度,3: 高度) 和染 色 范 围( 0 为1% ~9% ; 1 为10% ~24% ; 2 为25% ~50% ; 3 为51% ~75% ; 4 为>75% ) 乘积。两项评分乘积≥3 为阳性表达,乘积<3 为阴性表达。(3)血清CEA、SCC、CYFRA21-1 水平检测:术前采集所有患者空腹静脉血3 mL,离心处理后送检。离心参数:半径8 cm,速率以3500 r/min 为宜,时长选择10 min。其中CEA 及CYFRA21-1 水平的检测借助Elecsys2010 仪器完成,相关试剂及仪器均购自瑞士罗氏公司,检测方式选用电发光免疫测定法。SCC水平的检测借助美国Abbott 公司的IM x System 进行,具体操作遵循仪器及试剂盒说明书完成。(4)分组方式:对所有患者均开展5 年的随访观察,随访方式采用门诊、电话结合的方法,随访截止时间为2022 年10 月1 日,无失访患者。将患者按照预后状况的差异分作死亡组32 例及存活组48 例。死亡组32 例患者中有Ⅰ~Ⅱ期患者13 例,Ⅲ~Ⅳ期患者19 例,占比差异无统计学意义(χ²=0.079,P>0.05)。
1.3 统计学方法
2 结果
2.1 microRNA-31、Gas6 和Axl 在不同食管组织中的表达对比
ESCC 组织中microRNA-31、Gas6 和Axl 的表达水平均高于癌旁正常组织(P<0.05),见表1。Gas6和Axl 在食管癌组织中呈现强阳性表达,而在正常食管组织中低表达,见图1。
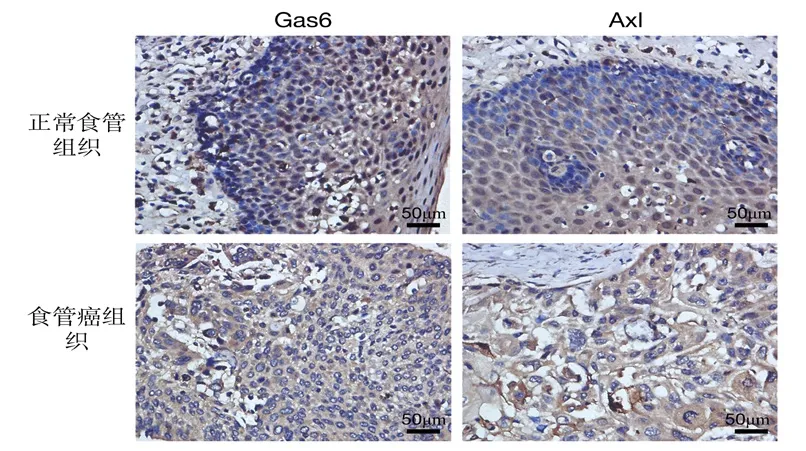
图1 Gas6 和Axl 在食管癌组织、正常食管组织中的表达情况(SP法,40 倍)
表1 microRNA-31、Gas6 和Axl 在不同食管组织中的表达对比(± s)
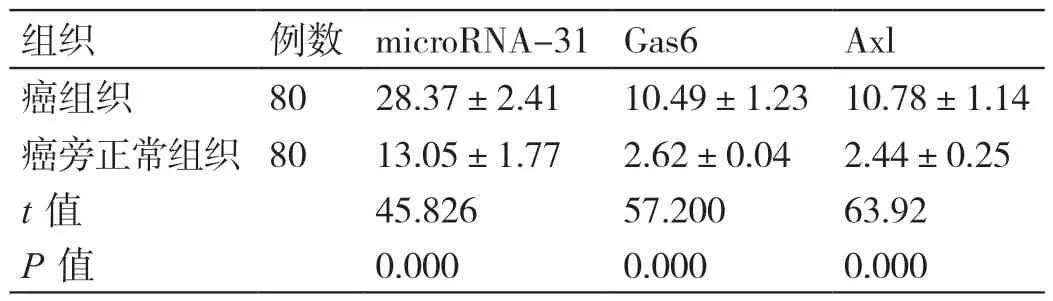
表1 microRNA-31、Gas6 和Axl 在不同食管组织中的表达对比(± s)
组织 例数 microRNA-31 Gas6 Axl癌组织 80 28.37±2.41 10.49±1.23 10.78±1.14癌旁正常组织 80 13.05±1.77 2.62±0.04 2.44±0.25 t 值 45.826 57.200 63.92 P 值 0.000 0.000 0.000
2.2 microRNA-31、Gas6 和Axl 表达与ESCC患者预后的关系分析
ESCC 死亡患者microRNA-31、Gas6 和Axl 的表达水平均高于存活患者(P<0.05),见表2。
表2 microRNA-31、Gas6 和Axl 表达与ESCC 患者预后的关系分析(± s)
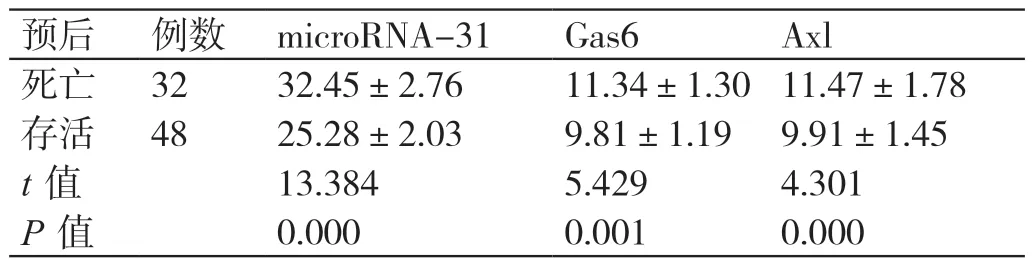
表2 microRNA-31、Gas6 和Axl 表达与ESCC 患者预后的关系分析(± s)
预后 例数 microRNA-31 Gas6 Axl死亡 32 32.45±2.76 11.34±1.30 11.47±1.78存活 48 25.28±2.03 9.81±1.19 9.91±1.45 t 值 13.384 5.429 4.301 P 值 0.000 0.001 0.000
2.3 CEA、SCC、CYFRA21-1 表达与ESCC 患者预后的关系分析
ESCC 死亡患者的CEA、SCC、CYFRA21-1 表达水平分别为(14.79±1.59)ng/mL、(1.52±0.24)ng/mL、(3.92±0.15)ng/mL,均高于存活患者的(3.48±1.01)ng/mL、(0.68±0.08)ng/mL、(2.24±0.07)ng/mL(P<0.05),见表3。
表3 CEA、SCC、CYFRA21-1 表达与ESCC 患者预后的关系分析(ng/mL,± s)
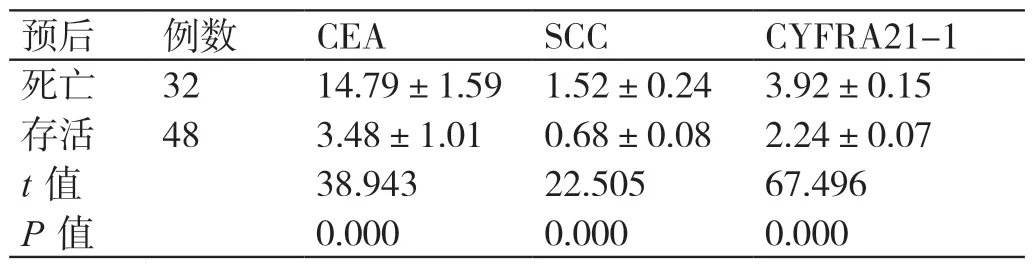
表3 CEA、SCC、CYFRA21-1 表达与ESCC 患者预后的关系分析(ng/mL,± s)
预后 例数 CEA SCC CYFRA21-1死亡 32 14.79±1.59 1.52±0.24 3.92±0.15存活 48 3.48±1.01 0.68±0.08 2.24±0.07 t 值 38.943 22.505 67.496 P 值 0.000 0.000 0.000
2.4 ESCC 患者microRNA-31、Gas6、Axl 表达与CEA、SCC、CYFRA21-1 的相关性分析
ESCC 患者microRNA-31、Gas6、Axl 的表达与CEA、SCC、CYFRA21-1 表达水平均呈正相关关系(P<0.05),见表4。
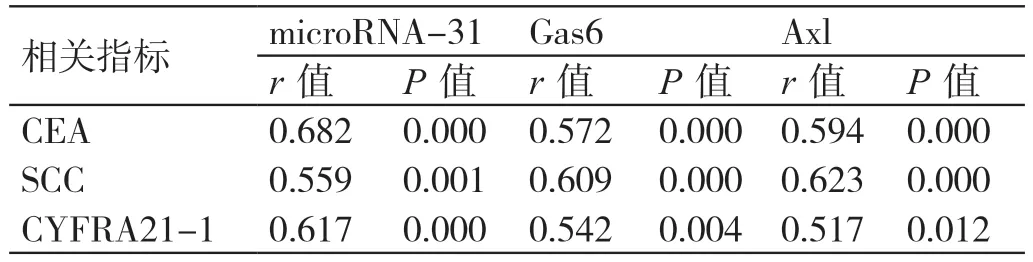
表4 ESCC 患者microRNA-31、Gas6、Axl 表达与CEA、SCC、CYFRA21-1 的相关性分析
3 讨论
ESCC 具有症状隐匿的特点,部分患者直至疾病晚期仍无明显症状表现,从而导致其临床早期检出率较低,预后不良[7]。临床上亟需寻找可在病变早期特异性识别ESCC 的分子标志物,以便为相关临床早期诊断和预后评估提供指导依据。不少研究证实,miRNA在调控肿瘤相关基因表达的同时,其自身亦可发挥促癌或抑癌基因的功能[8-9]。其中microRNA-31 在差异性肿瘤中的表达不同,如在结直肠癌以及肺癌中普遍存在高表达,而在乳腺癌及卵巢癌中存在低表达,且在腺癌和鳞癌中的表达亦明显不同。故此,通过研究microRNA-31 在ESCC 中的表达及其与患者预后的相关性有助于相关临床早期诊断和预后评估。有研究指出,Gas6、Axl 在血液肿瘤以及其他实体恶性病变中存在异常高表达[10-11],而这是肿瘤预后不良的独立危险因素。本研究结果显示,ESCC 组织中microRNA-31、Gas6 和Axl 表达水平均高于癌旁正常组织。提示microRNA-31、Gas6 和Axl 在ESCC患者中均存在异常高表达。究其原因,microRNA-31可能通过靶向调控多种下游靶基因或(和)蛋白的表达,进一步发挥促癌基因的作用,介导了ESCC 的发生、发展过程[12]。而Gas6 和Axl 可能通过表皮生长因子受体进行相关调控,进一步促进了疾病的侵袭、转移过程,发挥了促癌基因作用[13]。冯儒学等[14]的研究发现,microRNA-31 在晚期肿瘤患者中存在异常高表达,这为本文提供了强有力的佐证。另外,ESCC 死 亡 患 者microRNA-31、Gas6 和Axl 表达水平均高于存活患者。证实了上述三项指标表达水平和ESCC 患者的预后密切相关,即随着其表达水平的升高,ESCC 患者预后不良的风险也会升高。考虑其原因是,microRNA-31 的异常高表达会直接导致其靶基因出现致瘤性改变,促进肿瘤的侵袭转移,进一步导致临床治疗难度的增加,对预后造成负面影响[15]。Gas6 和Axl 可调节肿瘤细胞的侵袭、迁移能力,从而促进病情的加剧,导致预后不良[16]。此外,ESCC 死亡患者的CEA、SCC、CYFRA21-1 表达水平均高于存活患者。这反映了随着血清CEA、SCC 及CYFRA21-1 表达水平的升高,ESCC 患者的预后会变差。分析其原因是,上述三项血清学指标在ESCC患者中的表达水平高低受临床分期、分化程度以及浸润情况的影响,其中肿瘤分期晚、病灶大、浸润程度深,会导致肿瘤组织凋亡后溶解释放至血液中的相关标志物增多,导致预后相对较差。本文结果还显示了ESCC 患者microRNA-31、Gas6、Axl 的表达与CEA、SCC、CYFRA21-1 表达水平均呈正相关。原因可能是microRNA-31、Gas6、Axl 的异常高表达会促进肿瘤的增殖、分化、侵袭、转移,继而引起血清中CEA、SCC 及CYFRA21-1 含量的增多。
综上所述,microRNA-31、Gas6 和Axl 在ESCC中均呈异常高表达,且随着其表达水平的升高,ESCC患者的预后会变差,联合CEA、SCC、CYFRA21-1水平检测可作为有效预测ESCC 患者预后的手段。本文存在一定的不足之处:如未对不同临床分期、治疗方式患者进行分组对比研究,从而可能引起研究结果的偏倚,这有待在今后的研究中予以完善。

