骨/软骨类器官构建策略及应用前景
白 龙, 苏佳灿
(上海大学转化医学研究院, 上海 200444)
伴随我国老龄化社会的加速到来, 材料科学和生物医学技术的迅猛发展以及人们生活水平、医疗保健、康复水平的显著提高, 人们对人体组织器官修复和置换等方面的需求日益迫切[1]. 由创伤、感染、肿瘤等重大疾病导致的各类骨/软骨损伤修复, 一直也是骨科医生面临的巨大挑战[2]. 近年来, 骨组织工程的兴起为骨/软骨损伤的修复治疗开辟了全新的研究方向.骨形成相关活性因子/细胞与生物活性材料支架载体的有机复合, 是骨组织工程构建的起始和关键, 也是目前国内外研究的热点[3-4]. 然而, 传统骨组织工程的设计原则缺乏生物材料对骨组织形成过程中不同阶段、多种细胞、特异微环境等多维度、多层次的有序调控, 无法有效诱导空间化骨微环境特征, 成骨/软骨效果有限, 进而极大地限制其引导骨/软骨再生的活性. 此外, 骨组织工程的研究缺乏接近人体骨组织本身特性的体外模型, 支架材料和种子细胞的筛选单一依靠体内测试, 周期长、成本高, 无法满足现实科研和临床需求. 因此, 亟需开发能够促进骨/软骨组织有序再生修复的新技术.
类器官是近年来发展起来的新兴生物技术, 主要通过干细胞自组织方式, 在体外三维(three dimension, 3D) 培养条件下诱导分化形成有功能的组织复合体[5-6]. 类器官具有来源组织或器官的部分关键结构和功能特征. 迄今为止, 研究者已成功建立了一系列人体组织(如脑、肝、肾、肠、皮肤、骨骼、血管) 类器官模型. 类器官技术在器官发育、疾病模拟、精准医学、药物筛选和再生医学等领域显示出广泛应用前景, 2017 年被Nature Methods 列为年度技术[7]. 骨髓干细胞或骨内膜细胞通过增殖、分化得到骨类器官(如骨小梁、软骨等类器官), 这些骨类器官表现出与自然骨类似的生理和结构特征, 如呈现特定的生理氧和代谢梯度、维持胞外和细胞间的连接等特点[8-9]. 然而, 与心、脑等组织类器官相比较, 骨类器官研究尚处于起步阶段. 本工作系统总结了骨/软骨类器官发展历程、构建策略、评价表征、机制探索以及临床应用等方面的前沿进展, 通过举例分别简述了骨和软骨类器官的构建过程, 最后对骨/软骨类器官发展可能遇到的问题和方向进行了总结和展望.
1 类器官
类器官是指人类成体干细胞或多能干细胞经体外3D 培养后, 自诱导形成的带有特定结构和功能的细胞簇. 这一类器官虽不能称为真正意义上的人体器官, 其却能从构造与功能上与人体真实器官高度相似, 并可在体外持续稳定传代培养. 过去10 年中, 类器官的发展被誉为干细胞研究中最令人振奋的进展之一. 正如交通方式的更迭, 从人力时代的马车, 到蒸汽时代和电力时代的火车, 再到目前新时代的飞机汽车, 生命科学领域的研究模型也在不断更迭, 从初代的细胞培养、1.0 时代的动物模型、1.5 时代的器官芯片, 已然进步到目前2.0 时代的类器官(见图1). 器官芯片虽然在药物筛选和安全性评估中极具发展潜力, 但其存在明显缺陷.目前器官芯片存在细胞来源少、干细胞分化不稳定、芯片细胞种类单一、体外培养无法长时间培养等问题, 这些导致器官芯片的仿真程度仍然有限. 此外, 构建芯片所需聚二甲基硅氧烷(polydimethylsiloxane, PDMS) 材料存在疏水问题, 芯片制备方式多样不统一无规范, 制造成本高无法量产. 最近提出的类器官芯片(organoid-on-a-chip) 概念与器官芯片类似, 只是在体外培养, 突出使用的是具有三维结构的类器官而不是单纯二维培养的细胞. 类器官芯片作为器官芯片的重要发展方向之一, 伴随类器官技术的发展, 有望成为未来药物开发、筛选和安全性评估的重要平台.

图1 交通方式与生命科学研究模型更迭的对比Fig.1 Comparison of transportation modes and evolution of research models
早在20 世纪80 年代, “类器官” 一词便已提出, 但直到2009 年, 荷兰科学家Hans 团队首次将肠道干细胞在体外培养成具有类肠的隐窝状和绒毛状上皮区域的3D 结构, 即小肠类器官(small-intestinal organoids), 由此开启了类器官的研究[10]. 此后, 类器官研究步入高速发展期. 目前, 多种类器官已在体外被成功构建, 包括大脑、肾脏、胃、小肠、卵巢、结肠、肺、膀胱、肝脏、胰腺、食道、心脏等正常组织及相应的肿瘤组织类器官[11-12].
类器官技术作为一种全新的前沿科技, 在多个研究应用领域中极具发展潜力, 包括发育机理学、疾病病理学、细胞生物学、再生医学、精准医学, 以及研究药品毒性与药效等试验领域[5,13]. 类器官技术的发展为人类健康研究和新药筛选创造了一个全新平台, 这也是对目前二维细胞培养和动物模型策略的高信息量互补. 另外, 利用类器官技术可以获得最贴近真实人类健康细胞, 进行细胞靶向治疗也成为可能. 同时利用类器官所培育的干细胞群可以替换损伤或疾病的正常细胞, 实现类器官进行自体和同类异体组织治疗, 而未来这一科技在精准医学领域也将具有很大的发展潜力. 日本东京医科齿科大学研究团队从患者健康肠道中提取出了黏膜干细胞, 并将其诱导培养成肠道类器官, 2022 年该研究团队将体外培养的肠道类器官移植至患者溃疡性大肠处, 其安全性尝试结果将在一年后得到验证. 这种再生移植技术为世界首创的再生医学尝试, 若进展顺利, 溃疡性大肠炎有望被彻底治愈, 这也为“克罗恩病” 的治疗提供了可能. 虽然类器官治疗技术已经展出了治疗顽疾的潜力, 但其临床转化应用仍处于起步阶段,后续仍有广阔的发展空间. 此外, 通过这种技术手段, 结合CRISPR/Cas9 技术手段可以改善先天性遗传异常情况, 使健康的转基因细胞重新回流入病人体内, 并通过后期的再融合重新进入正常细胞中[14]. 在癌症治疗领域中, 病人来源的类器官已被预测为十分有效的药筛手段. 在实施治疗期间, 根据病人样本来源的类器官可初步检测病人体外对多种药物的反应, 从而对癌症病人的治疗进行有效引导和效果预判. 随着类器官技术的发展和其衍生的生产技术的研发,类器官将被应用于生命科学的各个领域.
然而, 类器官的发展仍然面临诸多问题和挑战. 类器官研究中最主要的问题是重复性和一致性, 这与过程管理欠缺和行业标准缺失有一定的关系. 类器官在构建阶段因机械参与程度低、人为影响较大, 导致系统偶然误差较大. 另外, 类器官检测方式和检测仪器过于缺乏, 活体观察较多使用形态学观察, 断点观察用的较多的是荧光检测的各项数据, 对类器官数据实时检测的光学、电化学等技术目前仍极不成熟. 目前, 很多科研工作者专注于创新类器官, 制作出的类器官有腺体、脾、肾、海马体、垂体等, 但无法做出一个符合特定指标(如大小、形态、基因表达量等) 的类器官, 也无法满足统计学指标(如类器官间的方差等). 这些问题也将极大地约束类器官的高速发展和临床成果转化. 类器官制造过程阶段的工程掌控也是迫切需要解决的问题. 现阶段培养类器官主要采用Matrigel 水凝胶作为培养基质. Matrigel 是康宁生命科学公司生产的一种Engelbreth-Holm-Swarm (EHS) 小鼠肉瘤细胞分泌的胶状蛋白混合物, 因含有外源动物成分, 难以应用于人的很多治疗场景. 另外, 即使现有将类器官与微流控技术进行结合的研究例子, 但是采用微流控芯片对类器官生存的流体环境进行模拟的方法有待进一步提升, 怎样操作微流控等技术监测控制类器官培养过程中流体微环境仍是亟需解决的问题.另外, 目前培养出的类器官直径为100∼500 µm, 虽然具备一定程度的尺度效应, 但仍然未能模拟人体组织、器官的状态, 如需培养尺寸更大的类器官, 其血管化问题亟待解决.
2 骨/软骨类器官
骨与软骨是构成身体支架的器官, 分别以骨组织和软骨组织为主要结构成分. 在人的一生中, 这两种组织尤其是骨组织不断更新和改建, 以适应成年前机体的生长发育和成年后机体支撑功能的变化需求. 骨由骨组织、骨膜及骨髓等构成. 骨组织由大量钙化的细胞间质及数种细胞组成, 坚硬且有一定韧性. 钙化的细胞间质称为骨基质. 细胞有骨原细胞、成骨细胞、骨细胞及破骨细胞4 种, 其中位于骨基质内的骨细胞最多, 其余3 种细胞均位于骨组织的边缘. 软骨组织由软骨细胞、基质及纤维构成. 根据软骨组织所含纤维的不同, 软骨分为透明软骨、纤维软骨和弹性软骨3 种. 软骨是固态的结缔组织, 略有弹性, 能承受压力和耐磨擦, 有一定的支持和保护作用(见图2).
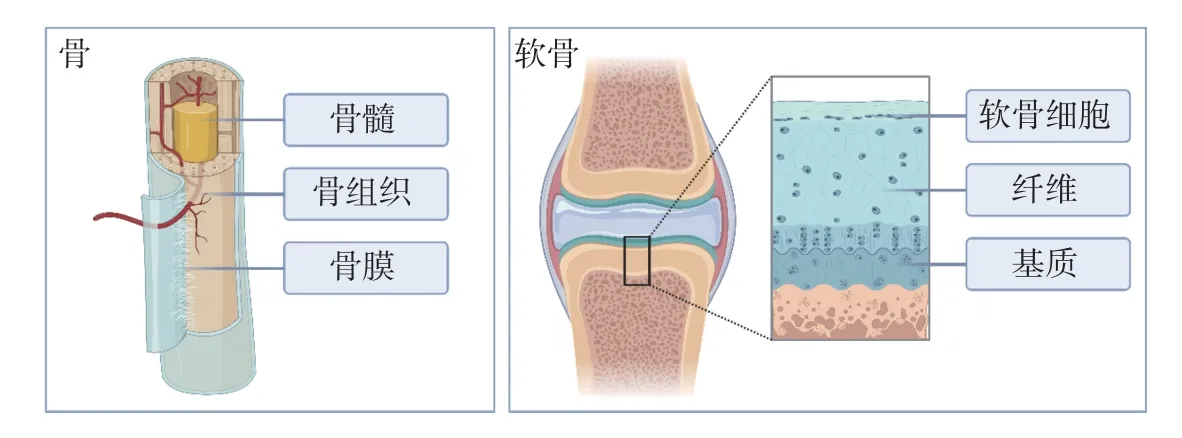
图2 骨/软骨结构组成示意图Fig.2 Schematic diagram of bone and cartilage structure composition
骨/软骨疾病是常见病、多发病, 具有起病隐匿、时间长等特点, 其预防和治疗往往被忽视. 目前, 骨/软骨疾病存在如下问题亟待解决:
(1) 研究难度大. 骨/软骨组织和细胞种类繁多, 且细胞间相互作用极为复杂; 相对于软组织, 骨骼硬组织研究的难度较大.
(2) 治疗药物和技术滞后. 受限于机制不清, 骨/软骨疾病治疗的药物极为缺乏, 且绝大多数骨/软骨疾病缺少有效治疗药物; 现有治疗以缓解症状为主, 无法真正逆转或延缓疾病进展.
(3) 组织工程研究进入瓶颈. 骨修复新材料研究周期长、成本高; 种子细胞和细胞因子选择在安全性和作用机理方面存在争议; 骨组织工程难以解决血管化难题, 无法用于修复大段骨缺损.
目前, 迫切需要开发新的研究工具和技术, 以较小成本和简单方式模拟骨/软骨的结构和生理功能, 在特定条件下能够模拟疾病发生过程, 复制病理特点, 用于发病机制研究和促进再生修复. 可以说, 骨/软骨类器官应运而生.
骨/软骨类器官是体外培养的、含有一种以上细胞类型的微型组织, 表现出骨/软骨的某些生理特征. 应用3D 培养技术将干细胞诱导特定谱系分化, 自我组装, 形成与骨/软骨组织细胞排布相似的微组织, 具有骨/软骨特有功能. 骨/软骨类器官能够在体外实现自我更新和自我组织, 这是其区别于传统体外组织培养的关键. 自我更新意味着干细胞能够不断克隆增殖产生子代细胞替代衰老和死去的细胞, 自我组织意味着干细胞能够模拟体内情况进行自我分化并形成空间特征化结构, 进而模拟体内骨/软骨相应功能.
2.1 发展历程
相比于其他组织, 骨/软骨类器官研究尚在起步阶段. 由于运动系统内干细胞起源复杂, 种类和功能各异, 分化路径不明确, 并且疾病种类多、病因复杂、周期长, 因此, 类器官构建具有相当难度. 2017 年Iordachescu 等[15-16]首先提出了骨类器官概念, 将成骨细胞加入含磷酸钙的纤维素凝胶之中, 成骨细胞能够自发形成类似天然骨的多级结构和骨细胞网络, 模拟钙盐沉积及骨成熟多个阶段. 引入破骨细胞后同时具备了骨形成和骨吸收功能, 能够模拟正常骨改建过程. 随后Akiva 等[17]、Park 等[18]、O’Connor 等[19]、Nilsson 等[20]等通过骨髓间充质干细胞(bone marrow mesenchymal stem cell, BMSC)、诱导多能干细胞(induced pluripotent stem cell, iPSC)、人骨膜衍生细胞(human periosteum-derived cell, hPDC) 等分别构建出能够模拟骨形成的骨类器官. Abraham 等[21]使用儿童捐献者的软骨组织酶解后构建了软骨类器官, 可模拟关节炎症. Tam 等[22]使用iPSC 诱导软骨分化构建了软骨类器官. Xie 等[23]通过将BMSC 分散在GelMA 水凝胶微球之后培养得到骨痂类器官, 回植后可快速修复兔子大段骨缺损. Zhang 等[24]绘制了首个骨髓组织图谱, 为骨髓类器官的构建奠定了基础.
2.2 构建策略
2.2.1 骨类器官
2022 年, 生物材料领域顶级期刊Bioactive Materials 首次总结了骨类器官相关研究并展望了其潜在用途[25]. 骨类器官指以类骨基质生物活性材料为支架, 通过体外3D 培养结合定向诱导技术, 将各类干细胞(如骨骼干细胞、胚胎干细胞等) 或功能细胞(成骨细胞、破骨细胞等) 培育组装成为具有骨空间特征的类骨组织, 能够模拟骨生理和病理特征, 具备骨的某些特定功能, 可用于骨骼发育和调控机制研究, 药物筛选和骨组织再生修复[26](见图3). 尽管已有多种类器官成功构建, 但是骨类器官研究尚处于起步阶段. 从分化调控角度, 骨形成具有长程性, 在不同时间剖面, 参与骨形成的细胞并不完全相同. 比如在编织骨形成阶段, 以间充质干细胞(mesenchymal stem cell, MSC) 及其成骨分化发挥主要作用; 而在骨小梁形成过程中, 破骨细胞介导的骨吸收及破骨细胞-成骨细胞对话是骨形成关键, 不同阶段需要给予不同外部刺激诱导细胞分化. 此外, 区别于其他类器官, 骨类器官应具有类骨组织支架结果以提供力学支撑和空间化仿生结构.

图3 骨类器官构建示意图Fig.3 Schematic diagram of bone organoids construction
根据报道, 构建骨类器官有2 种方法: 直接构建法和间接构建法, 前者通过骨形成相关细胞形成类骨样结构, 后者诱导干细胞形成软骨, 软骨再发生矿化形成骨组织.
(1) 直接构建法. 根据成年后骨塑建/骨改建理论, 通过在支架材料上接种成骨前体干细胞、成骨细胞或破骨前体细胞, 通过诱导使细胞与材料发生自组装, 形成类骨样结构, 中间不经历软骨阶段. Iordachescu 等[15]于2017 年最早提出骨类器官概念, 通过应用含磷酸钙的纤维素凝胶系统, 加入成骨细胞自我组装成类骨样结构, 再现了钙盐沉积及骨成熟多个阶段, 得到类似天然骨的多级结构和骨细胞网络. 他们通过介于2 个磷酸钙陶瓷锚之间的纤维蛋白凝胶模型, 提出了骨形成的自组织结构模型(见图4). 可以看出: 纤维蛋白支架在培养的第1 周围绕保留点进行重组, 无细胞发育的对照类器官在7 d 后显示出小幅收缩, 但仍保持扁平凝胶状, 未组装成3D 结构(见图4(a)); 2 个锚点之间张力导致6 d 之前的细胞对齐排列, 10 d 后在整个结构中观察到矿化结核(见图4(b)); 7 d 后矿床不明显,但4 d 后可以在靠近磷酸钙源的地方观察到个别矿化点(见图4(c)); 14 d 时可见纤维蛋白框架发生变化, 从锚定区域向中心形成明显基质, 直到3 个月时类器官完全被新基质覆盖(见图4(d)). 植入这些结构中的股骨骨膜细胞会有序沉积基质, 该基质在化学(胶原蛋白: 矿物质比例) 和结构方面与成熟骨非常相似. 拉曼光谱和X 射线衍射证实该矿物是与胶原蛋白相关的羟基磷灰石. 二次谐波成像表明, 胶原蛋白的组织方式与成熟的小鼠股骨相似. 纳米计算机断层扫描证实, 分化至骨细胞期的细胞通过小管连接, 并在整个培养过程中保持活力. 该模型可用于研究骨形成.

图4 骨器官的早期构建Fig.4 Early construction of bone organoids
之后, Iordachescu 等[16]选取牛股骨小梁颗粒作为系统基础, 将成骨细胞和破骨细胞同时种植在股骨头微型小孔, 应用破骨细胞分化因子(receptor activator nuclearfactor κβ ligand,RANKL) 及巨噬细胞集落刺激因子(macrophage colony-stimulating factor, M-CSF) 刺激破骨形成, 应用类固醇及β-甘油磷酸酯促进成骨细胞矿化, 成功构建微米级骨类器官, 置入模拟失重环境中成功模拟失重导致的骨丢失(见图5). 由图5(a)可以看出: 骨组织由小梁组成, 形成致密的骨骼; 骨组织高度矿化, 由磷酸钙组成, 蛋白质含量很少, 在骨髓腔中检测硫酸盐含量. 由图5(b) 可以看出, 股骨头由骨小梁组成(黑框), 适合承受较大机械负荷. 为确保骨类器官的解剖学相关结构基础, 使用来自股骨头热处理后的微小梁颗粒(500∼1 000 µm). 这些颗粒呈现出骨的层状结构(见图5(d)) 和表面形貌(见图5(e)), 对于正常细胞传感和附着必不可少. 它们还具有骨相关的生化成分, 由磷酸钙相(micro-XRF) 组成(见图5(f)). X 射线衍射分析证实这些是由成熟的骨矿物质羟基磷灰石(红色条) 的生物衍生相组成(见图5(g)). 微小梁天然具有高度静电, 可用于插入液体细胞悬浮液滴以生成微型骨. 悬滴培养系统用于悬浮小梁和原代雌性骨效应细胞, 并通过重力沉降直接附着到骨小梁表面(见图5(h)). 该模型将原代成骨细胞和破骨细胞接种到股骨头微小梁, 随后插入模拟微重力生物反应器(NASA-synthecon)以模拟减少机械刺激的病理状态. 与静态对照组相比, 模拟微重力组破骨细胞骨吸收位点形态发生改变. 暴露于微重力5 d 可观察到大量骨丢失. 在构建的类器官中可观察到大的骨细胞突起和管状结构以及新基质生成, 可用于研究骨改建过程, 揭示病理性骨质流失和骨骼重塑疾病机制.

图5 含磷酸钙的纤维素凝胶骨类器官构建Fig.5 Construction of cellulose gel bone organoids containing calcium phosphate
Akiva 等[17]利用人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSC) 接种在多孔3D 丝素蛋白支架, 通过旋转瓶生物反应器持续搅拌进行机械刺激, 而成骨细胞根据分化阶段完成自组装, 骨细胞嵌入产生的矿化细胞外基质中并能够进行细胞间通讯(见图6). 荧光免疫组织化学成像显示标记(见图6(a)∼(c)) 为成骨细胞形成的早期阶段,图6(d)∼(f) 为成熟成骨细胞, 图6(g)∼(i) 为骨细胞发育, 其中红色为细胞质, 蓝色为细胞核.图6(a)∼(i)中, 绿色分别为RUNX2 (第7 天)、OSX (第7 天)、ALP (第26 天)、骨钙素(第26天)、骨桥蛋白(第26 天)、骨黏连蛋白(第21 天)、DMP1 (第28 天)、podoplanin (第28 天)和硬化素(第28 天). 图6(j) 为MSCs 分化成成骨细胞和骨细胞的示意图, 表明在图6(a)∼(i)中预期蛋白质表达的状态. 荧光图像表明8 周后嵌入矿化基质中的骨细胞的自组织结构域, 骨细胞(硬化素, 红色) 和矿物质(钙黄绿素, 绿色) 的共定位见图6(k). 图6(l) 中胶原蛋白(红色) 和矿物质(钙黄绿素, 绿色) 表示丝素蛋白支架. 该系统在体外模拟了骨形成的早期状态,该阶段破骨细胞及骨改建尚未发生作用. 当机械力模拟人体骨骼形成所需压力时, 骨髓干细胞转变为成骨细胞和生长调节骨细胞, 细胞还分泌完成后续功能所需所有蛋白质. 经过4 周培养, 研究人员最终获得了由骨质结构相互交织的微型圆柱体, 随后被更成熟的骨组织替代. 利用这种工具, 研究人员可以在分子水平研究成骨过程中可能出现的问题.

图6 hBMSCs 分化为成骨细胞和骨细胞Fig.6 Differentiation of hBMSCs into osteoblasts and osteocytes
Park 等[18]使用仿骨小梁脱矿质骨质构建骨小梁类器官研究局部骨改建, 采用脱矿质皮质骨薄片复制了未矿化的骨细胞外基质(extracellular matrix, ECM). 这种生物材料被命名为脱矿质骨粉(demineralized bone powder, DBP). DBP 机械耐用、半透明, 并且具有可控的厚度和表面积. 他们研究了DBP 是否能够诱导成骨细胞形成矿化骨组织并获得骨衬细胞表型, 共培养原代鼠成骨细胞和单核巨噬细胞, 使用细胞因子刺激来重现骨重塑周期, 实现了DBP 表面同时含有活性和静息状态成骨细胞, 最后对细胞活动进行了定量空间映射以研究如何调节局部骨重塑活动. 结果显示, DBP 能够诱导成骨细胞发生快速结构性矿化, 成骨细胞有效转化为内衬细胞. 当加入激活骨改建的刺激后, 成骨细胞分泌RANKL, 添加的单核/巨噬细胞成功分化为破骨细胞进行骨吸收. 该模型有效地模拟了体内骨改建, 有助于研究调节因子时空分布在局部骨改建中的作用(见图7). 图7(a) 模拟了骨重塑周期顺序. 由图7(b) 可知, D3 和PGE2 刺激DBP 上的骨衬细胞导致RANKL/OPG 分泌比暂时增加. 荧光图像(见图7(c))显示, 激活的成骨细胞(osteoblas, OB) (绿色) 诱导单核巨噬细胞(红色) 分化为破骨细胞(osteoclast, OC). 图7(d) 证实破骨细胞可吸收矿物质. 由图7(e) 可知, 在DBP 和TCP 上,受刺激的OB 迁移速度比未受刺激的OB 快2 倍. 由图7(f) 可知, DBP 和TCP 上单一培养和共培养中OC 迁移. 在DBP 上, OC 经历细胞分裂和细胞融合(见图7(g)). 在TCP 上, OB很容易被大型多核OC 推动, 而在DBP 上OB 保持原位(见图7(h)). 在TCP 上, OC 反复进行细胞融合, 直到细胞变得巨大并经历细胞凋亡. 细胞凋亡后, OC 的大肌动蛋白环结构阻止相邻OB 迁移(见图7(i)). 图7(j) 为OB 碱性磷酸酶(ALP) 染色和定量比较. 图7(k) 为多核OC 抗酒石酸酸性磷酸酶(TRAP) 染色和定量比较(∗p<0.05,∗∗p<0.01, ns, 不显著).
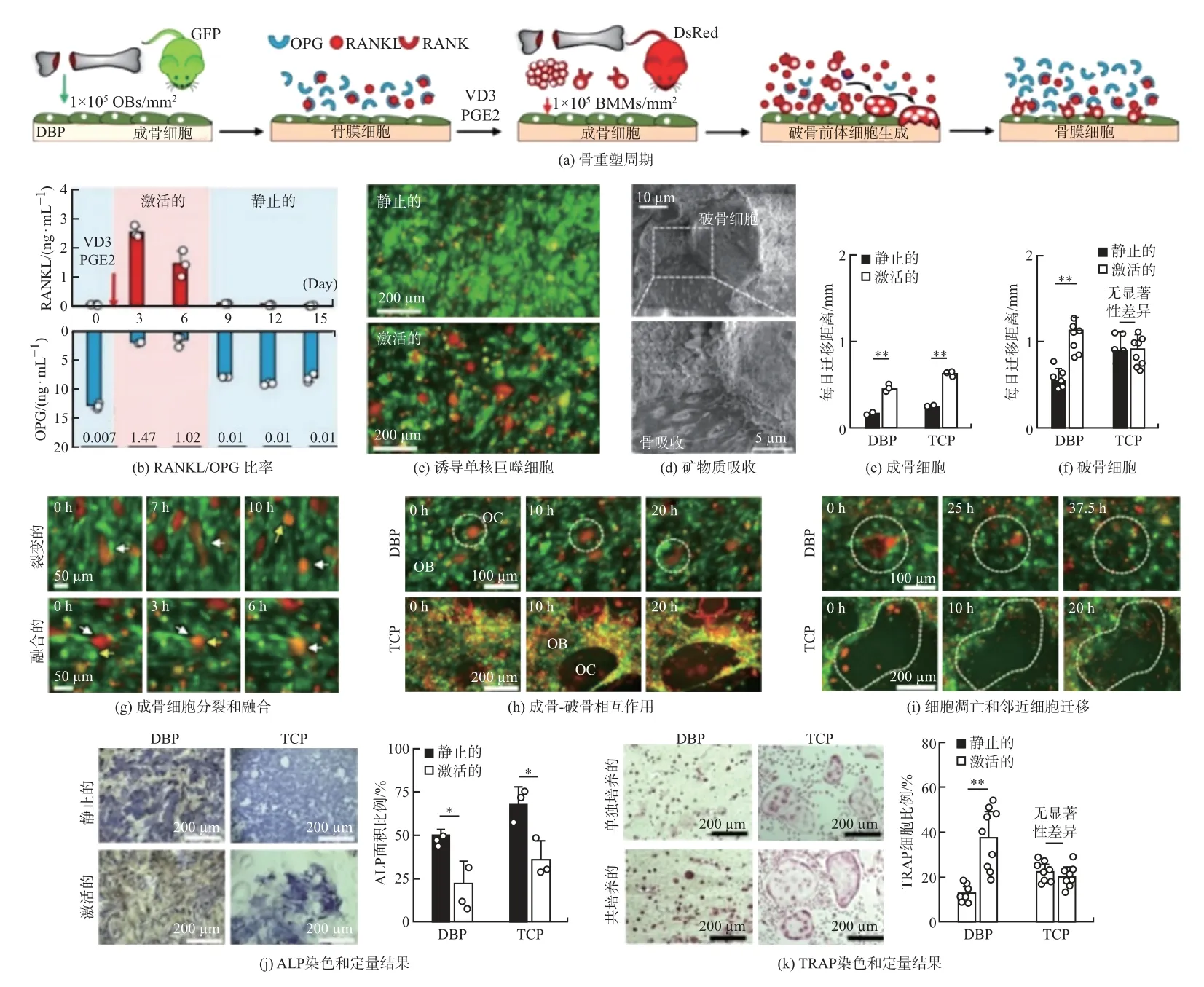
图7 构建骨类器官模拟骨改建中骨形成/骨吸收Fig.7 Construction of bone organoids structures simulating bone formation/resorption in bone remodeling
(2) 间接构建法. 软骨内成骨是大多数骨组织(包括四肢骨、躯干骨及颅底骨等) 发育和再生的主要机制. 另外一种骨类器官构建策略为先诱导干细胞形成软骨, 软骨再发生矿化形成骨组织. 为了模拟自然愈合和体内骨再生过程, 有人提出了“发育工程(developmental engineering)” 的概念, 即通过模拟软骨内成骨过程中的关键发育事件来促进有效骨组织再生.在软骨内成骨过程中, 间充质干细胞在缺损部位聚集, 分化形成“骨痂(callus)” 软骨核心, 随后骨痂内软骨细胞发生肥大、钙化和凋亡, 成骨祖细胞募集并向成骨方向分化.
在骨软骨组织工程中, 小鼠多能诱导干细胞iPSC(miPSCs) 可以通过转化生长因子β(transforming growth factor β, TGFβ) 和骨形态发生蛋白2 (bone morphological protein 2,BMP2) 诱导软骨形成和向成骨谱系特异性分化. O’Connor 等[19]报道了一种通过iPSC培养骨软骨类器官的方法. 研究人员从小鼠诱导性多能干细胞(induced pluripotent stem cells, iPSC) 中开发了一种骨软骨类器官. 将iPSC 时间依赖性连续暴露于生长因子(TGFβ3、BMP2), 通过软骨内骨化反映构建效果. 培养获得包括软骨区域和钙化骨区域骨类器官,该类器官可以模拟骨关节炎特点, 进行关节疾病药物筛选和遗传风险评估.
Nilsson 等[20]提出了一种应用人骨膜衍生细胞(human periosteum-derived cell, hPDC)自组装构建骨痂类器官的方法(见图8). 图8(a) 为从细胞聚集、凝聚和分化开始的示意图.图8(b) 为随时间推移微球体的投影面积(87∼400 个微球体, 10∼90 百分位数). 图8(c) 表示随时间微球体代表性明场图像. 图8(d) 表示随时间DAPI (核) 和鬼笔环肽(F-肌动蛋白) 染色共焦图像代表性3D 渲染. 图8(e) 表示微球体DNA 定量. 图8(f) 表示活(绿色)/死(红色) 染色. 图8(g) 表示微球体中细胞增殖半定量. 图8(h) 表示随时间微球体中增殖细胞代表性荧光图像, 其中蓝色代表细胞核. hPDC 长期培养遵循软骨内骨化的早期模式, hPDC 自组装获得软骨微球体, 随后发生骨化. 该类器官还可以融合为更大组织, 用来治疗较大范围骨缺损. 由于在骨折愈合过程中形成“软骨痂” 的大多数细胞都来自骨膜, 因此hPDCs 在长骨缺损的再生中有很大的应用前景. 此外该研究表明, 与骨髓间充质干细胞相比, hPDC 能够提高骨再生能力. hPDCs 可自组装, 在植入时形成骨微器官, 基因表达模式与胚胎生长板和骨折愈合过程相似. 多个骨痂类器官组合可形成大骨器官, 有效促进大段骨缺损小鼠骨缺损修复.
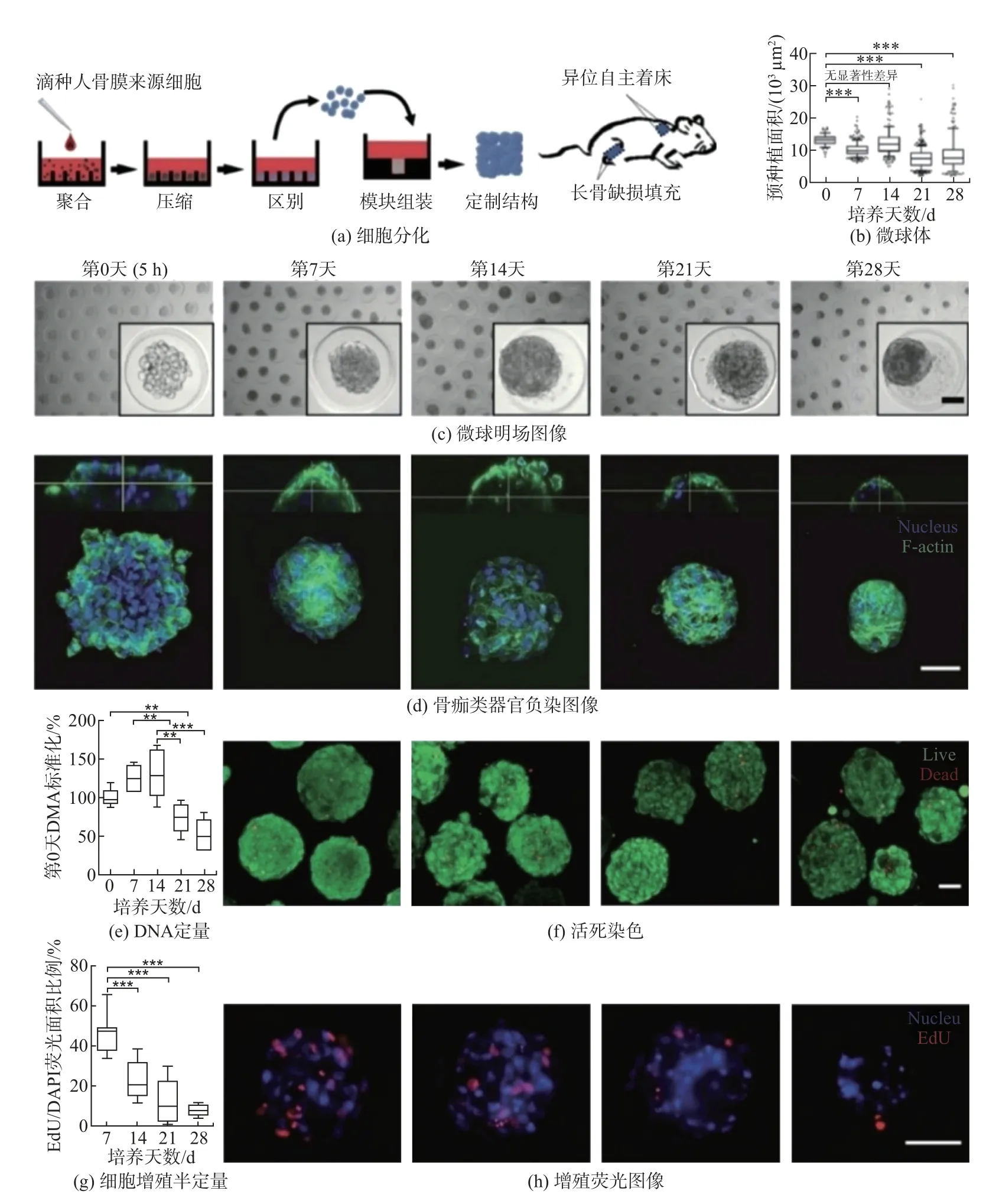
图8 人骨膜衍生细胞自组装构建骨痂类器官Fig.8 Self-assembly of hPDC to construct bone callus organoids
浙江大学Xie 等[23]报道了体外高效构建骨痂类器官用于大段骨缺损修复. 研究团队通过数字光处理(digital light processing, DLP) 打印技术, 实现了负载有BMSC 的水凝胶微球的高效生产和BMSC 在微球中的聚集. 在软骨诱导培养基中诱导分化3 周后, 构建出与发育过程中相似的骨痂类器官(osteo-callus organoids). 研究者发现体外逐渐成熟过程中骨愈伤组织类器官的表型基因表达模式与天然软骨内骨化类似. 此外, 将骨-愈伤组织类器官植入体内后发现其具备高效的异位骨形成和原位骨再生能力, 有助于大段骨缺损4 周内快速原位骨再生,以往类似缺损修复通常需要3 个月.
以上2 种生物构建策略存在周期长、成本高、重复性差等缺陷. 浙江大学Zhao 等[27]发明了一种新型的气流辅助3D 生物打印方法, 并成功构建多细胞骨类器官. 通过气流辅助3D 生物打印方法, 研究团队成功构建多细胞骨类器官. 该研究以水凝胶微球体为培养载体, 分别植入骨髓间充质干细胞和人脐带静脉内皮细胞进行成骨及成血管诱导. 培养10 d 后, 可以观察到明显血管化的骨组织. 与常规生物制造方法不同, 该研究首次利用数学建模及机械手段, 实现了细胞空间结构的可控成型, 为构建骨类器官提供了新思路.
2.2.2 软骨类器官
目前, 软骨类器官的构建有2 种方法: 消化获得软骨细胞和诱导干细胞分化为软骨细胞.
(1) 消化获得软骨细胞. Abraham 等[21]从儿童捐献者获得骨及软骨组织, 酶解获得细胞后分别进行骨及软骨类器官构建. 为了更好模拟关节发育及疾病状态, 该团队还将同时含有骨和软骨成分的肋骨消化获得的细胞进行骨-软骨诱导分化, 最终获得含有骨和软骨组织的迷你关节球. 该模型成功模拟关节炎症, 能够对药物疗效进行评价.
(2) 诱导干细胞分化为软骨细胞. Tam 等[22]研究了人多能干细胞的体外和体内软骨和骨组织形成能力(见图9). 诱导的多能干细胞可定向分化为软骨细胞, 随后自组装成软骨类器官.分化形成的软骨细胞表达与原代人关节软骨细胞相似水平的Ⅱ型胶原蛋白, 并在体内异位植入时产生稳定软骨. 在针对性地促肥大和促炎介质启动后, 类器官成功桥接了免疫功能低下小鼠的临界尺寸长骨缺损.

图9 人多能干细胞衍生的软骨类器官促进长骨缺损无支架愈合Fig.9 Human pluripotent stem cell-derived cartilage organoids promote scaffold-free healing of long bone defects
2.3 应用前景
骨/软骨类器官基于3D 体外细胞培养系统建立, 与体内骨/软骨结构高度相似, 可以复制出骨/软骨的复杂空间形态和功能, 表现出细胞与细胞之间、细胞与基质之间相互作用和空间位置形态, 与体内骨/软骨具有相似生理反应. 基于以上优势, 骨/软骨类器官能够在发育生物学、生物样本库、药物筛选、精准医疗、再生医学、疾病建模等领域有效弥补传统骨组织工程的不足, 在骨/软骨再生修复研究中具有巨大潜力(见图10).

图10 骨/软骨类器官的转化应用场景Fig.10 Translational application scenarios of bone/cartilage organoids
首先, 骨/软骨类器官能够模拟体内代谢和再生修复过程, 有助于阐明骨/软骨在各种生理病理状态下再生修复机制. Park 等[18]构建的骨类器官模型可以模拟体内骨改建这一复杂过程. 在此基础上, 构建病理条件下骨类器官, 模拟骨微环境特点, 在体外可直观研究疾病状态下骨改建规律. 在骨类器官上制作骨折、缺损模型, 可动态连续研究骨类器官缺损修复机制.其次, 骨/软骨类器官能够用于材料和药物快速筛选. 传统骨组织工程材料支架、种子细胞和生长因子的筛选主要依赖体内研究评价, 周期长、干扰多、成本高. 通过骨类器官可实现体外高通量快速筛选骨组织工程所需材料, 有效避免盲目设计与测试, 节约大量时间和资源. 最后,骨/软骨类器官本身可直接用于骨/软骨组织修复再生, 其研究目标是实现大尺度宏观骨/软骨类器官的制备, 可直接用于骨/软骨缺损原位修复.
3 总结与展望
骨/软骨在人体生理活动中发挥重要功能. 骨/软骨疾病种类多、起病慢、病程长、危害大,现在尚缺乏有效治疗手段. 由于缺乏简单高效的研究模型, 目前骨/软骨疾病研究仍有大量问题尚不明确, 如骨/软骨干细胞的鉴定和分离方法、骨/软骨微环境结构和细胞成分的解析等.骨/软骨类器官的构建和应用为临床解决上述问题提供了新的研究工具和技术, 其以较小成本和简单方式仿生骨/软骨的结构和生理功能, 在特定条件下能够模拟疾病发生过程, 复制病理特点, 高效用于骨/软骨发病机制和再生修复的研究.
展望未来, 骨/软骨类器官研究前景巨大. 该技术作为一种新型工具, 在骨/软骨基础研究和临床治疗中具有广泛的应用前景, 有望被应用在精准医学、药物毒性和疗效、生物学、疾病病理学、细胞生物学等领域.这项技术也为再生医学提供了巨大的潜力, 通过用骨/软骨类器官培养物替换受损或患病的骨/软骨组织, 可突破传统骨组织工程修复极限. 与此同时, 骨/软骨类器官有望为再生医学研究创造出更多的新成果. 将活体实时成像技术应用在骨/软骨类器官中, 将首次实现人体骨/软骨组织发育进程的实时观察; 将骨/软骨类器官与生物3D 打印结合,将实现骨/软骨组织损伤的空间特征化功能修复; 将骨/软骨类器官与“人类细胞图谱(human cell atlas, HCA)” 技术结合, 骨/软骨类器官细胞图谱将能加速多种骨/软骨相关罕见病等的治疗进程.
综上所述, 骨/软骨类器官研究意义重大, 应用前景广泛, 但目前尚处于起步阶段, 需要解决包括细胞外基质材料、干细胞种类、来源及诱导条件等诸多问题, 方能将骨/软骨类器官真正推向临床应用, 造福广大患者.

