基于双参数磁共振影像组学模型评估前列腺癌风险分级的应用
龚涵颖 陆钰 汤文瑞 韩俊 朱翔*
前列腺癌是男性常见恶性肿瘤之一[1],随着发病率逐年上升,严重威胁老年男性的生活质量与生命安全。血清前列腺特异抗原(prostate specific antigen,PSA)是早期前列腺癌的主要肿瘤筛查标记物[2],但血清PSA的灵敏度及特异度均不高,也可能由前列腺增生、炎症、直肠指检等引起。经直肠超声引导下的前列腺活检是目前常用的前列腺癌确诊方法,但由于取样错误、观察者水平的差异等原因,活检可能不能反映真实等级,且病理活检作为一项有创性检查,存在出血、感染等风险[3]。多参数磁共振(multiparametric magnetic resonance imaging,mp-MRI)可以提供前列腺肿瘤的定位与分期,在前列腺癌诊断方面起重要作用[4],但受诊断医师的水平及经验差异影响,对前列腺肿瘤mp-MRI图像的判断仍存在主观性。因此需要一项更加客观、准确且无创的辅助检查来提高前列腺癌的术前评估效率。本研究拟通过提取双参数磁共振(biparameter magnetic resonance imaging,bp-MRI)的图像特征构建机器学习模型,探讨影像组学在预测中低风险与高风险前列腺癌的作用。
1 资料与方法
1.1 临床资料 回顾性分析2021年1月至12月本院经病理证实为前列腺癌的患者,并获得患者的Gleason 评分(Gleason Score,GS)、临床分期及血清PSA 值,根据美国国家综合癌症网络(national comprehensive cancer network,NCCN)前列腺癌分级指南将患者分为中低危组及高危组[5]。中低危组:PSA<20 ng/mL 且GS ≤7 且临床分期T1~T2c,高危组:PSA ≥20 ng/mL 或GS>7 或临床分期T3a~T4。纳入标准:①MRI 检查后2 个月内获得前列腺癌的病理结果;②患者血清PSA 异常升高;③所有纳入病例无MRI 检查禁忌症。排除标准:①MRI图像不完整或图像质量差;②患者入院前曾接受穿刺活检或化疗;③临床资料不完整;④合并其他恶性肿瘤者。本项研究从符合上述入组标准的前列腺癌患者中,筛选经同一台机器成像的患者119 例,其中中低危位组57 例,高危组62 例。
1.2 检查方法 应用美国GE Healthcare Discovery 750 3.0T 的MR 成像系统,采用盆腔相控阵线圈。患者取仰卧位,覆盖整个前列腺与精囊,尽量减少影像伪影。横断位T2WI 序列,TR:3,343.0 ms,TE:Minimum ms,层厚3.0 mm,层间距1.0 mm,FOV 34 cm×34 cm,矩阵320×256,激励次数(NEX)=2。横轴面DWI 扫描在定位时需要保证和T2WI 所有序列层面一致,TR:2,080 ms,TE:Minimum ms,层厚3.0 mm,层间距1.0 mm,FOV34 cm×34 cm,矩阵128×128,激励次数(NEX)2~8 不等,b值=1,000 s/mm2。ADC 图由DWI 图生成。1.3 感兴趣区勾画 收集患者完整的 T2WI 及ADC 图像,从本院影像归档与通信系统(picture archiving and communication system,PACS)系统中以dicom 格式导出所有图像,并转换为占据空间更小nii 格式文件再进行后续处理。由两位>10 年MRI 诊断经验的影像科医师根据已获得的每一针标本的组织病理学GS 使用视觉配准法,在T2WI 和ADC 图像上确定相应的病变位置在ITK-SNAP 操作界面逐一手动对每个层面横轴位T2WI 及ADC 图像的病灶所在区域进行感兴趣区(region of interest,ROI)勾画,生成三维兴趣容积(volum of interest,VOI)。有疑问时由2 位医师共同商讨决定。为减小ROI 的部分容积效应,勾画时保持绘制线距前列腺边缘大约1~2 mm 距离(见图1)。
1.4 图像特征提取与筛选 图像特征提取与筛选是影像组学的重要环节,本研究使用Pyradiomics 工具包对医师勾画的VOI 分别进行高通量的特征提取,并使用目前常用的Z-score 方法对提取的特征进行归一化,将特征值拉伸到(0,1)之间,以便进一步处理。本研究先采用Spearmen 相关系数法剔除过度相似的特征,在相关系数>0.9 的两组特征中保留其中一组。再使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)基于最小惩罚系数(λ)进行特征降维。
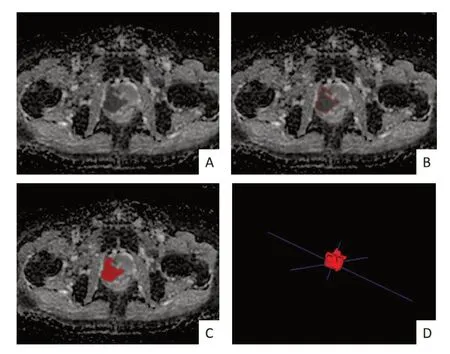
图1 肿瘤分割示意图。A. ADC序列横断面图像;B. 沿肿瘤边界勾画感兴趣区(ROI);C、D. ROI融合后形成三维兴趣容积(VOI)
1.5 模型构建与评估 通过不断训练和调整分类器,最终得到能够比较准确分类的模型。使用筛选后的重要特征,从中低危组与高危组患者中分别随机抽取70%作为训练组(n=83),剩余30%作为验证组(n=36)。分类器的训练采用十折交叉验证法,将训练组随机分成十组进行,最后分别建立基于T2WI、ADC、T2WI+ADC的三组支持向量机(support vector machine,SVM)模型及随机森林(random forest,RF)模型。用测试组对模型进行验证,检验每一种模型的准确率、特异性、敏感性并绘制受试者操作特征曲线(ROC),得到ROC 曲线下面积(AUC),使用AUC 评价每一分类器的性能。
2 结果
经Pyradiomics 共提取出107 个特征,包括形态学特征14 个、一阶统计特征18 个、纹理统计特征75 个。基于T2WI 序列提取的特征经Spearman 相关系数法筛选出27 个特征,在LASSO 回归对应logλ=0.039 时特征数为10 个;基于ADC 序列提取的特征经spearman相关系数法筛选出32 个特征,在LASSO 回归对应logλ=0.052 时特征数为5 个;T2WI+ADC 序列提取的特征经Spearman 相关系数法筛选出15 个特征,在LASSO回归对应logλ=0.013 时特征数为10 个(见图2~3)。基于T2WI 序列建立SVM 模型、RF 模型的AUC 分别为0.797、0.713;基于ADC 序列建立SVM 模型、RF 模型的AUC 分别为0.826、0.667;T2WI+ADC 序列建立SVM模型、RF 模型的AUC 分别0.871、0.724(见表1、图4)。联合双参数的模型预测效能优于单参数模型。
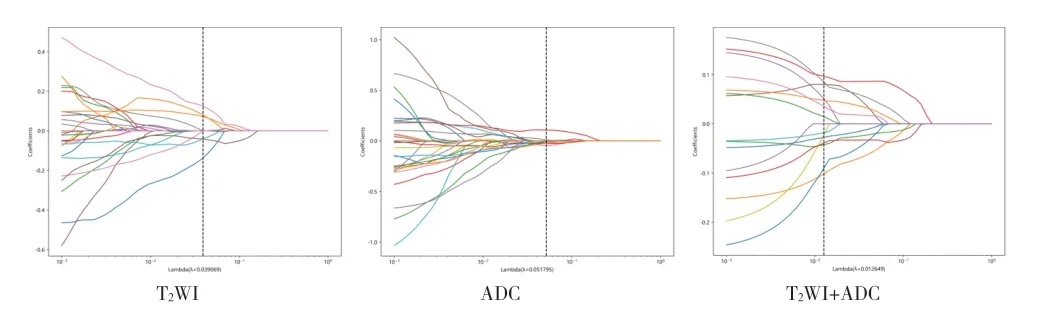
图2 三组数据集LASSO回归基于λ特征筛选
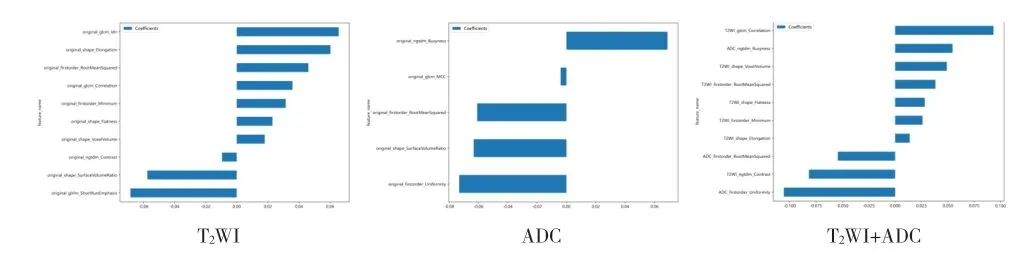
图3 三组数据集筛选后特征加权

图4 基于T2WI、ADC及T2WI+ADC构建SVM模型、RF模型的ROC曲线
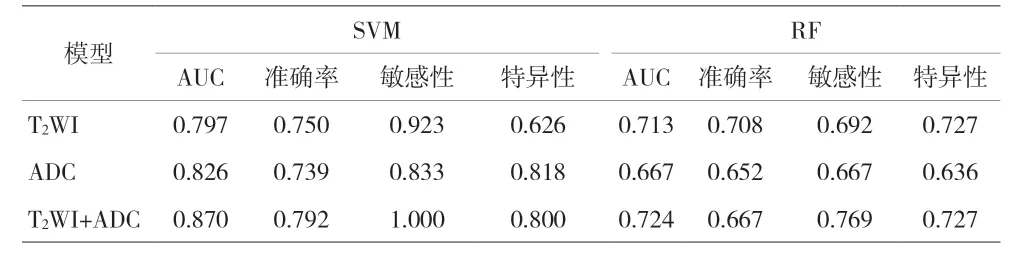
表1 3组模型对前列腺癌风险分级的预测效能
3 讨论
众多研究表明,中低危的早期前列腺癌侵袭性低且进展缓慢,可采取随访观察或主动监测的治疗方式,立即实施不合理的治疗反而会增加患者负担[6]。既往临床结果显示,中低危患者采取前列腺癌根治切除术的术后并发症少且复发率低,能达到较好的疗效[7]。而高危前列腺癌侵袭性强,术后复发率高,且高危前列腺癌存在包膜浸润、周围侵犯、远处转移等情况,在发现时常错过手术的最佳时机,主张采取内分泌治疗或放疗等姑息性治疗。因此,科学了解前列腺癌的生物特性对患者治疗方案的选择至关重要。NCCN 指南根据血清PSA值、病理结果、临床分期将前列腺癌进行风险分级,分成低危组、中危组、高危组,并再进一步细分成六组。相比较于仅依靠单项数据的传统评估前列腺癌的方式,该风险分级方法提供了更加全面、科学、细致风险分级系统,为不同患者的个体化治疗提供依据。
Mp-MRI 被认为是目前无创检测和定位前列腺癌的最有效方法。bp-MRI(T2WI 和ADC)检测前列腺肿瘤的准确度与传统的mp-MRI 相当[8]。多项研究基于T2WI 和(或)ADC 序列构建影像组学模型用于前列腺癌的定性诊断、危险度评估、疗效评价等。T2WI 图像可提供前列腺与周围结构的高分辨率图像,显示前列腺的解剖分区及病变的准确定位。SUN 等[9]用T2WI 纹理分析预测区分GS ≥4+3 分与GS ≤3+4 分的前列腺癌,结果表明GLCM 纹理特征与肿瘤病理风险等级分层有明显关联。HECTORS 等[10]研究发现基于T2WI 序列构建的分类器在PI-RADS 3 病变中对临床前列腺癌预测表现出良好性能。还有学者基于T2WI 构建模型预测前列腺癌有无包膜侵犯,结果表明该模型有较好的临床实用性[11]。本研究基于T2WI 序列构建的SVM 模型及RF 模型在预测前列腺癌风险分级也表现出良好效能,AUC 分别为0.797、0.713。ADC 通过定量观测组织内水分子的运动情况反映肿瘤的恶性程度,高危前列腺癌组织致密,细胞间隙小,水分子的运动受到强烈抑制而表现为低信号,影像组学可以定量反映中低危与高危前列腺癌间的图像差异。WIBMER 等[12]研究MRI的Haralick 纹理发现GS ≤3 + 4 分癌与 GS ≥ 4 + 3 分癌的熵有显著性差异,并揭示ADC 图像能量与GS 分期有关。GONG 等[13]基于ADC 序列构建的LR 模型预测GS>7 前列腺癌AUC 达0.787,与联合双参数的模型效能相当。本研究通过提取ADC 序列特征构建的SVM模型AUC 为0.826,表现出良好的前列腺癌风险分级预测潜力。然而关于T2WI 与ADC 哪一序列构建的分类器模型预测前列腺癌风险更佳仍尚无定论,大部分学者认为ADC 序列更能反映肿瘤的恶性程度,然而本研究结果显示基于T2WI 序列的RF 模型效能并不亚于ADC 模型,这可能与模型的选择有关。
本研究中联合双参数序列的机器学习模型AUC普遍高于单一序列的模型,SVM 模型训练集AUC 为0.871,RF 模型训练集AUC 为0.724。这可能是由于双参数图像整合单序列的优势,保留更多有价值的特征信息,提高模型预测前列腺癌风险分级的效能,具有较好的临床应用潜能,与ZHANG 等[14]研究结果一致。LI等[15]研究提取152 例前列腺癌T2WI+ADC 图像特征建立的模型能够准确、自动区分CG 中的低级别和高级别前列腺癌。谢金珂等[16]对92 例前列腺癌患者的T2WI、ADC 图像进行纹理分析后用于区分低级别和高级别前列腺癌的AUC 达0.714。然而部分学者认为在鉴别高危和低危前列腺癌时,单序列模型的效能虽略低于多序列模型,但其兼顾简化扫描、易于分割、容易质控、节约耗时的优点,更利于影像组学发展与推广[17]。
SVM 算法与RF 算法均比较适合小样本和二分类变量的模型构建,也是目前传统影像组学研究中的常用算法。SVM 模型作为一类广义的线性分类器,常用于解决高维空间的小样本下机器学习问题,且拥有比较强的泛化能力,但传统的SVM 算法有只能处理二类分类问题的弊端;RF 模型中包含多个决策树,能处理高维数据问题,其优势包括简单、易实现、计算开销小等,但在某些噪音较大的分类或回归问题上会出现过拟合的情况。本研究中SVM 模型在三种数据集中的AUC 均高于RF 模型,达到优秀级别的性能,可能与本研究样本数量以及数据分布有关。
综上所述,T2WI、ADC 序列模型均有良好的分类效能,联合双参数序列的模型在前列腺癌风险分级的分类中优于单序列,并且SVM 模型的效能普遍优于RF模型。影像组学模型能无创进行前列腺癌术前预测并指导个体化治疗方案选择,具有很大的临床应用潜力。

