脑卒中血清培养骨髓间质干细胞移植对大鼠脑缺血再灌注的影响
贾韩静 童一心 黄哲华*
脑卒中在老年人群中较为常见,具有高发病率和高死亡率特点,其中87%为缺血性脑卒中,目前青年缺血性脑卒中的发病率已明显增加[1]。间充质干细胞(mesenchymal stem cell,MSCs)来源广泛,有高度自我更新和多态分化能力,已被应用于脑卒中移植治疗以改善神经功能[2]。但MSCs 移植的成功率较低,因此提高MSCs 细胞移植后的活力已成为MSCs 移植治疗脑卒中的研究重点[3]。研究发现,MSCs 经中风患者血清培养后移植可提高MSCs 的治疗效果[4]。基于此,本研究通过建立大鼠中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,探讨缺血性脑卒中血清预处理的MSCs对MCAO 大鼠的神经保护效果及机制。
1 材料与方法
1.1 实验动物 85 只健康SD 大鼠,体重250~280 g,购于上海吉辉实验动物饲养有限公司[SCXK(沪)2017-0012)],饲养于杭州鹰旸生物科技有限公司动物中心[SYXK(浙)2020-0024)]。
1.2 材料与仪器 苏木素染液(货号:MD911467)购于MDL;伊红染液(货号:613101)购于珠海贝索生物技术有限公司;Tunel 试剂盒(货号:11684817910)购 于Roche;CD44、CD90、CD45抗 体(货 号:85-12-0444、85-11-0900、85-11-0461)购于eBioscience;CD34抗体(货号:AF6518)购于R&D;脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、神经生长因子(nerve growth factor,NGF)、肝细胞生长因子(hepatocyte growth factor,HGF)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)ELISA 试剂盒(货号:MM-0209R1、MM-0187R1、MM-0152R1、MM-0179R1)购于酶免。Brdu 抗体(货号:Ab8152)购于Abcam,BDNF、NGF 抗体(货号:DF6387、DF6061)购于Affnity。C6 流式细胞仪(BD);Micro 17R 高速离心机(Thermo),Nikon DS-U3 成像系统(日本尼康)。1.3 方法 (1)骨髓MSCs 的分离与培养:从大鼠股骨中抽取骨髓,淋巴细胞分离液密度梯度离心分离法分离单核细胞。用10% 胎中血清(FBS)和含有1%双抗(penicillin/streptomycin)的DMEM 培养基培养分离的单核细胞并传代2 次获取MSCs。(2)流式细胞术检测CD44、CD90、CD34、CD45抗原表达:PBS 清洗MSCs,离心,适量PBS 重悬底部细胞,调整浓度为5×106~10×106/mL。吸取100μL 细胞悬液与流式管内,各加抗体5 μL,混匀后室温避光孵育15 min。清洗细胞(同上),500μL PBS 重悬细胞,流式上机检测。(3)缺血脑组织预处理MSCs:分离5 只缺血性脑卒中大鼠和5 只正常大鼠血清,离心10 min 后分离上层液。脑卒中大鼠血清与细胞培养液混合后培养MSCs,标记为SS-MSCs,正常大鼠脑组织血清与细胞培养液混合后培养MSCs,标记为NS-MSCs;FBS 培养的MSCs,标记为FBS-MSCs。(4)MCAO 大鼠模型的制备与分组:10%戊巴比妥钠腹腔麻醉大鼠,采用Zea Longa 线栓法制作MCAO 大鼠模型[5]。造模1 d 后,预处理MSCs 经Brdu 荧光染色后静脉注射到大鼠尾静脉中,随机分为MCAO 组(等体 积PBS)、MCAO+FBS-MSCs 组(2×106cells FBSMSCs)、MCAO+NS-MSCs 组(2×106cells NS-MSCs)、MCAO+SS-MSCs 组(2×106cells SS-MSCs),同时sham组注射等体积PBS。(5)MCAO 大鼠行为变化的监测:MCAO 大鼠尾静脉注射移植预处理的MSCs 第1、7、14天后观察其行为变化,采用贴纸试验(Adhesive-removal test)、改良神经功能缺损评分(modified neurological severity score,mNSS)进行评估。mNSS 评判标准:轻型受损1~6 分;中型受损7~12 分;重型受损13~18 分。(6)TTC 染色:MSCs 移植14 d 后,麻醉处死大鼠,摘取脑组织,于-20 ℃冰箱冻存5 min,取出后称重。将大鼠脑组织按1~2 mm 厚度切下5~6 片,TTC 溶液染色,37℃孵育15 min,4%多聚甲醛固定30 min,拍照;梗死区呈白色,正常区呈红色,图像处理和分析软件处理以计算脑梗死面积占比(%)=脑梗死区面积/脑组织总面积×100%。(7)HE 染色:石蜡包埋脑组织,常规切片,烤片,脱蜡至水。按步骤进行HE 染色。同时行HE 半定量分析,0 分为无炎症细胞浸润、无神经元萎缩,1~4 分分别为炎症细胞浸润范围、神经元萎缩面积<25%、25%~50%、>50%~75%、>75%。(8)Tunel染色:标本制作同上。蛋白酶K 修复工作液和破膜工作液预处理标本。滴加TdT 与dUTP,37℃孵育2 h,避光室温加入DAPI 复染细胞核10 min,PBS 洗涤,抗荧光淬灭封片剂封片,倒置荧光显微镜下观察并采集图像以分析脑组织中细胞凋亡情况。阳性凋亡细胞核呈绿色。(9)ELISA 检测:参照相关试剂盒说明,ELISA检测大鼠脑组织BDNF、NGF、HGF、VEGF 等生长因子或营养因子的表达水平。(10)免疫组织化学染色:MCAO 造模后,大鼠腹腔内定时注射50 mg/kg BrdU 连续3 d,14 d 后取脑组织行冠状组织制备冷冻切片。按试剂说明书行免疫组织化学和DAPI 双重染色。20 倍、40 倍显微镜下选取连续6 个视野计数阳性细胞。
1.4 统计学方法 采用SPSS 16.0 统计软件。符合正态分布计量资料以(±s)表示,多组间比较用方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 MSCs 的形态学特征 原代MSCs 经过24 h 培育后,可见单个黏附贴壁细胞,呈纺锤状或多边形(见图1A);3~5 d MSCs 细胞迅速增殖所示,可见梭形、多突状的成纤维样克隆细胞(见图1B)。
图1 骨髓间质干细胞的形态学特征
2.2 MSCs 细 胞 表 面 标 志 物CD44、CD90、CD34、CD45的表达 MSCs 细胞表面CD44和CD90分子阳性率达到92.17%±0.51% 和95.50%±0.95%;而CD34和CD45分子阳性率仅为1.31%±0.09%和1.95%±0.07%。见图2。

图2 MSCs细胞表面标志物CD44、CD90、CD34、CD45表达
2.3 MCAO 大鼠行为变化的情况 MSCs 移植第0、1 天各组大鼠贴纸去除时间和mNSS 评分差异均无统计学意义(P>0.05)。从MSCs 移植后第7 天开始,MCAO+FBS-MSCs 组、MCAO+NS-MSCs 组 与MCAO+SS-MSC 组大鼠的双侧贴纸去除时间、mNSS评 分 较MCAO 组 均 降 低(P<0.05 或P<0.01);与MCAO+FBS-MSCs 组比较,MCAO+SS-MSC 组大鼠贴纸去除时间、mNSS 评分降低(P<0.01);与MCAO+NSMSCs 组比较,MCAO+SS-MSC 组大鼠贴纸去除时间、mNSS 评分降低(P<0.01)。见图3。
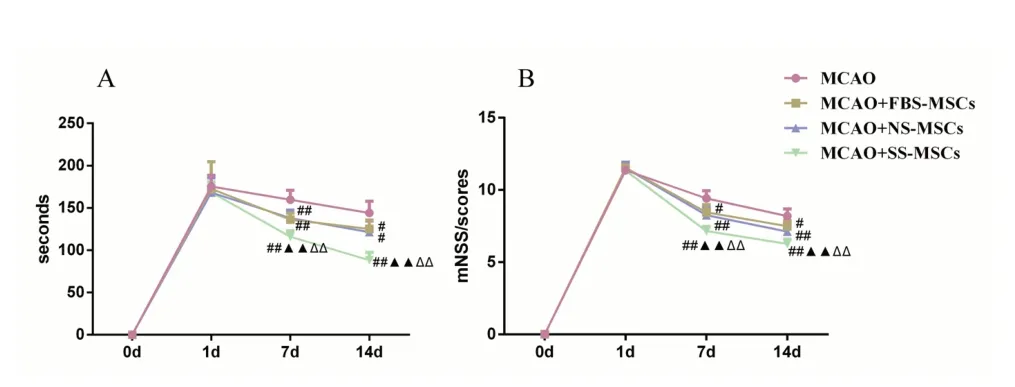
图3 MCAO大鼠行为变化的情况 A:注射预处理MSCs第0、1、7、14 天后的贴纸试验结果;B:注射预处理MSCs第0、1、7、14 天后mNss评分结果
2.4 TTC 染色观察MCAO 大鼠脑梗死面积 与sham 组比较,MCAO 组大鼠脑梗死面积极升高(P<0.01),与MCAO 组比较,MCAO+FBS-MSCs 组、MCAO+NS-MSCs组与MCAO+SS-MSC 组大鼠脑梗死面积降低(P<0.05或P<0.01);与MCAO+FBS-MSCs 组比较,MCAO+SSMSC 组大鼠脑梗死面积降低(P<0.01);与MCAO+NSMSCs 组比较,MCAO+SS-MSC 组大鼠脑梗死面积降低(P<0.01)。见图4。

图4 A. MCAO大鼠脑梗死面积(TTC染色×400);B. 预处理MSCs对MCAO大鼠脑梗死率的影响
2.5 HE 染色观察MCAO 大鼠脑组织恢复情况 sham组大鼠脑组织神经元染色正常,结构清晰,排列致密有序。MCAO 组脑组织结构疏松,着色变浅,神经细胞层次改变,可见明显细胞碎片及组织空泡样改变,HE 半定量评分较sham 组升高(P<0.01)。与MCAO 组比较,预处理MSCs 组神经元数目增加,空泡样改变减弱,且神经元损伤性病理变化减轻,大鼠脑组织HE 半定量评分均降低(P<0.05 或P<0.01),其中MCAO+SS-MSCs 损害程度最低,接近于sham 组。见图5。

图5 A. MCAO大鼠脑组织恢复情况(HE染色×400);B. MCAO大鼠脑组织HE半定量评分
2.6 Tunel 染色观察脑组织中细胞凋亡情况 与sham组比较,MCAO 组脑组织细胞凋亡率升高(P<0.01)。各预处理MSCs 组较MCAO 组凋亡率均显著减少(P<0.05 或P<0.01),其细胞凋亡程度由低到高依次为:MCAO+SS-MSC 组<MCAO+FBS-MSCs 组<MCAO+NSMSCs 组。见图6。

图6 A. MCAO大鼠脑组织细胞凋亡表达情况(Tunel染色×400);B. MCAO大鼠脑组织细胞阳性凋亡率
2.7 预处理MSCs 对大鼠脑组织中BDNF、NGF、HGF、VEGF 水平影响 与sham 组比较,MCAO 组脑组织中BDNF 水平升高(P<0.01),VEGF 水平降低(P<0.05);与MCAO 组比较,MCAO+FBS-MSCs 组BDNF、HGF、VEGF 水平高(P<0.05、P<0.01),BDNF、NGF、HGF、VEGF 水平在MCAO+NS-MSCs 组与MCAO+SS-MSC 组均升高(P<0.05、P<0.01);与MCAO+FBS-MSCs 组比较,MCAO+SS-MSC 组BDNF、NGF、HGF、VEGF 水平均升高(P<0.05、P<0.01);与MCAO+NS-MSCs 组比较,MCAO+SS-MSC 组BDNF、HGF、VEGF 水平升高(P<0.05、P<0.01)。见图7。

图7 MCAO大鼠脑组织中BDNF、NGF、HGF、VEGF水平表达情况
2.8 免疫组化检测大鼠脑组织中BrdU、BDNF 与NGF的表达水平 与sham 组比较,MCAO 组大鼠脑组织中BDNF、NGF 表达水平下降(P<0.05),BrdU 表达水平升高(P<0.05)。与MCAO 组比较,MCAO+NS-MSCs 组与MCAO+SS-MSC 组Brdu、BDNF、NGF 表达水平均上升(P<0.05 或P<0.01);MCAO+FBS-MSCs 组仅BrdU表达水平升高(P<0.01)。与MCAO+FBS-MSCs 组比较,MCAO+SS-MSCs 组BDNF、BrdU、NGF 表达水平均上升(P<0.05、P<0.01);MCAO+NS-MSC 组NGF 表达水平上升(P<0.01)。与MCAO+NS-MSCs 组比较,MCAO+SSMSCs 组BrdU、BDNF、NGF 表达水平均上升(P<0.05)。见图8。

图8 A. 脑组织中BrdU、BDNF与NGF水平表达情况(免疫组化染色×200,×400);B. 脑组织BrdU、BDNF与NGF表达水平
3 讨论
MSCs 移植治疗缺血性脑卒中主要机制为细胞替代,血管生成及神经系统重建,并具有降低外周免疫抑制作用[2]。ASGARI 等[4]研究发现,脑卒中血清预处理MSCs 可通过CXCR4 和C-Met 信号迁移至梗死区,提高其治疗效果;MOON 等[5]研究表明,MSCs 经中风患者血清预处理可通过血管生成提高MSCs修复脑损伤的作用。
本研究造模的MCAO 大鼠神经功能缺损严重,与ZHAI 等[6]研究结果相符,而MSCs 移植干预可降低双侧贴纸去除时间、mNSS 评分,其中MCAO+SS-MSC 组改善效果明显,表明经脑卒中血清预处理MSCs 移植改善神经功能缺损效果最佳。可能是由于大鼠脑卒中血清中培养扩增MSCs 可维持骨髓细胞特征,因而更利于神经功能恢复[7]。
本研究结果显示,与sham 组比较,MCAO 大鼠脑梗死面积明显增加,脑组织及神经元病理性损伤加重,而MSCs 移植干预可有效减少脑梗死面积,改善脑组织损伤,且MCAO+SS-MSC 组改善明显。研究发现,VEGF、BDNF 表达水平升高对缺血性脑卒中有明显保护作用[8]。VEGF 参与调控内皮祖细胞,在血管生成、神经保护及建立侧支循环方面均有重要作用[9]。BDNF 可改善神经可塑性[10],介导抗凋亡机制延缓神经细胞凋亡,诱导神经再生[11]。NGF 为神经细胞生长调节因子,在缺血缺氧状态下,可促进神经细胞增殖,修复受损神经,维持神经元正常生理功能。而HGF 为多效性生长因子,参与生长、再生及重塑等过程,其在梗死灶周围表达呈上升趋势。本研究中,MCAO+SS-MSC 组BDNF、NGF、HGF、VEGF 水平较MCAO 组升高(P<0.01),且高于MCAO+FBS-MSCs 组、MCAO+NS-MSCs 组。免疫组化结果显示MCAO+SS-MSCs 组Brdu、BDNF、NGF表达水平较MCAO 组均上调,且高于MCAO+FBS-MSCs组、MCAO+NS-MSCs 组,表明脑卒中经血清预处理的MSCs 更能向脑组织梗死区迁移。
综上所述,经脑卒中血清预处理的MSCs 移植成功率高,且神经改善效果好,可能与脑卒中血清预处理能够增强MSCs 的活力和迁移能力,抑制脑组织细胞凋亡,上调BDNF、NGF、HGF、VEGF 水平有关。

