黑切牛肉贮藏过程中活性氧相对含量变化及其与肉品质指标相关性分析
陈明 袁婷 涂俏 叶慧兰 雷海悦 王佳昱 马安方 辛建增


摘 要:活性氧在宰后肉品质形成过程中起重要作用,研究活性氧在黑切(dark, firm and dry,DFD)牛肉中对肉品质变化的影响。以黑切牛肉(pH24 h>6.2)为研究对象,取宰后4 ℃排酸24 h牛肉,4 ℃贮藏,在贮藏1、24、72、120 h分别测定活性氧相对含量、色差值、pH值、蒸煮损失率、滴水损失率、羰基含量及巯基含量,并进行相关性分析。结果表明:贮藏期间黑切牛肉的pH值大于6.5,显著高于正常牛肉;活性氧相对含量在贮藏期间呈升高趋势,一直高于60 (mg/L)/min,贮藏72、120 h高于正常牛肉;红度值在贮藏期间均在4.47以下,低于正常牛肉;滴水损失率低于8.90%,蒸煮损失率低于28.10%,均低于正常牛肉;羰基含量高于2.80 nmol/mg、巯基含量高于37.16 nmol/mg,羰基含量在贮藏72、120 h高于正常牛肉,巯基含量贮藏期间低于正常牛肉;相关性分析表明,黑切牛肉中活性氧与肌肉蛋白质氧化指标羰基含量、巯基含量显著相关。活性氧与黑切牛肉成熟过程中肉品质形成密切相关,其可能是调控黑切牛肉品质变化的重要因子。
关键词:黑切牛肉;活性氧;蛋白氧化;保水性;肉品质
Abstract: Studies have confirmed that reactive oxygen species (ROS) play an important role in the development of postmortem meat quality. This research studied the effect of ROS on the change of meat quality in dark, firm and dry (DFD) beef. DFD beef after postmortem aging at ℃for 24 h (pH24 h > 6.2) was stored at 4 ℃ and measured for relative ROS content, color difference, pH, cooking loss, drip loss, carbonyl content and sulfhydryl content after 1, 24, 72 and 120 h, and correlation analysis was performed. The results showed that the pH value of DFD beef during storage was greater than 6.5 and significantly higher than that of normal beef. The relative content of ROS in DFD showed an increasing trend during storage, which was always higher than 60 (mg/L)/min, and was higher than that of normal beef after 72 and 120 h. The a* value remained below 4.47 and lower than that of normal beef. The drip loss was lower than 8.90%, and the cooking loss was lower than 28.10%, both of which were lower than those of normal beef. The carbonyl content in DFD was higher than 2.80 nmol/mg and higher than that in normal beef after 72 and 120 h, and the sulfhydryl content was higher than 37.16 nmol/mg and lower than that in normal beef after storage for up to 120 h. Correlation analysis showed that ROS in dark cutting beef was significantly correlated with muscle protein oxidation indicators such as carbonyl and sulfhydryl contents. The results of the study revealed that ROS is closely related to the development of meat quality during the postmortem aging of dark cutting beef, and it may be an important factor regulating the quality change of DFD.
Keywords: dark cutting beef; reactive oxygen species; protein oxidation; water-holding capacity of muscle; meat quality
DOI:10.7506/rlyj1001-8123-20230209-013
中圖分类号:TS251.5 文献标志码:A 文章编号:
引文格式:
陈明, 袁婷, 涂俏, 等. 黑切牛肉贮藏过程中活性氧相对含量变化及其与肉品质指标相关性分析[J]. 肉类研究, 2023, 37(5): . DOI:10.7506/rlyj1001-8123-20230209-013. http://www.rlyj.net.cn
CHEN Ming, YUAN Ting, TU Qiao, et al. Changes in the relative content of reactive oxygen species in dark cutting beef and its correlation with meat quality characteristics during storage[J]. Meat Research, 2023, 37(5): . (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230209-013. http://www.rlyj.net.cn
随着我国经济社会的快速发展,人们的饮食水平在逐渐提升,肉类的消费水平也在不断升级,牛肉因具有脂肪含量低、蛋白含量高、氨基酸种类齐全、味道鲜美等特点而深受广大消费者喜爱[1]。黑切(dark, firm and dry,DFD)牛肉是一种牛肉生产领域常见的劣质牛肉,颜色发黑发暗,切面干燥且坚硬,货架期短,但其往往具有较高的保水能力[2],其最典型特点是极限pH值比较高,通常大于6.2,嫩度较低,食用品质较差[3]。相关研究已证实,黑切牛肉pH值越高,其色泽、剪切力和滴水损失等越小[4]。且因为黑切牛肉的极限pH值高,导致肌细胞中的氧化酶活性较高,这可使颜色鲜红的氧合肌红蛋白转化为暗褐色的脱氧肌红蛋白,而肌肉颜色变黑,这是黑切牛肉颜色发黑的原因之一[5]。
活性氧是动物机体几乎随时都在产生的物质,活体动物体中活性氧的产生和清除保持着动态平衡,机体将其维持在一定范围内,从而保证细胞正常代谢。肌细胞在宰后贮藏过程中也会产生大量活性氧,而此时由于动物生命终止后,机体的活性氧代谢稳态被打乱,活性氧含量上升,这会对肌细胞的结构和功能造成一定损害[6]。黑切牛肉在贮藏成熟过程中也会产生活性氧,然而活性氧在黑切牛肉贮藏过程中如何调控肉品质缺少相应的深入研究。
本研究以黑切牛肉(pH24 h>6.2)为研究对象,取宰后4 ℃排酸24 h牛左侧背最长肌,4 ℃贮藏,在贮藏的1、24、72、120 h分别测定活性氧相对含量、色差值、pH值、蒸煮损失率、滴水损失率、羰基含量及巯基含量,并进行相关性分析。探究黑切牛肉贮藏期间活性氧相对含量变化及其对肉品质形成的影响,以期为闡明活性氧在黑切牛肉成熟过程中调控肉品质机理提供一定的研究基础。
1 材料与方法
1.1 材料与试剂
实验牛肉由伊德肉业食品有限公司提供,从屠宰的80 头西门塔尔肉牛(去势公牛,年龄1~2 岁,平均体质量(715.00±40.24) kg)中,取宰后牛左侧背最长肌在4 ℃条件下贮藏24 h,用便携式pH计测定肉样pH值(pH24 h),pH24 h>6.2被认定为黑切牛肉,pH24 h<6.2为正常牛肉,筛选得到黑切肉牛5 头,取正常肉牛5 头,在测定pH24 h后的1、24、72、120 h,分别测定色差值、pH值、活性氧相对含量、蒸煮损失率和滴水损失率,并在相应的时间点留样20 g,先用液氮速冻1 min,然后置于-80 ℃冰箱备用,测定羰基含量及巯基含量。
三羟基氨基甲烷(Tris)、5,5-二硫代双(2-硝基苯甲酸)(5,5-dithio bis(2-nitrobenzoic acid),DTNB)、盐酸胍、2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)、甘氨酸 北京索莱宝技术有限公司;二乙胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA-2Na)、EDTA、磷酸三钠 天津科蒙化工有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、乙酸乙酯、尿素、无水乙醇、盐酸、三氯乙酸 天津风船化工试剂有限公司;磷酸二氢钾 天津永晟化工有限公司;氢氧化钠、酒石酸钾钠 天津化学试剂三厂;标准蛋白溶液 北京市酷来博科技有限公司;无水硫酸铜 天津永成化工试剂有限公司;蔗糖 天津北宏试剂厂;氯化钠 广东省精细化工开发中心;以上试剂均为分析纯。
1.2 仪器与设备
Testo 205便携式pH计 德国仪器贸易有限公司;PHS-3实验室pH计 奥豪斯仪器有限公司;BC∕BD-220GS海尔电冰箱、DW-86L 728ST海尔超低温冰箱 青岛海尔电冰柜有限公司;Biofuge Stratos冷冻高速离心机 美国Thermo公司;HH-4电热恒温水浴锅 北京泰特仪器有限公司;T6-新世纪可见分光光度计 上海菁华科技仪器有限公司;FSH-2A可调高速匀浆机 金坛市新瑞仪器厂;DHG-9140A电热鼓风干燥箱 上海恒瑞科学仪器有限公司;HQ45Z恒温摇床 武汉中科技术有限责任公司;ACS电子天平 上海桦利电子有限公司;Synergy HT多功能酶标仪 美国BioTek公司;Scientific超低温冰箱 上海求精生化试剂仪器有限公司;Dsf70便携式色差计 深圳博科有限公司。
1.3 方法
1.3.1 色差值的测定
采用CIE-L*a*b*法测定牛肉样品的色差值,参考Hunt等[7]的方法并稍作修改。测量时需在牛肉样品表面覆盖透明聚氯乙烯保鲜膜,用便携式色差计测定样品亮度值(L*)、红度值(a*)和黄度值(b*),每个样品测定5 个平行。
1.3.2 pH值的测定
首先将便携式pH计进行校准,然后将探头插入被测肉样中,当示数趋于稳定后,读取并记录数据,每个样品测定5 个平行。
1.3.3 活性氧相对含量的测定
荧光探针DCFH-DA在细胞酯酶的作用下水解生成DCFH,继而又被组织中的活性氧氧化生成有荧光的DCF(脱氢DCFH),因此,检测DCF的荧光变化即可计算细胞内活性氧的水平。
参考张玉林[8]、刘宁[9]等的方法并稍作修改:将1 g剔除可见脂肪、结缔组织的牛肉样品放入盛有6 mL Tris-HCl缓冲液(含10 mmol/L Tri-HCl、0.8 g/100 mL NaCl、10 mmol/L蔗糖、0.1 mmol/L EDTA-2Na,pH 7.4)的试管中,将试管置于冰水浴中用手术剪剪碎样品后,高速匀浆机匀浆,3 000×g、4 ℃离心15 min,弃去沉淀保留上清,并且用双缩脲试剂法测定上清液的蛋白质量浓度。
100 μL上清液和100 μL缓冲液(含10 mmol/L Tris-HCl缓冲液、0.8 g/100 mL NaCl、0.1 mmol/L EDTA-2Na、10 mmol/L蔗糖、10 μmol/L DCFH-DA,pH 7.4)在酶标板内混合均匀后调节最大发射波长525 nm,激发波长480 nm,用酶标仪测定孵育前的荧光值。然后在温度为37 ℃的条件下用摇床孵育40 min,测定孵育后的荧光值。活性氧相对含量按式(1)计算。
1.3.5 肌原纤维蛋白的提取
参考李银[10]的方法并稍作修改。取牛肉样品,去掉可见脂肪及结缔组织后切碎,准确称取切碎后的牛肉样品2 g,与8 mL分离缓冲液(含0.1 mol/L NaCl、2 mmol/L MgCl2、10 mmol/L Na3PO4、1 mmol/L EGTA,pH 7.0)在离心管内进行混合匀浆,然后2 000×g、4 ℃离心15 min,弃上清后得到的沉淀再加入8 mL分离缓冲液按上述相同的条件离心2 次。最后得到的沉淀再用同样的方法和条件与8 mL 0.1 mol/L NaCl溶液混合并离心1 次,然后用3 层纱布进行过滤,滤去肌膜、肌腱和脂肪等,并用0.1 mol/L HCl溶液调节其pH值为6.0,最后将匀浆液以上述同样的条件离心1 次,弃上清后即得到肌原纖维蛋白。
1.3.6 肌原纤维蛋白质量浓度测定
采用双缩脲法进行测定。双缩脲试剂配制:将0.75 g CuSO4·5H2O、3.0 g KNaC4H4O6·4H2O溶解于150 mL 10 g/100 mL NaOH溶液,并用蒸馏水定容至500 mL然后分装备用。将标准蛋白(牛血清白蛋白)溶液配制成0、0.2、0.4、0.6、0.8、1.0 mg/mL的溶液,取18 支试管标号并分成3 组,每组6 只试管,分别加入0、0.2、0.4、0.6、0.8、1.0 mL标准蛋白溶液,对应的试管分别加入1.0、0.8、0.6、0.4、0.2、0 mL蒸馏水,然后将4 mL双缩脲试剂加入到6 只试管中,摇匀后静置30 min,以0 mg/mL溶液作为空白对照,在540 nm波长处测定吸光度,绘制标准曲线。最后将1 mL待测肌原纤维蛋白溶液与4 mL双缩脲试剂混匀,以同样的条件测定吸光度,利用标准曲线计算肌原纤维蛋白质量浓度。
1.3.7 肌原纤维蛋白氧化的测定
1.3.7.1 羰基含量的测定
参考闫利国[11]、贡慧[12]等的方法并稍作改进。将1 mL肌原纤维蛋白溶液与1 mL 10 mmol/L DNPH溶液混合均匀,25 ℃静置1 h。空白对照样品中加入1 mL 2 mol/L HCl溶液,然后2 组样品均加入2 mL 20 g/100 mL三氯乙酸进行蛋白沉淀,混合均匀后11 000×g、4 ℃离心5 min,蛋白沉淀用2 mL乙醇-乙酸乙酯混合液(体积比1︰1)洗涤3 次后用5 mL 6 mol/L盐酸胍溶解,然后在37 ℃水浴条件下加热30 min,11 000×g离心5 min,最后取上清液在370 nm波长处测定吸光度。羰基含量按式(4)计算。
1.4 数据处理
采用SPSS 17.0及Excel 2013软件进行数据整理和分析,采用独立样本t检验和ANOVA方差分析中LSD法对各组数据进行显著性分析(P<0.05),实验结果均表示为平均值±标准差。
2 结果与分析
2.1 宰后肉色的变化
由表1可知,2 组牛肉样品L*在贮藏期间均呈现先升高后下降的趋势,但表现形式不完全相同。正常牛肉贮藏72 h时L*最高,且与1 h差异显著(P<0.05),但与另外2 个时间点数值差异不显著。黑切牛肉贮藏24 h时L*最高,且与72、120 h差异显著(P<0.05)。组间比较显示,2 组牛肉样品贮藏1、24 h的L*差异不显著,但贮藏72、120 h,正常牛肉均显著高于黑切牛肉(P<0.05)。正常牛肉a*在贮藏期间呈升高趋势,且贮藏期间的后3 个时间点均显著高于贮藏1 h时,a*贮藏期间波动小,相对较稳定。黑切牛肉a*在贮藏期间也呈升高趋势,且贮藏72 h和120 h差异显著(P<0.05),说明其a*在贮藏后期显著升高。组间比较表明,贮藏1、24、72 h,正常牛肉a*均显著高于黑切牛肉(P<0.05),说明其色泽优于黑切牛肉。2 组样品b*变化趋势也存在差异。正常牛肉b*呈升高趋势,贮藏72、120 h的b*显著高于贮藏1、24 h(P<0.05)。黑切牛肉4 个贮藏时间b*均差异显著,贮藏期间有先下降后上升的趋势。组间比较显示,正常牛肉b*在贮藏1、24、72 h时均显著高于黑切牛肉(P<0.05)。
肉色是评价牛肉品质的重要指标,消费者在购买生肉时,往往会根据肉色判断肉品质优劣。在放血充分的肌肉中,肉色主要是由肌红蛋白的含量和存在状态决定的[15]。a*是反应肉色的一个重要指标,它的值高且波动小,说明鲜肉中氧合肌红蛋白的比例高且肉色稳定,此时,鲜肉会呈现出鲜艳的红色。在本研究中,正常牛肉a*在贮藏期间高于黑切牛肉,且数值波动小,说明正常牛肉的肉色稳定性高于黑切牛肉。这与Tang[16]、Mckeith[17]等的研究结果相一致。本研究中黑切牛肉a*波动大,可能主要与黑切牛肉的生理代谢状态有关,黑切牛肉由于宰后pH值较高,使其线粒体还能保持相当的活性[18],在宰后成熟过程中会与肌红蛋白竞争氧气,导致其肉色劣变,且肉色不稳定。
Swatland[19]的研究表明,肉品pH值越高,L*会较低,其表面会比较干燥,主要原因为高pH值大于肌肉蛋白质等电点,肌肉蛋白未发生凝聚,导致游离水分并未渗出[20]。而Juncher等[21]对猪肉的研究结果表明,肌肉宰后最终乳酸水平与L*呈线性相关,乳酸含量高,L*也高。研究结果证实,在贮藏的72、120 h,正常牛肉的L*显著高于黑切牛肉,这与前人的研究结果类似。
2.2 宰后pH值的变化
小写字母不同,表示同组样品、不同贮藏时间差异显著(P<0.05);大写字母不同,表示同一贮藏时间、不同样品差异显著(P<0.05)。图2~6同。
由图1可知,2 组牛肉样品pH值在贮藏期间变化较小,正常牛肉在贮藏的1~24 h显著降低(P<0.05),在以后的贮藏时间保持相对稳定,而黑切牛肉pH值在贮藏的120 h显著下降,均低于前3 个时间点。组间比较显示,贮藏期间黑切牛肉pH值均高于正常牛肉,且在后3 个时间点差异显著(P<0.05)。
宰后肌肉pH值下降主要是由于动物宰杀放血后,呼吸停止,导致氧气供应中止,肌肉在无氧条件下利用肌糖原产生乳酸所致。黑切牛肉的产生主要因为多种因素的作用,如待宰方式、屠宰方式、屠宰季节等,导致肌糖原被提前消耗,不能够产生足够的乳酸来实现pH值的降低[3]。本研究参考Fjelkner-Modig[22]的研究,以pH24 h>6.2作为区分黑切牛肉与正常牛肉的标准,结果显示,黑切牛肉pH值在贮藏期间均保持在6.2以上,且相关肉品指标符合黑切肉特征。
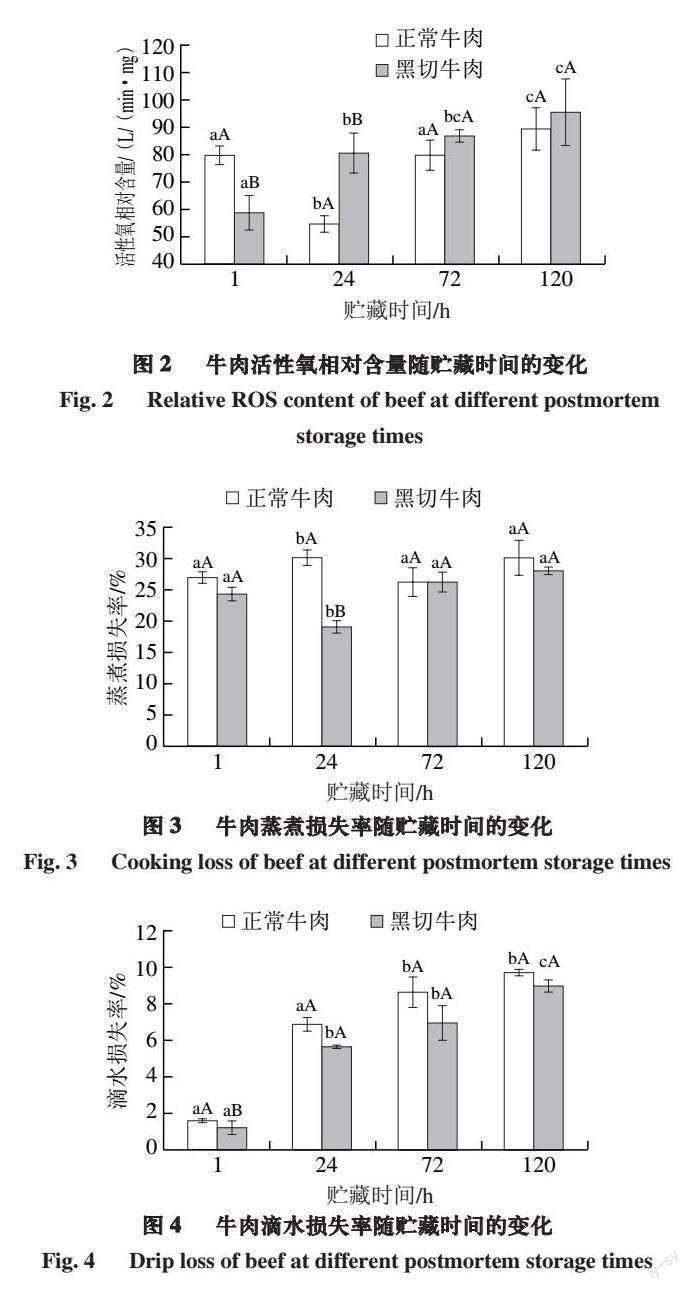
2.3 宰后活性氧相对含量的变化
由图2可知,2 组牛肉样品贮藏期间,活性氧相对含量均呈上升的趋势,但变化趋势有所不同。正常牛肉活性氧相对含量呈现先降低后升高的趋势,在贮藏24 h显著降低,然后升高。黑切牛肉活性氧相对含量在贮藏期间升高,且均显著高于1 h(P<0.05)。组间比较显示,贮藏1 h,正常牛肉的活性氧相对含量显著高于黑切牛肉,随着贮藏时间的延长,黑切牛肉活性氧相对含量逐渐高于正常牛肉,且在贮藏24 h差异显著(P<0.05)。
活性氧是肌细胞在代谢过程中产生的化学性质活泼的氧自由基和能转化为自由基的物质,主要包括羟自由基(·OH)、超氧阴离子自由基基(O2-·)、过氧游离基(ROO·)等氧自由基和氢过氧化物(ROOH)、过氧化氢(H2O2)等某些非自由基物质[23]。宰后肌肉成熟过程中活性氧通常认为主要来源于线粒体[24-25],有研究证实,牛肉在4 ℃条件下贮藏,在宰后144 h仍然能够分离得到完整的线粒体[26],线粒体呼吸链的“电子漏”是产生活性氧的主要原因[23]。在宰后肌肉中活性氧已被证实与很多肉品质密切相关,如肉色、嫩度、系水力等[27]。本研究结果表明,黑切牛肉中活性氧相对含量增长趋势高于正常牛肉,主要可能是因为黑切牛肉的高pH值使肌肉中线粒体保持比较活跃的状态,从而产生更多的活性氧[3]。
2.4 宰后保水性的变化
由图3可知,2 组牛肉样品的蒸煮损失率在贮藏期间有增加的趋势,说明在宰后成熟过程中其保水性逐渐降低,但随着时间的延长,蒸煮损失率波动幅度减小。贮藏期间,正常牛肉的蒸煮损失率高于黑切牛肉,但差异不显著。黑切牛肉在贮藏24 h后蒸煮损失率逐渐增加,说明黑切牛肉宰后贮藏过程中保水性在逐渐减弱。贮藏1、24 h,正常牛肉的蒸煮损失率逐渐增加,而黑切牛肉显著降低(P<0.05)。
由图4可知,2 组牛肉样品滴水损失率在贮藏期间均呈上升趋势,并且在贮藏1、24 h,黑切牛肉上升趋势显著(P<0.05),而正常牛肉1、24 h的滴水损失率与72、120 h差异显著(P<0.05)。贮藏1 h,2 组牛肉样品差异显著(P<0.05),24、72、120 h差异不显著。
滴水损失率和蒸煮损失率均能反映肌肉的保水性,牛肉保水性也是評价产品口感与消费者满意程度的重要指标[28]。肉的保水性指的是当肌肉受到外力作用时,其保持原有水分与外源添加水分的能力,其对研究肉的各项品质具有重要意义,而且对肉的滋味、嫩度、结构、产量、经济价值等产生影响[29]。影响肉保水性的因素有很多,主要有肌肉蛋白的空间构型、肌细胞的结构完整性、pH值和脂肪含量等[30]。
2 组牛肉在贮藏的1~24 h滴水损失率急剧上升,24~72 h上升缓慢。宰后贮藏较短时间内,肉的保水性下降,蒸煮损失率增加。随着宰后时间的延长,保水性增加,蒸煮损失率降低。这是因为在这期间出现了僵直期,肌动球蛋白的形成会导致肌肉保水性下降。在牛肉成熟期间,线粒体会产生活性氧,导致蛋白质和脂肪氧化,这会损害肌肉结构完整性,导致其持水能力下降。此外,肌原纤维蛋白还会和一些金属离子发生反应,产生蛋白质自由基,使保水性逐渐上升[31]。Kristensen[32]、Bertram[33]等研究认为,肌肉成熟过程中,骨架蛋白发生降解,肌原纤维基质膨胀,肌原纤维间隙增加,胞外水分重新渗入胞内,使肉的持水能力增加。
黑切牛肉的蒸煮损失率和滴水损失率比正常牛肉小,这是因为黑切牛肉pH值太高而偏离蛋白质等电点,并且带有较多电荷,从而减少了蛋白分子的吸引力,使肌肉中游离水与其结合紧密[34],所以其保水性高于正常牛肉。
2.5 宰后羰基含量的变化
由图5可知,在贮藏期间,2 组牛肉样品羰基含量均呈上升趋势,贮藏120 h羰基含量显著高于1、24、72 h(P<0.05),且贮藏72 h样品羰基含量显著高于前2 个时间点(P<0.05)。组间比较表明,黑切牛肉羰基含量在贮藏的72、120 h显著高于正常牛肉(P<0.05)。
2.6 宰后巯基含量的变化
由图6可知,2 组牛肉样品巯基含量在贮藏期间呈下降趋势,贮藏120 h巯基含量显著低于前3个贮藏时间点。组间比较显示,贮藏期间黑切牛肉巯基含量一直低于正常牛肉,但仅在24 h差异显著(P<0.05)。
肌肉中蛋白质氧化水平与肉品质密切相关,肌肉蛋白发生过度氧化会导致肉品质劣变,如保水性、嫩度、肉色等品质严重下降,造成经济损失[35-36]。羰基、巯基含量是反映蛋白质氧化程度的最常见指标[37]。其中羰基主要来源于蛋白质肽链上的NH—或NH2—,它们在受到活性氧攻击时会被氧化成羰基,肌肉蛋白的空间结构会发生变化,从而对肉品质产生影响,同样肽链上的巯基被氧化也会改变肉品质[38]。在本研究中,黑切牛肉的羰基含量在贮藏期间均呈现上升趋势,巯基含量呈下降趋势,且在贮藏72、120 h,黑切牛肉羰基含量显著高于正常牛肉。说明黑切牛肉蛋白质氧化程度高于正常牛肉,这主要与过高的pH值有关,高pH值导致线粒体在宰后的一定时间内保持活性,产生的活性氧含量高,导致蛋白氧化程度相对较高。黑切牛肉的活性氧含量和羰基含量在贮藏期间有高于正常牛肉的趋势,这与程述震等[39]的研究结果相似。
2.7 2 组牛肉样品各指标相关性分析
由表2可知,正常牛肉的pH值和a*、滴水损失率呈显著负相关性(P<0.05),即pH值越高,a*和滴水损失率越小。滴水损失率和蒸煮损失率也呈显著负相关(P<0.05),说明滴水损失率越大,蒸煮损失率越小。此外,羰基含量和b*呈显著正相关(P<0.05)。且活性氧相对含量与蒸煮损失率、羰基含量和巯基含量的相关系数分别为-0.678、0.663和-0.683。
由表3可知,黑切牛肉pH值与a*呈显著负相关(P<0.05),即pH值越大,a*越小。活性氧相对含量与滴水损失率呈极显著正相关(P<0.01),与羰基含量呈显著正相关(P<0.05),说明在黑切牛肉中活性氧可能会对牛肉的保水性和蛋白质氧化产生重要影响。黑切牛肉中羰基含量与L*呈极显著负相关(P<0.01),与巯基含量呈显著正相关(P<0.05)。
3 结 论
在贮藏过程中,黑切牛肉pH值显著高于正常牛肉,牛肉样品活性氧相对含量均呈上升趋势,黑切牛肉活性氧相对含量高于正常牛肉。正常牛肉的多项指标优于黑切牛肉,如羰基含量、巯基含量低于黑切牛肉,色泽稳定性高于黑切牛肉。然而,黑切牛肉的保水性优于正常牛肉。相关性分析结果表明,黑切牛肉中活性氧与肌肉蛋白质氧化指标羰基含量、巯基含量显著相关,且活性氧与肉色、滴水损失率、蒸煮损失率等指标也存在一定的相关性。研究结果表明,活性氧与黑切牛肉成熟过程中肉品质密切相关,会影响牛肉的色泽、保水性、蛋白质氧化等品质,其可能是影响黑切牛肉品质形成的一项重要因子。
参考文献:
[1] VAHMANI P, PONNAMPALAM E N, KRAFT J, et al. Bioactivity and health effects of ruminant meat lipids: invited review[J]. Meat Science, 2020, 165(1): 108114. DOI:10.1016/j.meatsci.2020.108114.
[2] 張怡宁. 基于消费者视觉评价对黑切牛肉颜色和pH阈值的确定[D]. 泰安: 山东农业大学, 2020. DOI:10.27277/d.cnki.gsdnu.2020.001137.
[3] 卢骁, 朱立贤, 毛衍伟, 等. DFD牛肉研究进展[J]. 食品科学, 2015, 36(19): 271-276. DOI:10.7506/spkx1002-6630-201519049.
[4] 杜燕, 张佳, 胡铁军, 等. 宰前因素对黑切牛肉发生率及牛肉品质的影响[J]. 农业工程学报, 2009, 25(3): 277-281.
[5] 牛乐宝. DFD牛肉关键品质异变机理及气调保鲜对DFD牛肉品质改善研究[D]. 泰安: 山东农业大学, 2016: 33-39.
[6] 张小涛. 鹅肉ROS形成对宰后caspase介导细胞骨架蛋白降解的影响[D]. 宁波: 宁波大学, 2013: 3-43.
[7] HUNT M C, KING A, BARBUT S, et al. AMSA meat colormeasurement guidelines[M]. Illinois: American Meat Science Association, 2012: 45-72. DOI:10.22175/mmb.12473.
[8] 张玉林, 曹锦轩, 潘道东, 等. 成熟过程中活性氧簇(ROS)对肌原纤维蛋白结构的影响[J]. 现代食品科技, 2014, 30(9): 26-32; 108. DOI:10.13982/j.mfst.1673-9078.2014.09.005.
[9] 刘宁, 王軻, 赵歌. 递增负荷运动训练对大鼠血清及部分组织MDA、ROS含量和SOD活性变化的影响[J]. 青海医学院学报, 2008, 29(4): 240-244; 259. DOI:10.13452/j.cnki.jqmc.2008.04.017.
[10] 李银. 蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014: 9-15.
[11] 闫利国, 唐善虎, 王柳, 等. 冷冻贮藏过程中氧化诱导牦牛肉肌原纤维蛋白结构的变化[J]. 食品科学, 2015, 36(24): 337-342. DOI:10.7506/spkx1002-6630-201524062.
[12] 贡慧, 史智佳, 陈文华, 等. 关于几种蛋白氧化后羰基含量的对比研究[J]. 化学试剂, 2014, 36(11): 1014-1016; 1035. DOI:10.13822/j.cnki.hxsj.2014.11.012.
[13] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[14] 孙圳. 牛肉亚冻结保藏品质变化与水分迁移机制[D]. 北京: 中国农业科学院, 2017: 1-20.
[15] SUMAN S P, JOSEPH P. Myoglobin chemistry and meat color[J]. Annual Review of Food Science and Technology, 2013, 4: 79-99. DOI:10.1146/annurev-food-030212-182623.
[16] TANG J, FAUSTMAN C, HOAGLAND T A, et al. Postmortem oxygen consumption by mitochondria and its effects on myoglobin form and stability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 1223-1230. DOI:10.1021/jf048646o.
[17] MCKEITH R O, KING D A, GRAYSON A L, et al. Mitochondrial abundance and efficiency contribute to lean color of dark cutting beef[J]. Meat Science, 2016, 116: 165-173. DOI:10.1016/j.meatsci.2016.01.016.
[18] 吴爽, 王磊, 杨啸吟, 等. 基于肌浆蛋白质组研究黑切牛肉的形成机制[J]. 食品科学, 2020, 41(5): 1-7. DOI:10.7506/spkx1002-6630-20181231-368.
[19] SWATLAND H J. A review of meat spectrophotometry (300 to 800 nm)[J]. Canadian Institute of Food Science and Technology Journal, 1989, 22(4): 390-402. DOI:10.1016/s0315-5463(89)70435-1.
[20] 卢骁. 影响DFD牛肉发生因素调研及不同极限pH值牛肉与血液生化指标关系分析[D]. 泰安: 山东农业大学, 2016: 4-5.
[21] JUNCHER D, R?NN B, MORTENSEN E T, et al. Effect of pre-slaughter physiological conditions on the oxidative stability of colour and lipid during chill storage of pork[J]. Meat Science, 2001, 58(4): 347-357. DOI:10.1016/s0309-1740(00)00156-x.
[22] FJELKNER-MODIG S, RUDERUS H. The influence of exhaustion and electrical stimulation on the meat quality of young bulls: Part 1: post-mortem pH and temperature[J]. Meat Science, 1983, 8(3): 185-201. DOI:10.1016/0309-1740(83)90044-x.
[23] 张玉林. 宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D]. 宁波: 宁波大学, 2014: 2-10.
[24] MURPHY M P. How mitochondria produce reactive oxygen species[J]. Biochemical Journal, 2009, 417(1): 1-13. DOI:10.1042/BJ20081386.
[25] 李孟孟. 肉羊宰后ROS形成对caspase介导细胞骨架蛋白的影响[D]. 邯郸: 河北工程大学, 2020. DOI:10.27104/d.cnki.ghbjy.2020.000714.
[26] TANG J. The postmortem potential of mitochondria and its effects on myoglobin forms and stability[D]. Connecticut: University of Connecticut, 2005: 107-159.
[27] ZOU Bo, SHAO Lele, YU Qianqian, et al. Changes of mitochondrial lipid molecules, structure, cytochrome c and ROS of beef Longissimus lumborum and Psoas major during postmortem storage and their potential associations with beef quality[J]. Meat Science, 2023, 195: 109013. DOI:10.1016/j.meatsci.2022.109013.
[28] GIL M, RAM?REZ J A, PLA M, et al. Effect of selection for growth rate on the ageing of myofibrils, meat texture properties and the muscle proteolytic potential of M. longissimus in rabbits[J]. Meat Science, 2006, 72(1): 121-129. DOI:10.1016/j.meatsci.2005.06.014.
[29] 牛克兰. 冷鲜牦牛肉保水性及其蛋白功能特性研究[D]. 兰州: 甘肃农业大学, 2017: 10-15.
[30] 朱迎春, 李茜, 马俪珍, 等. 不同包装方式和贮藏温度对牛肉保水性的影响[J]. 食品研究与开发, 2016, 37(22): 15-19. DOI:10.3969/j.issn.1005-6521.2016.22.004.
[31] 張建华. HL-低钠盐对肌原纤维蛋白抗氧化及凝胶特性的影响[D]. 重庆: 西南大学, 2020. DOI:10.27684/d.cnki.gxndx.2020.002048.
[32] KRISTENSEN L, PURSLOW P P. The effect of ageing on the water-holding capacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23. DOI:10.1016/S0309-1740(00)00125-X.
[33] BERTRAM H C, WHITTAKER A K, SHORTHOSE W R, et al. Water characteristics in cooked beef as influenced by ageing and high-pressure treatment: an NMR micro imaging study[J]. Meat Science, 2004, 66(2): 301-306. DOI:10.1016/S0309-1740(03)00103-7.
[34] 左惠心, 温彬, 罗欣, 等. 宰后不同部位牛肉保水性变化和蛋白质特性研究[J]. 食品与发酵工业, 2022, 48(2): 45-51. DOI:10.13995/j.cnki.11-1802/ts.027663.
[35] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[36] KIM Y H, HUFF-LONERGAN E, SEBRANEK J G, et al. High-oxygen modified atmosphere packaging system induces lipid and myoglobin oxidation and protein polymerization[J]. Meat Science, 2010, 85(4): 759-767. DOI:10.1016/j.meatsci.2010.04.001.
[37] 张楠, 杨晨, 张伟伟, 等. 不同氧化/冷冻条件对乳清蛋白结构的影响[J]. 天津: 天津科技大学学报, 2022, 37(4): 1-8. DOI:10.13364/j.issn.1672-6510.20210209.
[38] GANHA?O R, MORCUENDE D, EST?VEZ M. Tryptophan depletion and formation of α-aminoadipic and γ-glutamic semialdehydes in porcine burger patties with added phenolic-rich fruit extracts[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3541-3548. DOI:10.1021/jf903356m.
[39] 程述震, 王志东, 张春晖, 等. 肉及肉制品中蛋白氧化的研究进展[J]. 食品工业, 2017, 38(1): 230-234.

