膜解剖理论在全腹膜外修补术斜疝疝囊分离中的应用
刘龙虎 张 琴 李 洋 赵士宇 徐继宗
1 湖北省远安县人民医院 湖北远安 444200; 2 三峡大学第二人民医院 湖北宜昌 443000
随着腹腔镜技术广泛的普及和推广,腹股沟斜疝的微创治疗在基层医院也得到了广泛的开展,其手术方式主要有全腹膜外修补术(TEP)、经腹腔腹膜前修补术(TAPP)、腹腔内修补术(IPOM)等[1-2]。其中,因TEP手术在腹膜外间隙进行操作,不进入腹膜腔,避免了腹腔内操作可能引起的肠粘连等并发症,从而成为指南推荐的首选腹腔镜疝修补术式[3]。但是,TEP操作空间有限,手术区域结构复杂,术中完整剥离斜疝疝囊较为困难,容易损伤腹膜导致手术中转开放[4]。我科将膜解剖理论应用于TEP术中,针对斜疝疝囊采取不同的分离方式取得了良好的效果,现回顾性分析在我院行TEP手术的180例斜疝患者临床资料,报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2019年4月—2021年6月在我院行TEP手术的180例斜疝患者临床资料,男170例,女10例;年龄(58.6±6.7)岁;病史3天到2年不等。其中,观察组83例,疝囊最大直径(4.3±1.4)cm,体质量指数(BMI)(27.6±2.8)kg/m2。对照组97例,疝囊最大直径(4.5±1.2)cm,体质量指数(BMI)(26.3±3.5) kg/m2。观察组运用膜解剖理论进行疝囊主动切开,对照组97例按传统方法常规剥离疝囊,两组一般资料(性别、年龄、BMI、疝囊最大直径)比较差异无统计学意义,具有可比性(P>0.05)(见表1)。

表1 两组一般资料比较
本研究经本院医学伦理委员会审核通过,患者及家属均知晓并签署知情同意书。纳入标准:①患者均明确诊断为单侧腹股沟斜疝,符合腹腔镜修补术式指南推荐首选术式;②疝囊最大直径大于3 cm;③无腹股沟区及下腹部手术病史者。排除标准:①有精神、语言或听力障碍不能配合研究者;②复发疝和既往有硬化剂治疗者;③排除嵌顿疝、直疝或复合疝;④合并严重的心脑血管疾病无法耐受全麻手术者;⑤合并严重的呼吸系统疾病不能耐受二氧化碳气腹者;⑥恶性肿瘤晚期、肿瘤有复发转移者。
1.2 手术方法
1.2.1 对照组 采用气管插管全身麻醉,按照《腹股沟疝腹腔镜手术操作指南(2017版)》中TEP手术操作步骤进行[5]:①在脐下取约1.0 cm横切口,切开腹直肌前鞘,用小拉钩将腹直肌向两侧牵开,进入到腹直肌和腹直肌后鞘之间的间隙,沿后鞘使用镜头推镜进入腹膜前间隙。②向耻骨膀胱间隙(Retzius间隙)方向进行分离,扩展腹膜前间隙,充分扩展手术区域空间,显露耻骨联合和耻骨梳韧带。③辨认腹壁下动脉的位置和走向,在其外侧找到腹横筋膜和腹膜(斜疝外侧缘)之间的间隙,沿此进入髂窝间隙(Bogros间隙),分离至髂前上棘水平。④Retzius间隙和Bogros间隙分离完成,即可显露斜疝疝囊。⑤将斜疝疝囊从腹股沟管内回纳至内环口,并继续与其后方的精索血管、输精管分离至内环口下方约6cm。如需横断疝囊,则在疝囊和精索之间先分离出间隙,穿过缝线结扎后再横断疝囊。⑥放置网片完整覆盖肌耻骨孔,后用器械压住补片的下缘,将CO2气体缓缓释放,保证补片下方不会发生卷曲(见图1)。

图1 对照组
1.2.2 观察组 在进行到第4步后,充分牵拉侧展斜疝疝囊,于靠近内环口处切开面向术者一侧的囊壁,注意精细操作避免损伤疝内容物,然后提起切开的疝囊采用类似开放切开疝囊的手法环形切开整圈疝囊,并壁化精索至内环口下方约6 cm,放置好网片后采用可吸收丝线连续缝合或套扎器关闭破损腹膜。其余步骤同对照组(见图2)。

图2 观察组
两组均选用美国巴德公司轻量型3Dmax网片,放置好后予北京福爱乐公司医用胶固定。术中任何腹膜破损都应关闭,建议术后常规进入腹腔探查腹膜有无破损、补片是否展平、有无疝内容物损伤等情况。
1.3 观察指标
比较两组手术时间、术后住院时间、术后12 h疼痛评分、手术室费用、术中副损伤(输精管、精索血管、肠管)、并发症发生率(血清肿、切口感染、慢性疼痛)。术后疼痛评分采用数字分级法(numerical rating scale,NRS):0为无痛;1~3为轻度疼痛;4~6为中度疼痛;7~10为重度疼痛。术后均随访12个月,统计复发和慢性疼痛情况以及患者满意度。
1.4 统计学处理
2 结果
两组患者均手术顺利,无中转开放。观察组手术时间(48.6±13.5)min较对照组(62.8±12.2)min显著缩短,差异有统计学意义(P<0.05)。两组患者术后住院时间、术后12 h疼痛评分、手术室费用、术中副损伤比较差异均无统计学意义(P>0.05),观察组与对照组比较差异有统计学意义(P<0.05),提示在膜解剖理论基础上选择不同的疝囊分离方式均不易造成术中输精管、精索血管及肠管的副损伤(见表2)。

表2 两组临床指标比较
两组患者术后并发症的比较:两组患者术后切口感染和慢性疼痛发生率比较差异无统计学意义(P>0.05);观察组血清肿发生率较对照组高,差异有统计学意义(2=6.052,P<0.05),提示疝囊主动切开不会增加切口感染和慢性疼痛,但可能导致血清肿发生率升高。所有患者术后均随访6个月,无肠梗阻、复发、慢性疼痛、补片感染等严重并发症发生(见表3)。
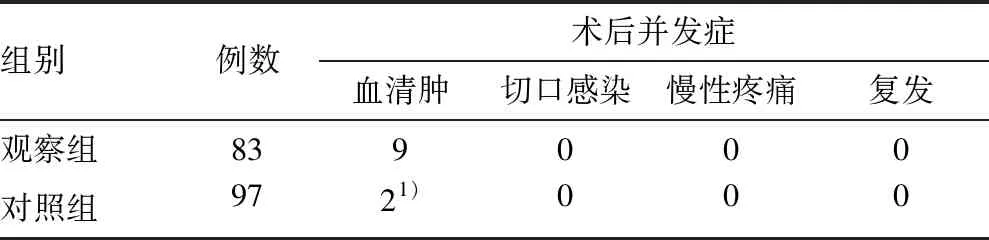
表3 两组术后并发症比较
3 讨论
目前,膜解剖理论在胃肠外科手术中应用较广,其核心理论认为组织与组织之间存在具有功能的膜结构,并强调系膜与系膜床的解剖[6]。在疝外科领域,部分外科医生存在一定的误区,认为疝手术简单普及,将膜解剖理论应用于疝外科没有实际价值。但我们必须清楚的意识到,外科技术的进步与解剖的新进展和新认识是密不可分的,疝手术反而更需要将精确的解剖知识和外科技能完美结合,膜解剖的核心思想“筋膜间平面”和“联合筋膜平面”可指导我们将疝手术做得更加精细和完美。尤其是随着腹腔镜技术的进步,在从局部解剖发展到亚微外科的今天,每当对疝的解剖有了新的认识,疝外科的发展就会向前取得明显的进步,例如髂耻束、耻骨肌孔理念的提出等[7],腹股沟疝术式的演变正验证了这一点。
腹股沟疝术式千变万化,分Lichtenstein术、网塞修补术、腹膜前补片修补术、全腹膜外腹膜前修补术(TEP)、经腹腔腹膜前修补术(TAPP)、腹腔内补片修补术(IPOM)等。 在其众多术式中,腹腔镜手术因网片能完整覆盖整个肌耻骨孔区域,且具有疼痛轻、恢复快、手术并发症少等优点,被欧洲疝外科学会推荐为成人腹股沟疝的标准术式[8]。而TEP相对于其它术式区别在于所有操作均在腹膜前间隙内进行,操作过程无需进入腹腔,从而避免了手术对腹腔内脏器的干扰,更符合生理学的特点[9]。但是,TEP也有劣势所在,其操作空间相对较小,对于病程较长及疝囊较大的斜疝患者,疝内容物反复坠出并摩擦可使疝囊壁与精索及周围组织紧密粘连,导致解剖层次不清而不易分离[10]。此时,若强行追求完整剥离疝囊则易导致输精管或精索血管损伤,甚至损伤危险三角的髂血管。因此,如何将膜解剖理论运用在斜疝疝囊的分离中成为我们研究的重点。
李建文教授认为,TEP的手术分离空间腹膜前间隙并不是我们以往理解的腹横筋膜(transversalis fascial,TF)浅深两层之间,而是在腹膜前筋膜(preperitoneal fascial,PPF)中,PPF与腹膜前脂肪一起构成了腹膜前间隙[11]。而腹横筋膜(transversalis fascial,TF)与PPF在不同的膜层,两者之间有“膜桥”结构存在,即为分离时出现的所谓“天使的发丝”[12]。在膜解剖的基础上,我们认为危险三角与内环口联合构成的区域是TEP术中重要的解剖部位,其解剖标志为内侧的输精管和外侧的精索血管,并与内侧的Retzius间隙和外侧的Brogros间隙相连。在此区域PPF分为浅层(内衬于腹壁和髂血管表面)和深层(包绕精索)[13]。斜疝疝囊的分离过程并不在两层PPF之间,而是腹膜(疝囊)与PPF深层之间的分离。由于斜疝疝囊的分离并不是沿着真正的腹膜前间隙进行,而需要分离疝囊与PPF深层之间致密的粘连,因此TEP术中斜疝疝囊的分离较直疝困难得多,尤其是一些病程较长、粘连严重的斜疝、巨大的阴囊疝及女性斜疝,分离中费时且极易导致疝囊破损。
理解了斜疝疝囊分离区域的膜解剖特点后,我们清楚地认识到分离斜疝疝囊时需要在壁平面与脏平面之间切换,极易导致腹膜破损。众所周知的是,TEP手术在基层推广中的难点就是操作空间不易建立,一旦早期出现腹膜破损,气腹中的CO2气流将通过破损处进入腹腔形成“活瓣”效应,同时CO2聚集导致腹腔压力的升高,腹膜上下浮动使腹膜外空间变得愈加狭小,并严重影响手术视野和操作,令手术医生懊恼甚至中转开放[14]。我们在开展TEP手术的早期,也常常会出现无意中损伤腹膜导致空间建立失败而操作极其困难的情况。仔细研究后我们发现,腹膜破损只是在手术的初期才会影响手术的进程。在大部分的手术空间分离完成后,腹膜前和腹腔压力达到平衡,腹膜破损不再具有“活瓣”效应,对操作空间没有大的影响,也不会干扰手术的进行。因此,在TEP术中我们也尝试主动切开疝囊,突破膜的限制,也无需在TEP狭小的空间内进行平面的转换,反而更有利于疝囊的分离[15]。
我们分析主动切开疝囊的心得体会如下:①疝囊主动切开技术适用于病程较长、疝囊较大的疝以及难复性疝,此类斜疝的疝囊常与精索致密粘连,界限不清,强行试图完整剥离或开窗横断易出现误损伤,延长手术时间,增加了手术难度;②疝囊切开需在Retzius间隙、Bogros间隙充分打开后方能进行,提前打开腹膜会形成“活瓣”效应,将严重影响手术视野,阻碍操作进行;③根据陈双教授将疝囊构建成三棱柱的理论,疝囊切开时左手持钳充分牵拉疝囊,使之尽量展开,初始切开部位应为AB面交界处的C面,避免盲目切开疝囊侧边或后方,避免损伤髂血管[16];④切开疝囊后务必缝合关闭腹膜,手术医生需具备熟练的腔镜下缝合技巧,否则切开腹膜反而会增加手术时间和创伤;⑤女性患者因子宫圆韧带与疝囊紧密附着并无间隙,在没有离断子宫圆韧带情况下追求在腹膜与子宫圆韧带之间层次的解剖不仅费时,也易导致腹膜破损,而疝囊主动切开可在不损伤子宫圆韧带的基础上充分游离疝囊,尤为适用。
我们研究发现,在熟练掌握膜解剖的理论、清晰地理解腹股沟区膜解剖的基础上,主动切开疝囊可缩短手术时间,减少对精索的损伤,并不增加手术并发症,是针对完整剥离或横断困难疝囊安全有效的处理手段。但是,疝囊主动切开技术也存在一定的缺点,有学者报道疝囊完全剥离还纳与横断疝囊相比,可明显减少术后血清肿及异物感的发生率,以及腹腔内脏器误损伤的可能,且缝合关闭腹膜缺损需具备熟练的腹腔镜下缝合技巧,对于初学者较困难且费时[17]。我们的研究认为,在切开疝囊时尽量紧贴内环口,减少疝囊残留可以避免上述并发症出现。目前对于TEP术中疝囊的处理尚无所谓的“金标准”,将膜解剖理论运用实践中有助于对手术解剖层次的认识,根据其理论选择最适合的疝囊分离方式,最终使患者获益。

