NKD1调控Wnt/β-catenin信号通路影响结直肠肿瘤细胞周期的机制研究
石 斌,王 嘉,马 荣,王 鹏,曹 佳
结直肠肿瘤(CRC)是常见的消化道恶性肿瘤之一,与肺癌、乳腺癌并列为目前世界上最常见的三大恶性肿瘤。近年来,由于人口老龄化加剧、遗传因素、生活习惯的改变,导致CRC发病率和死亡率逐年上升且呈现年轻化趋势[1]。手术治疗为主的综合治疗是目前结直肠肿瘤主要的治疗方案,虽然患者预后较以往有所改善,但整体生存率仍需要进一步提升。因此,寻找具有潜在价值的生物标志物和有效靶点已成为结直肠肿瘤治疗领域的研究重点,深入探究其发生发展的分子机制对其靶向治疗具有非常重要的指导作用。裸角质膜同源蛋白(NKD)最早被发现是一种比较保守的与早期发育相关的因子,脊椎动物基因组主要编码NKD1和NKD2两个分子。NKD1基因位于染色体16q12.1,编码470个氨基酸蛋白,其作为经典Wnt/β-catenin信号通路抑制剂,通过与β-catenin结合抑制其入核参与Wnt通路的负性调控[2]。研究表明,NKD1在胃癌[3]、肝癌[4]等恶性肿瘤中表达上调,但在结直肠肿瘤中的表达及生物学功能尚不清楚。本研究检测NKD1在人结直肠肿瘤临床样本中的表达差异,利用定量蛋白质组学结合生信分析筛选NKD1富集的生物学功能及信号通路,探究NKD1对结直肠肿瘤细胞增殖、细胞周期的影响,明确NKD1作为癌基因在结直肠肿瘤进展中的调控作用,为寻找结直肠肿瘤治疗靶点提供理论依据。
1 资料与方法
1.1 一般资料:SW620细胞和HT29细胞购自中科院上海细胞库;Leibovitz′s培养基和McCoy′s 5A培养基、青霉素-链霉素溶液、0.25%胰酶溶液、PBS缓冲液均购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;RNA裂解液Trizol试剂购自Invitrogen公司;曝光显影液购自Millipore公司;CCK-8增殖检测试剂盒、全蛋白提取试剂盒购自凯基生物;反转录试剂盒及RT-PCR试剂盒购自Takara公司;BCA蛋白定量检测试剂盒购自Thermo公司;免疫组化检测试剂盒购自中杉金桥公司;慢病毒载体、HitransG P感染增强液购自上海吉凯基因有限公司;引物由上海生工生物合成。
1.2 免疫组化方法检测NKD1在结直肠肿瘤组织中的表达:将结直肠癌组织和癌旁组织制备为石蜡标本,切成厚度为4 μm的切片,60 ℃烤箱烤片至少2 h。二甲苯溶液脱蜡后放入梯度酒精中各作用5 min,自来水清洗。利用柠檬酸钠抗原修复液对组织切片进行抗原修复,PBS冲洗切片后加入3%H2O2溶液室温孵育10 min,阻断内源性过氧化物酶活性。在切片上滴加山羊血清封闭液室温封闭1h,去除非特异性染色。根据组织大小滴加适量的NKD1一抗稀释液(Abcam,ab133650,兔单克隆抗体,1∶200),37 ℃湿盒温箱中孵育过夜。去除一抗稀释液,PBS缓冲液清洗后滴加100 μL反应增强液,室温孵育20 min。滴加100 μL增强酶标山羊抗兔IgG二抗聚合物溶液(中杉金桥,1∶200),室温孵育1 h,促使抗原抗体发生特异性结合。加入适量新鲜配制的DAB显色液,显微镜下观察染色强度及时间,自来水冲洗终止染色反应。滴加苏木素染色液孵育30 s,盐酸酒精分化数秒,自来水冲洗反蓝;梯度酒精脱水、二甲苯透明晾干,中性树胶封片。
1.3 RT-PCR方法检测NKD1在结直肠癌组织中的表达:与本院结直肠外科合作,收集15例新鲜配对的结直肠癌组织和癌旁组织标本,标本离体后迅速放置液氮罐中冷冻保存。取出组织放置1.5 mL EP管中,加入500 μL Trizol裂解液,利用高压消毒灭菌的剪刀将组织充分剪碎,补加500 μL Trizol试剂促使组织充分裂解。加入200 μL氯仿剧烈振荡,室温放置10 min,12 000 rpm离心20 min。抽取上清液至新的EP管中,加入等体积异丙醇,上下颠倒混匀,室温静置10 min,12 000 rpm离心15 min。去除上清保留沉淀,加入1 mL 75%酒精清洗沉淀,7 500 rpm离心5 min。去除酒精后放置通风橱内5 min,根据沉淀量加入去离心水20~60 μL,充分溶解后混匀测定RNA浓度及纯度。
1.4 RT-PCR方法检测NKD1慢病毒转染效果及细胞周期标志物表达:将HT29和SW620细胞分别铺至24孔板,细胞密度达到40%转染NKD1慢病毒空载体(NC)和干扰载体(siNKD1),48h加入嘌呤霉素去除未转染成功的细胞。72h换液后荧光显微镜观察荧光强度达到60%收集细胞。分为Control组、NC组、siNKD1组,各组分别加入RNA裂解液Trizol试剂提取各组细胞总RNA。按照逆转录试剂盒说明书冰上操作将RNA逆转录为cDNA,反应条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃。RT-PCR实验按照以下比例加入96孔板中,SYBR-Green 10 μL、上游引物0.8 μL、下游引物0.8 μL、ddH2O 6.4 μL、cDNA 2 μL,扩增条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。扩增结束后通过查看溶解曲线和扩增曲线确定结果的准确性和可靠性。分析结果以GAPDH作为内参,利用2-△△Ct方法计算基因相对表达量。相关的引物序列见表1。
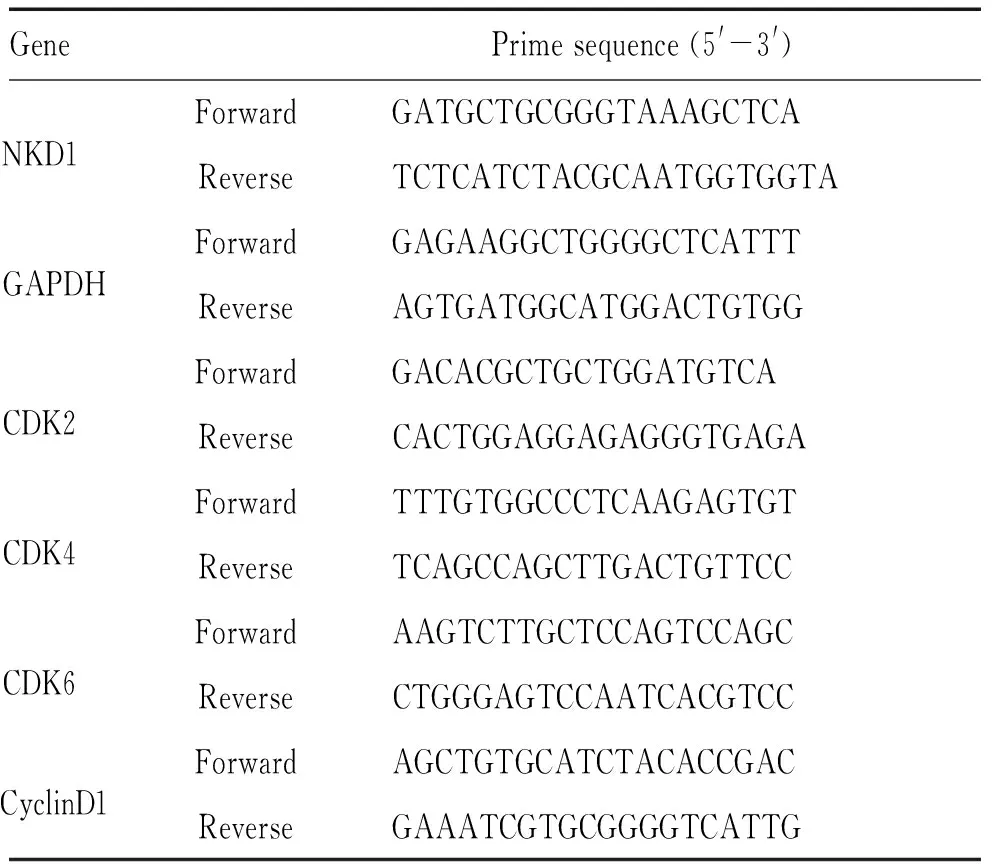
表1 基因引物序列
1.5 CCK8方法检测细胞增殖能力:将转染NKD1干扰载体的SW620和HT29细胞以相同的细胞密度(1 000个/孔)接种于96孔板中(每组设置5个复孔作为生物学重复),每孔加入100 μL培养基重悬细胞,将其放置37 ℃ 5% CO2培养箱中培养24 h。待细胞完全贴壁后镜下观察细胞的生长情况,分别于培养24 h、48 h、72 h时收集细胞。用完全培养基稀释CCK8溶液,按照1∶10的比例避光配置CCK8工作液,弃去96孔板中原有培养基,加入100 μL/每孔CCK8工作液,37 ℃培养箱中孵育2h。取出96孔板,观察颜色变化(颜色与吸光度值呈正比)。打开酶标仪,设置检测波长为490 nm测定各孔的吸光度值。绘制细胞生长曲线,检测实验组与对照组相比细胞增殖能力是否存在差异。
1.6 平板克隆方法检测细胞增殖能力:分别收集3组(Control组、NC组、siNKD1组)生长状态良好的SW620和HT29细胞,其中SW620细胞以3 000个/孔、HT29细胞以1 000个/孔接种于6孔板中,每孔加入3mL培养基重悬细胞,将其放置37 ℃ 5% CO2培养箱中培养3 d。镜下观察细胞贴壁及生长状况,每隔2 d换液,培养至10~15 d时收集细胞。弃去培养基,PBS缓冲液冲洗后加入4%多聚甲醛溶液固定细胞20 min,去除固定液加入0.3%结晶紫溶液染色细胞10 min。流水缓慢冲洗细胞至板底透亮,观察拍照并计数细胞克隆数,比较各组之间细胞增殖能力是否存在差异。
1.7 Western blot方法检测细胞周期标志物蛋白表达:将Control组、NC组、siNKD1组细胞接种至培养瓶中,待细胞密度达到80%后分别加入胰酶溶液消化细胞收集细胞沉淀。根据全蛋白提取试剂盒按比例加入蛋白裂解液Lysis buffer、蛋白酶抑制剂、PMSF混合液冰上裂解细胞45 min,12 000 rpm离心20 min,吸取上清至新EP管。根据BCA蛋白定量检测试剂盒测定蛋白浓度,并加入5×loading buffer蛋白上样缓冲液,100 ℃煮沸10 min促使蛋白变性。经10%PAGE凝胶电泳,湿转将蛋白转移至PVDF膜。5%脱脂奶粉室温封闭1 h,孵育一抗4 ℃过夜。1×TBST溶液清洗后孵育二抗(1∶5 000)室温1 h。洗膜后利用化学发光成像仪曝光显影。相关抗体信息见表2。

表2 Western blot货号抗体信息
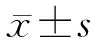
2 结果
2.1 NKD1在人结直肠癌组织中高表达:RT-PCR结果显示,NKD1基因在癌组织中表达明显高于癌旁组织(P<0.01),见图1A(封三)。免疫组化结果显示NKD1主要定位表达于胞质中,癌组织中细胞浆或细胞膜有棕黄色颗粒沉着为阳性,癌旁组织无棕黄色颗粒沉着为阴性,见图1B(封三)。NKD1阳性表达统计结果见图1C(封三)。
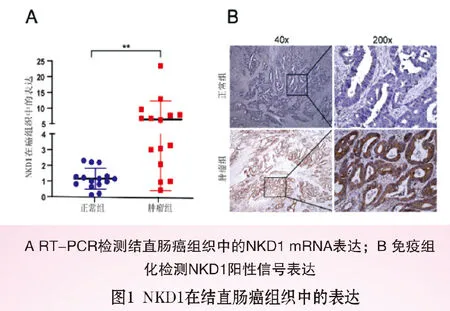
2.2 NKD1干扰慢病毒载体构建及转染效率验证:将NKD1慢病毒空载体(NC)和干扰载体(siNKD1)转染至HT29和SW620细胞中,荧光显微镜观察两种细胞的荧光转染效率分别为90%和60%,见图2A(封三)。RT-PCR(图2B)和Western blot,见图2C,2D(封三)结果显示,siNKD1组NKD1 mRNA和蛋白表达明显低于NC组和Control组(P<0.05)。上述结果表明NKD1干扰慢病毒载体转染成功。
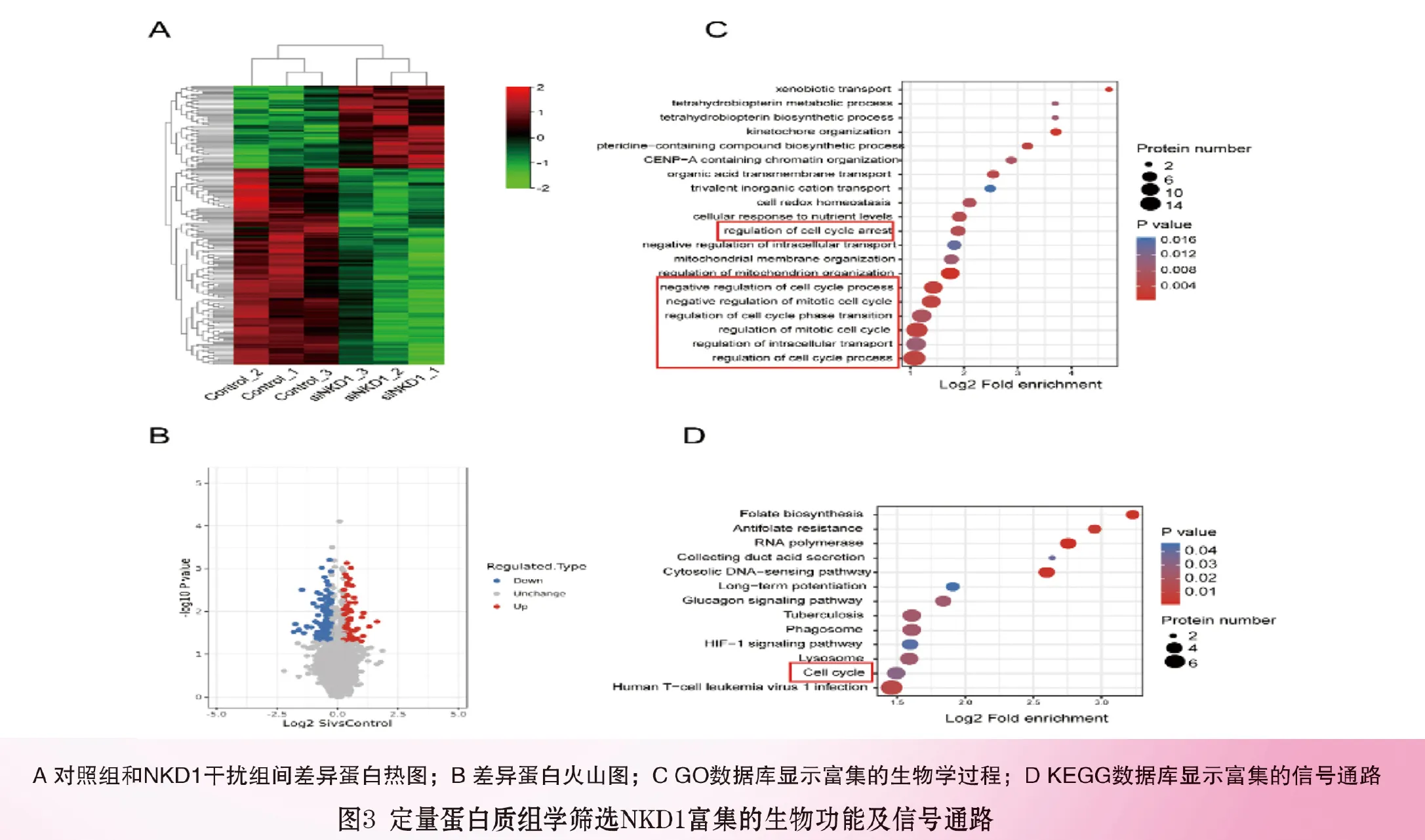
2.3 定量蛋白质组学筛选NKD1富集的生物功能及信号通路:聚类热图和火山图显示干扰NKD1差异表达蛋白,其中上调蛋白75个,下调蛋白169个,见图3A,3B(封三)。将差异蛋白进行GO富集分析,显示差异蛋白生物过程主要与细胞增殖、细胞周期调控密切相关 ,见图3C(封三),且KEGG分析能够显示富集细胞周期信号通路,见图3D(封三)。上述蛋白组学结果提示NKD1可能参与调控细胞增殖和细胞周期生物学过程。
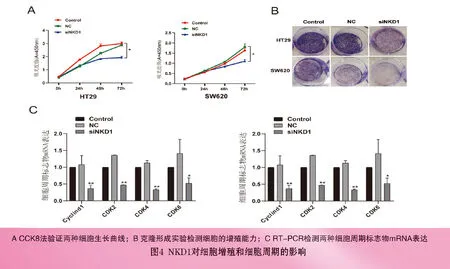
2.4 下调NKD1抑制细胞增殖和细胞周期:CCK8结果显示,与Control组和NC组相比,siNKD1组随着作用时间延长两种细胞生长曲线减缓,72h更为显著(P<0.05),见图4A(封三)。平板克隆实验结果显示,siNKD1组细胞克隆集落数较Control组和NC组明显减少,见图4B(封三);RT-PCR和Western blot结果显示,siNKD1组HT29和SW620细胞周期标志物CyclinD1、CDK2、CDK4、CDK6 mRNA和蛋白表达均降低(P<0.05),见图4C,4D(封三)。上述结果表明抑制NKD1能够显著抑制结直肠肿瘤细胞增殖和细胞周期。
2.5 抑制NKD1激活Wnt/β-catenin信号通路:Western blot检测Wnt/β-catenin信号通路核心分子表达,结果显示与Control组和NC组相比,siNKD1组β-catenin、GSK3β、Axin2、c-Jun蛋白表达升高(P<0.05)。表明抑制NKD1能激活Wnt/β-catenin信号通路参与抑制细胞增殖和细胞周期生物学过程。
3 讨论
结直肠肿瘤是常见的胃肠道肿瘤,也是目前全球排名第三的恶性肿瘤。尽管优化治疗方案和干预措施改善了结直肠癌患者的预后,但总体生存效果并不理想[5]。因此寻找简单高效的预测结直肠癌患者诊断预后的生物标志物至关重要。NKD1蛋白主要分布于细胞质和细胞膜,在肺脏、心脏、肝脏、肾脏、结肠等重要组织器官中广泛表达。同时,多项研究结果表明NKD1在多种恶性肿瘤中异常表达,与人体肿瘤的发生发展密切相关。研究发现NKD1蛋白表达缺失显著增加非小细胞肺癌的浸润能力,与患者临床病理分型和不良预后密切相关[6]。NKD1蛋白在肝癌组织中表达下调,与肝癌患者肿瘤大小、肝内外转移、组织学分化等一系列临床病理参数之间存在相关性[7]。Wang等[8]利用数据库生信分析结合基础实验证实NKD1促进结直肠肿瘤细胞增殖,可作为结直肠肿瘤生物标志物。以上研究提示NKD1在多种肿瘤的发生发展过程中扮演着重要角色,可能是癌症诊断和治疗的潜在靶点。本研究中,我们发现NKD1在结直肠癌中显著高表达,研究结果与之前的研究结果相一致。为了进一步探究NKD1与结直肠肿瘤发生发展之间的调控关系及分子机制,我们进行了功能缺失型研究。在高表达NKD1的结直肠肿瘤细胞SW620和HT29中稳定转染NKD1干扰慢病毒载体,通过定量蛋白质组学结合生信分析,发现NKD1缺失主要与细胞运动、细胞增殖、细胞周期等生物学功能密切相关,且显著富集细胞周期信号通路。因此,我们推测NKD1可能通过介导细胞增殖和细胞周期生物学功能参与结直肠肿瘤的发生发展。
细胞周期是指以有丝分裂方式增殖的细胞从一次分裂结束到下一次分裂结束所经历的过程,周期蛋白(Cyclins)和周期蛋白依赖性激酶(CDKs)在细胞周期发展过程中起着重要作用,CyclinD1、CDK4、CDK6参与介导G0/G1期、CDK2参与介导S期,其异常表达是癌症进展的重要事件之一[9-10]。本研究证实NKD1缺失抑制结直肠肿瘤细胞增殖,同时显著抑制细胞周期标志物CyclinD1、CDK2、CDK4、CDK6的相对表达与定量蛋白质组学分析结果一致。表明NKD1通过调控细胞增殖和细胞周期参与结直肠肿瘤恶性发展,可能作为结直肠肿瘤干预和治疗的潜在靶点。
为了进一步探究NKD1参与结直肠肿瘤调控的分子机制,我们研究了NKD1表达对Wnt/β-catenin信号通路的影响。研究表明Wnt/β-catenin信号通路在肿瘤发病进展及恶性转化过程中发挥了重要作用[11-12]。NKD1作为经典Wnt/β-catenin信号转导抑制剂负向调控Wnt信号通路[13]。本研究发现抑制NKD1可以促进β-catenin、GSK3β、Axin2、c-Jun等Wnt通路核心蛋白表达,表明抑制NKD1通过激活Wnt/β-catenin信号通路调控结直肠肿瘤细胞增殖和细胞周期进程。
综上所述,本研究以结直肠肿瘤组织标本、肿瘤细胞系为主要研究对象,基于定量蛋白组学及分子生物学实验,证实NKD1通过负向调控Wnt/β-catenin信号通路促进肿瘤细胞增殖及细胞周期,介导结直肠肿瘤进展的生物学作用。NKD1作为结直肠肿瘤进展的重要调节基因,可能成为防治结直肠肿瘤治疗的有效分子靶点。

