运动促进骨骼肌健康的新视角:基于Rac1/PAK1/p38 MAPK 信号通路改善肌生成和糖代谢的研究进展与展望
任翔宇 ,沈 飞 , ,金 玲 ,卢 健 ,陈彩珍 *
骨骼肌约占人体体质量的40%,在维持运动能力、平衡机体代谢稳态等方面起着重要作用。不良的生活方式和习惯,如久坐不动、不当饮食使得与衰老伴随的各类慢性病发病率日益激增。运动作为一项重要干预手段,被体育科学、生物医学等领域广泛研究。骨骼肌作为运动的载体,其功能的改善通过运动能力提高、代谢功能优化、内分泌增强等方面来实现(Zhao et al.,2020)。骨骼肌重塑能力下降、质量降低会影响人体的运动机能,增加跌倒损伤的风险。同时,衰老和肥胖使机体易出现代谢功能异常,肌肉中的蛋白质被分解,使运动能力受限,进一步加剧骨骼肌萎缩,形成恶性循环(Zhang et al.,2020)。而规律性地进行身体活动能增强运动表现,促使骨骼肌蛋白合成增加、抑制骨骼肌蛋白降解(邱守涛 等,2014),改善线粒体功能,继而促进机体代谢平衡(Shen et al.,2021)。因此,探索运动改善骨骼肌功能的效果和潜在机制具有广泛的理论和现实意义。研究表明,Rac1/PAK1/p38MAPK 信号通路与细胞骨架运动、凋亡、代谢等多种细胞功能密切相关,在调节肌生成中起着核心作用(Rader et al.,2020)。同时,运动引起的应激反应和肌肉重塑水平的协调也提示该通路可作为运动防治肌肉衰减的靶点。目前,鲜见关于运动能否以及如何调节Rac1/PAK1/p38 MAPK 信号通路、影响细胞生物进程的报道。本研究梳理了Rac1/PAK1/p38 MAPK 信号通路促进肌生成和改善糖代谢的作用机制,总结了运动影响该通路的研究进展,分析了运动通过该通路促进骨骼肌健康的理论可能。
1 Rac1/PAK1/p38 MAPK信号通路组成及调节
Ras 相关C3 肉毒毒素亚基(Ras-related C3 botulinum toxin substrate,Rac)基因被Didsbury 等(1989)发现,后续研究发现其亚型Rac1 通过调节内皮细胞迁移、粘附、侵袭和增殖,在血管生成中发挥核心作用(Tan et al.,2008)。Rac1 被广泛用于微丝网络的组织、细胞间接触和肿瘤恶性转化等研究,因而抑制Rac1 激活已成为癌症的治疗靶点(Bid et al.,2013)。除激活细胞内信号级联反应外,细胞外基质成分通过激活Rac1 整合蛋白来活化胞内信号以响应外界刺激,进而激活p21 激活激酶1(p21-activated kinases 1,PAK1),后者充当分子开关,将细胞外的信号跨膜转导至胞内,并控制p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)及其下游的信号转导通路的活性(Shin et al.,2013),因而在调节细胞运动,促进细胞更新、组织生长、局部营养改善等方面,该通路的适度激活是必要的。
1.1 Rac1/PAK1/p38 MAPK信号通路中的核心分子
Rac1、PAK1 和p38 MAPK 是构成Rac1/PAK1/p38 MAPK信号通路的核心分子(图1)。Rac1 广泛分布于机体的各种组织,尤其在骨骼肌和心肌中表达丰富(Meriane et al.,2000)。Rac1 生物学功能的发挥依赖于与二磷酸鸟苷(guanosine diphosphate,GDP)结合的非活性形式和与三磷酸鸟苷(guanosine triphosphate,GTP)结合的活性形式之间的循环,即Rac1-GTP 参与下游信号分子PAK1 的激活(朱包良等,2020)。PAK1 在N 端包含1 个GTPase 结合域、1 个自抑制域和1 个C 末端激酶域,因其特殊的结构和多样的家族伴侣,其活性可被microRNA(miRNA)及一些非编码RNA 直接或间接介导(Xu et al.,2020),PAK1 磷酸化和乙酰化也是活化的途径之一。PAK1 不仅在细胞骨架动力学中发挥作用,还可以调节细胞存活、有丝分裂等各种细胞活动(May et al.,2014)。p38 MAPK 家族通常被机械张力、促炎细胞因子、紫外线辐射和氧化应激等刺激激活,在基因表达、细胞活动和应激适应等方面起着重要作用,参与骨骼肌运动性适应的细胞调控过程(何丹 等,2014)。
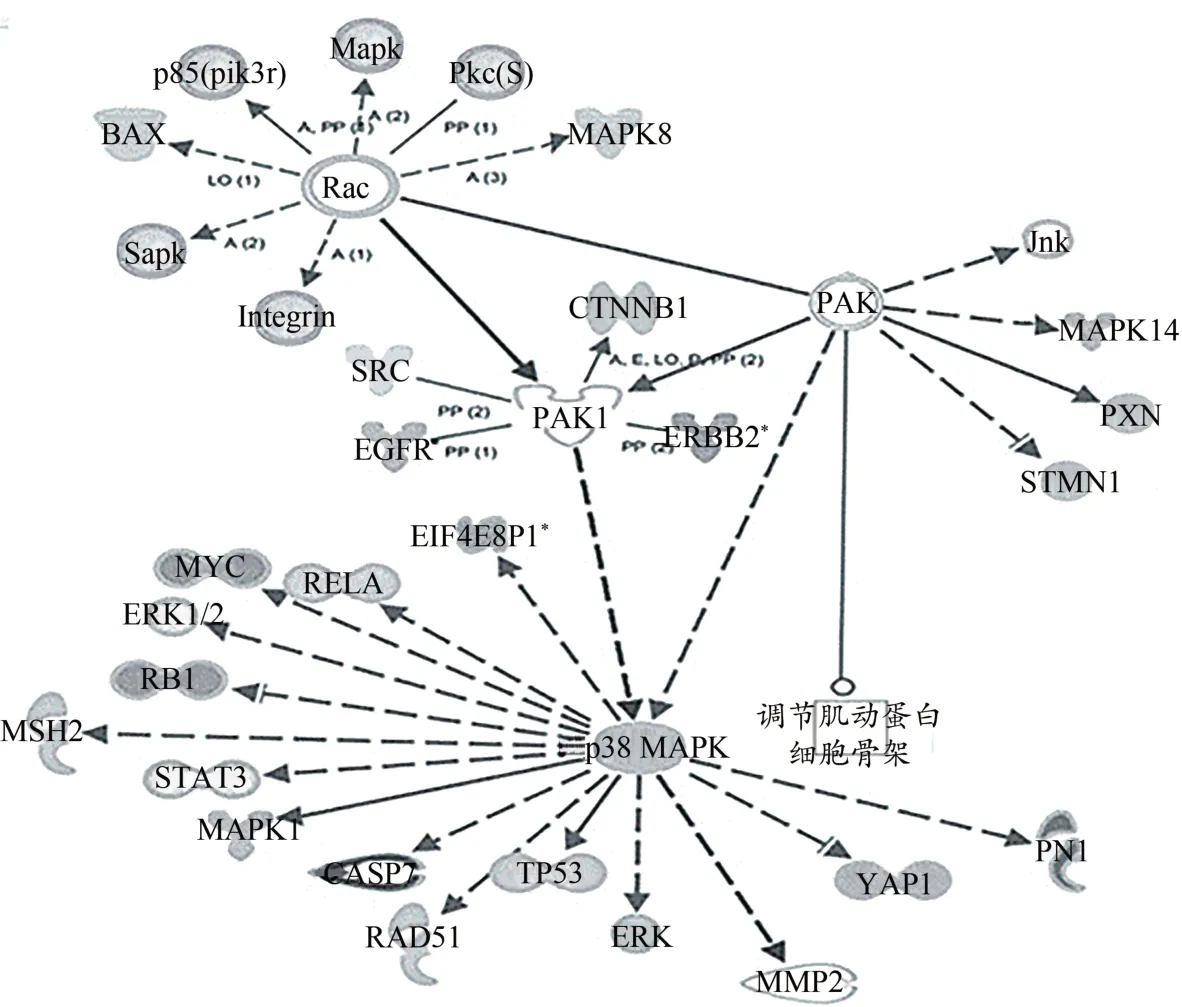
图1 Rac1、PAK1、p38 MAPK之间的关系及作用靶点(Gonzalez-Villasana et al.,2015)Figure 1.Relationship and Target of Rac1,PAK1,and p38 MAPK(Gonzalez-Villasana et al.,2015)
1.2 Rac1、PAK1及p38 MAPK的联系与调节
Rac1 在磷酸化后影响肌动蛋白细胞骨架和细胞黏附,控制成肌细胞的融合过程,从而影响细胞的形态(Hodge et al.,2016)。活化的Rac1 可通过PAK1 间接激活LIM 激酶1(LIM kinase 1,LIMK1),调控肌动蛋白素向肌动蛋白骨架传递信号,这实现了Rac1/细胞分裂周期蛋白42(cell division cycle 42,Cdc42)信号转导与肌动蛋白细胞骨架动力学耦合,从而调控肌动蛋白的动态平衡。Rac1可磷酸化PAK1,参与PAK1 活性的调节(Deguchi et al.,2010),而Rac1 和Cdc42 蛋白的相互作用也可间接激活PAK1,从而参与p38 MAPK 的活化、卫星细胞的激活以及肌管形成(Cerquone Perpetuini et al.,2018)。三者在Rac1/PAK1/p38 MAPK 信号通路中作用的发挥也涉及其他多个分子,可独立作用于相同或不同的蛋白,因此具有同时治疗一种或多种疾病的潜力(Olson et al.,2018)。
2 Rac1/PAK1/p38 MAPK信号通路对骨骼肌健康的作用
骨骼肌是调节糖脂代谢平衡的重要器官,肌肉过度流失是癌症、器官衰竭、感染等多种疾病的预后不良指标(Sartori et al.,2021)。Rac1/PAK1/p38 MAPK 信号通路对机体内环境稳态和健康至关重要,其适度激活还可连结mTOR 信号通路并作为调节肌肉质量的重要途径,促进骨骼肌再生、调控糖原存储和葡萄糖转运,从而促进骨骼肌健康(Liu et al.,2020)。
2.1 Rac1/PAK1/p38 MAPK信号通路与肌生成
2.1.1 促进成肌细胞融合
骨骼肌的生长发育涉及到多个环节,包括肌肉干细胞的增殖、迁移、分化,单核成肌细胞增殖、分化、相互融合并形成多核肌管(金晶 等,2019)。多核肌管的形成是成肌过程的关键步骤,需要在胚胎发育以及肌肉再生和修复过程中进行非常精确的时空调节。钙粘着蛋白(cadherin)对Rac1、PAK1 和p38 MAPK 的激活是肌管形成时所必需的(Joseph et al.,2017),其依赖性粘附可以通过Rho 型鸟嘌呤核苷酸交换因子(Rho guanine nucleotide-exchange factor,Rho-GEF)Trio 参与成肌细胞的识别,诱导局部细胞内信号传导(Kruse et al.,2019),在融合成肌细胞的接触部位募集肌动蛋白和黏着斑蛋白(Lehka et al.,2020)。活化的Rac1、PAK1、p38 MAPK 均能够上调肌细胞生成素(myogenin,MyoG)基因的表达,调节肌动蛋白在肌肉细胞的重组,调控成肌分化的早期阶段(Meriane et al.,2000)。p38 MAPK 一旦被激活,就会诱导处在G1期的成肌细胞退出细胞周期(庄秋宇 等,2013),磷酸化肌细胞增强因子2(myocyte enhancer factor 2,MEF2)家族中MEF2A、MEF2C 和MEF2D 以及生肌决定因子(myogenic determination gene,MyoD),并提高其转录活性(Parker et al.,2017)。在骨骼肌再生的早期阶段,p38 MAPK 促进分化,而后期阶段其活性必须被抑制,以使分化的细胞伸长、极化、集聚和融合(Segalés et al.,2016),且在恶病质机体内,p38 MAPK 是刺激蛋白降解和促进肌萎缩的关键因素,此时氧化应激诱导p38 MAPK 激活泛素-蛋白酶体和自噬-溶酶体促进肌肉流失(McClung et al.,2010)。
研究表明,转染了Rac1 基因显性负性突变体的细胞中有95%以上的细胞无法表达MyoG、肌钙蛋白T和肌球蛋白重链(myosin heavy chain,MHC)(Vasyutina et al.,2009)。恶病质小鼠萎缩的胫骨前肌内PAK1 表达下调,加入PAKs抑制剂后,p38 MAPK 的磷酸化水平降低,MyoG 延迟表达且含量降低,卫星细胞的终末分化过程中细胞周期退出延迟,骨骼肌受损程度加重(Cerquone Perpetuini et al.,2018)。在小鼠C2C12 成肌细胞萎缩模型中,PAK1 的过表达可引起MyoG 显著增多,发挥抗萎缩作用。同样,当胫骨前肌失神经支配后,PAK1 表达量显著增加,其Ser158 位点磷酸化,促进转录辅助抑制因子C-末端结合蛋白1 从MyoG 基因启动子区上移开,MyoG 基因表达被激活,若此时沉默PAK1,则MyoG 的mRNA 水平被显著抑制(Thomas et al.,2015)。此外,用p38 MAPK 激活剂处理骨骼肌可以重新激活衰老的卫星细胞,这为人工干预衰老骨骼肌提供了可能(Tomida et al.,2020)。因此,Rac1/PAK1/p38 MAPK 信号通路可上调MyoD 和MyoG 的表达水平,促进骨骼肌的损伤修复。
2.1.2 调节肌纤维形态
Rac1/PAK1/p38 MAPK 信号通路直接参与肌纤维形态的维持。例如,在Rac1 基因条件突变小鼠早期胚胎(E11.5或E12.5)中,Rac1 基因的缺失几乎不会影响肌群的大小。但在E14.5 和E18.5 时,骨骼肌逐渐萎缩,观察到的肌纤维短而细,且杂乱无章,成肌细胞融合指数和肌核数量降低(Vasyutina et al.,2009)。研究显示,骨骼肌PAK1 和PAK2基因双敲除(double knockout,dKO)小鼠成肌细胞分化延迟,肌群的质量均明显低于对照组,且年龄越大,骨骼肌萎缩程度越重(Brennan et al.,2021)。dKO 小鼠骨骼肌内呈现出严重拉长的巨型圆锥形线粒体,多数线粒体长度跨越了整个相邻的肌小节。10 月龄时,dKO 小鼠骨骼肌出现纤维化和变性迹象,而后肢比前肢受到的影响更大(Joseph et al.,2019)。然而,单独敲除PAK1 或PAK2 基因对骨骼肌发育和再生没有明显影响,因此PAKs 在成肌细胞分化的过程中起限速作用,而不是决定作用。用p38 MAPK 抑制剂处理肌源性细胞群后,成肌细胞无法融合成肌管,骨骼肌发育受阻(Tomida et al.,2020)。
2.2 Rac1/PAK1/p38 MAPK信号通路调节糖代谢
2.2.1 参与胰岛素分泌及运输
Rac1/PAK1/p38 MAPK 信号通路是维持代谢稳态的重要调节途径,也是代谢调节的核心途径之一。骨骼肌在全身的相对质量较大,氧化能力和储存糖原的能力较强,在胰岛素介导的葡萄糖清除中占比较大。当血糖水平急剧上升时,胰岛素刺激骨骼肌葡萄糖摄取、氧化和肝糖原合成。生理条件下,葡萄糖会促进胰岛β 细胞内Rac1 的激活,这是由T 淋巴瘤侵袭转移诱导因子1(T lymphoma invasion and metastasis inducing factor 1,Tiam1)和/或癌蛋白Vav2 介导的(Kowluru,2017)。Rac1 通过与其下游效应物胰岛素受体酪氨酸激酶底物p53 结合,继而与Wiskott-Aldrich 综合征蛋白和WASP 家族维脯氨酸同源蛋白(WASP-WAVE)结合后释放WAVE,激活肌动蛋白相关蛋白2/3(actin-related proteins 2/3,Arp2/3),促进膜上F-肌动蛋白的形成。PAK1 通过磷酸化Arp2/3 调节亚基p41ARC使肌动蛋白重塑,参与胰岛素的运输。
在Rac1 缺失的胰腺β 细胞中,即使在高糖刺激下,胰岛素分泌依旧减少(Kalwat et al.,2013)。在急性(体内输注脂质)和慢性(高脂饮食诱导的肥胖症和2 型糖尿病)胰岛素抵抗状态下,Rac1 和PAK1 的活化受损(Sylow et al.,2013),因此骨骼肌对葡萄糖的吸收既需要保持Rac1/PAK1/p38 MAPK 信号通路的完整性,又需要胰岛素的作用。在2 型糖尿病小鼠和人体的胰腺β 细胞内,Tiam1 和/或Vav2 介导了Rac1 的过度持续激活,使得胰岛内吞噬细胞NADPH 氧化酶(NAPDH oxidase,NOX)被活化,产生过多的活性氧(reactive oxygen species,ROS),最终导致过度氧化应激、线粒体损伤和细胞凋亡等现象(Kowluru,2017),此时,抑制Rac1 激活可保护β 细胞免受糖脂毒性和细胞因子的有害影响(Syed et al.,2011)。
2.2.2 促进GLUT4转位
葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)转位是骨骼肌在运动和胰岛素刺激下进行葡萄糖摄取的基础。研究表明,在胰岛素刺激下,Rac1/PAK1/p38 MAPK和PI3K/Akt/AS160 信号通路通过平行的信号传导机制介导GLUT4 转位及葡萄糖摄取(Sylow et al.,2013),且Rac1诱导GLUT4的易位时需要Akt的激活(Møller et al.,2019)。Rac1 在肌肉的特异性缺失会加剧高脂饮食诱导的胰岛素抵抗(Raun et al.,2018),在缺乏Rac1 的脂肪细胞中,胰岛素刺激的GLUT4 转运被完全抑制(Takenaka et al.,2020)。
PAK1 是维持胰岛素敏感性的主要调节剂,通过2 种机制诱导骨骼肌中胰岛素信号的传导:1)在胰岛素刺激下,PAK1 增加了皮层肌动蛋白(cortactin,CTTN)对N-WASP 的亲和力,L6成肌细胞中N-WASP-p41ARC复合物增多,因而促进骨骼肌吸收葡萄糖(Tunduguru et al.,2017)。2)PAK1磷酸化LIMK 的Thr508 位点,导致肌动蛋白解聚因子丝切蛋白(cofilin)家族活性降低,使得F-肌动蛋白的解聚减少,GLUT4 介导的葡萄糖转运增强(Mierke et al.,2020)。PAK1 表达水平的降低可能是糖尿病前期易感性的潜在危险因素。研究表明,缺失PAK1 基因的骨骼肌内cofilin磷酸化被抑制,且表现出全身葡萄糖耐受不良、稳态失衡等症状(Wang et al.,2011)。与此结论相反的研究认为,电刺激该类小鼠趾长伸肌时,葡萄糖的转运不受影响(Møller et al.,2020)。当单独敲除PAK2 基因或同时敲除PAK1、PAK2 基因时,刺激骨骼肌收缩后葡萄糖的转运部分减少,因此运动后,葡萄糖的转运在一定程度上依赖PAK2,而不依赖PAK1(图2)。
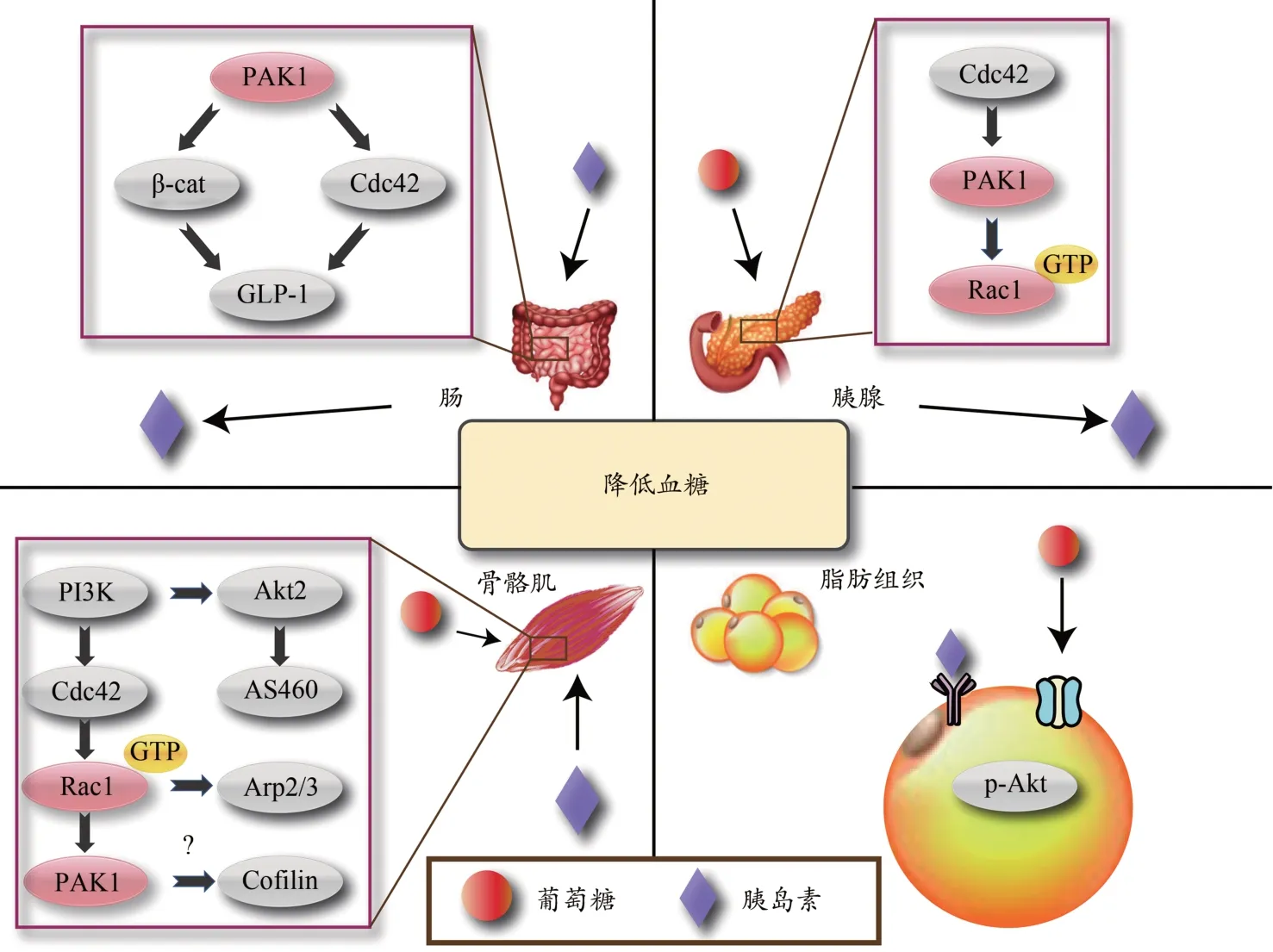
图2 Rac1和PAK1在糖稳态中的作用(Chiang et al.,2014; Møller et al.,2019)Figure 2.Roles of RAC1 and PAK1 in Glucose Homeostasis(Chiang et al.,2014; Møller et al.,2019)
Rac1/PAK1/p38 MAPK 信号通路的短暂激活可提高GLUT4 表达水平、增加PGC-1α 活性、增强线粒体的生物发生和氧化代谢来促进机体对葡萄糖的吸收,从而预防肥胖和胰岛素抵抗。用p38 MAPK 抑制剂处理健康L6 肌管细胞后,在胰岛素刺激下,其葡萄糖摄取量减少,但GLUT4转位未受影响(Niu et al.,2003)。而过度活化的p38 MAPK可抑制胰岛素激活胰岛素受体底物1(insulin receptor substrate-1,IRS-1),破坏胰岛素信号通路,同时抑制GLUT4和PGC-1α 基因的转录,促进葡萄糖转运蛋白1(glucose transporter type 1,GLUT1)基因的转录(Bengal et al.,2020)。此时对p38 MAPK 的抑制可确保胰岛素信号的恢复、降低细胞炎症因子的表达,并阻止肝脏糖异生而减少肝脏葡萄糖释放,降低血糖水平(Cao et al.,2005)。
3 不同运动方式对Rac1/PAK1/p38 MAPK信号通路的影响
Rac1/PAK1/p38 MAPK 信号通路被激活后,影响mTOR、Wnt/β-catenin 等信号通路,从而改善细胞结构及功能,参与抗氧化和炎症反应,这些过程与运动时引起的能量状态改变有关。作为应激刺激因素,一次极量运动即可引起机体发生一系列的生理应答反应,长期运动则可诱导机体产生骨骼肌结构重塑和血糖控制等适应性变化(金晶 等,2017)。尽管该通路在细胞活动、肌生成和糖代谢中发挥重要作用,但是运动对此通路的调控仍有待梳理(表1)。
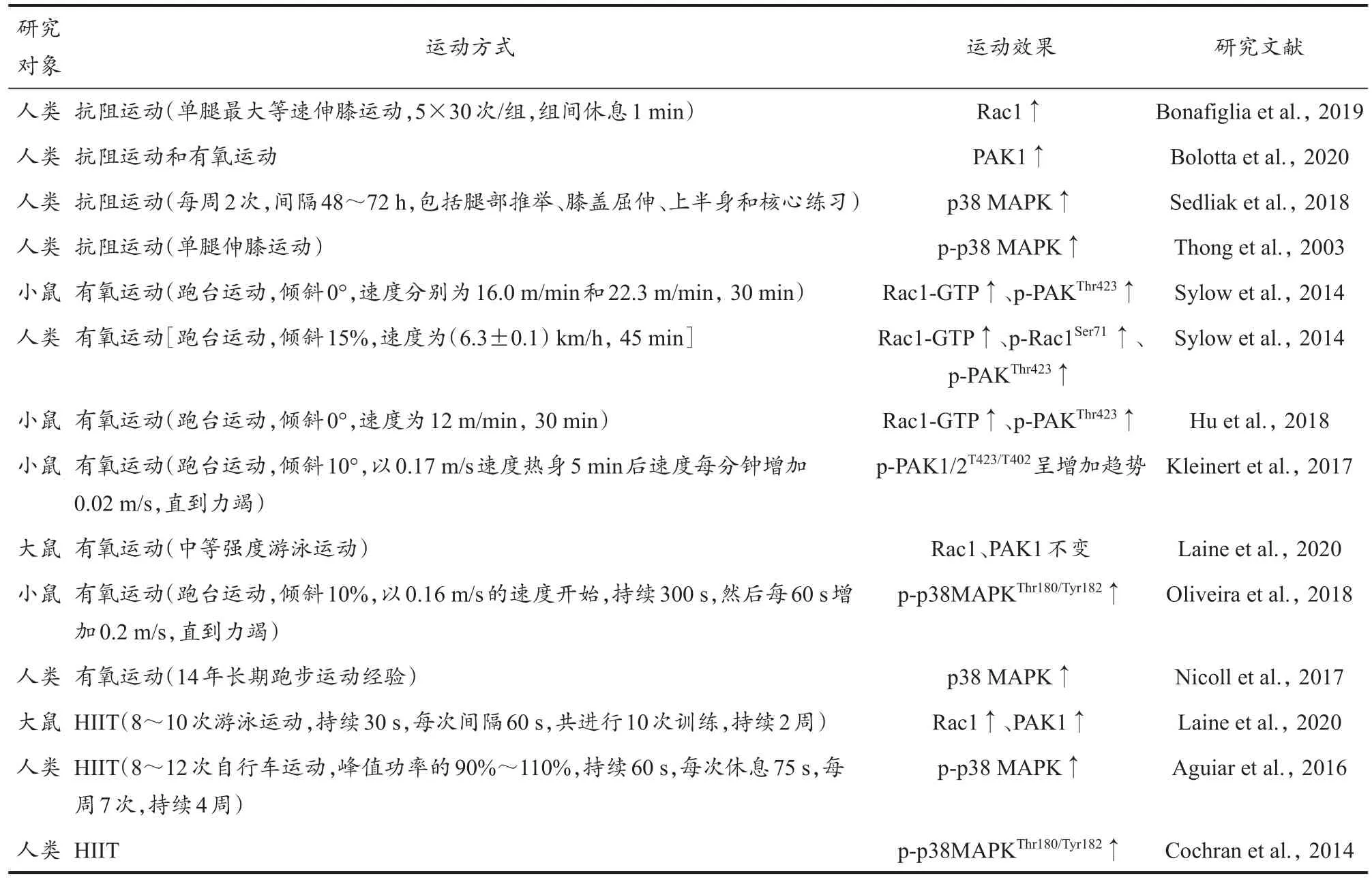
表1 运动对Rac1/PAK1/p38 MAPK信号通路的影响Table 1 Effects of Exercise on Rac1/PAK1/p38 MAPK Signaling Pathway
3.1 抗阻运动
抗阻运动可促进肌肉肥大,增强蛋白合成能力,增加肌肉力量,抑制蛋白质降解通路,同时提高机体内胰岛素的敏感性,起到促进糖代谢的作用(王平 等,2011)。Bonafiglia 等(2019)对人体单次急性抗阻运动24 h 后的骨骼肌转录组分析发现,该运动能引起Rac1 基因产生较大的表达变异性,并且Rac1 基因参与了调节慢性抗阻运动适应的信号传导功能途径,促进卫星细胞介导的肌发生通路激活。Bolotta 等(2020)对年长的业余运动员、有终身抗阻运动和有氧运动习惯的受试者与非运动者的股外侧肌活检标本转录组比较发现,PAK1 水平上调了1 倍以上。Sedliak 等(2018)研究发现,未受过训练的男性进行11 周抗阻运动后,p38 MAPK 的磷酸化水平显著提高。以上研究表明,抗阻运动可有效激活Rac1/PAK1/p38 MAPK信号通路。
3.2 有氧运动
有氧运动能够增加骨骼肌内线粒体体积和毛细血管密度,增强线粒体的生物发生和蛋白合成,提高抗乳酸能力和抗氧化能力(Qaisar et al.,2016)。有研究表明,有氧运动使Rac1-GTP 和PAK1 的磷酸化程度增强。Hu 等(2018)的研究显示,小鼠在以最大跑步能力的65%持续进行20 min 的有氧运动后,比目鱼肌Rac1-GTP 增加了(3.08±0.42)倍。Sylow 等(2013)认为,进行有氧运动时,Rac1 与GTP 的结合能力取决于运动负荷:小鼠以其最大跑步速度的50%或70%进行运动后,Rac1-GTP 分别增加了50%和100%,p-PAKThr423分别增加了60%和100%。而在相对低速(最大速度的40%)的情况下,30 min 后Rac1-GTP 增加了44%。一次长时间有氧力竭运动使小鼠腓肠肌中的p-PAK1 呈增加趋势(Kleinert et al.,2017)。不同强度或持续时间的运动训练会导致运动后p38 MAPK 的选择性激活。Lee 等(2002)对大鼠进行8 周低强度和中高强度有氧运动训练,再进行1 次急性运动测试后发现,腓肠肌内p38 MAPK 的总表达量分别升高(1.36±0.27)倍和(1.44±0.07)倍。Nicoll 等(2017)研究发现,5 名有14 年运动训练经验的跑者和5 名没有运动习惯的2 组受试者股四头肌总MAPK 表达差异很小,而进行长期耐力运动的个体中p-p38 MAPK 水平趋于增加,且p-p38 MAPK 与总MAPK 含量的比值与I 型纤维的数量呈正相关,与IIA 型纤维的数量呈负相关。
3.3 高强度间歇运动
高强度间歇运动(high-intensity interval training,HIIT)可以在短时间内募集更多肌纤维的同时耗尽其糖原储存量,起到改善机体代谢的作用。Laine 等(2020)研究认为,HIIT 与中等强度有氧运动效果相似或更好,大鼠进行2 周HIIT 后,腓肠肌Rac1 蛋白水平显著升高,PAK1 的表达被显著激活,且HIIT 和中等强度有氧运动对比目鱼肌中Rac1、PAK1 的mRNA 及蛋白表达水平没有显著影响,这可能与骨骼肌的快肌、慢肌纤维的构成有关。健康男性进行4 周HIIT 后,股外侧肌p-p38 MAPK 肌肉含量增加(Aguiar et al.,2016)。HIIT 效果在很大程度上兼具抗阻运动和有氧运动的共性,HIIT 对Rac1/PAK1/p38 MAPK信号通路的激活可刺激线粒体生物发生,激活血管生成的信号级联反应,提高骨骼肌的氧化能力,上调肌肉质量调节有关的基因和蛋白质的表达,增加肌肉蛋白质的合成并激活卫星细胞(Callahan et al.,2021)。
4 运动激活Rac1/PAK1/p38 MAPK 信号通路促进骨骼肌健康
Rac1/PAK1/p38 MAPK 信号通路的突变或持续激活与癌症、神经退行性疾病和代谢疾病的发生发展有关。相反,可控的或短暂激活此通路能保证机体正常生理功能,并且有规律的体育锻炼可以介导此通路,调节机体适应性和骨骼肌健康水平。抗阻运动通过增加骨骼肌质量提高葡萄糖摄取的能力,而耐力训练主要通过改善胰岛素抵抗、提高GLUT4 转运效率起作用(朱荣 等,2017)。
Rac1/PAK1/p38 MAPK 信号通路通过磷酸化相关蛋白激酶、转录因子、细胞骨架蛋白等调节细胞的下游事件(Bengal et al.,2020)提高糖酵解和柠檬酸循环通量、线粒体的数量和质量,促进运动骨骼肌适应代谢需求和能量需求(张媛 等,2018)。Rac1/PAK1/p38 MAPK 信号通路在骨骼肌的表达量与肌纤维类型有关。在小鼠比目鱼肌中,Rac1 蛋白的含量比趾长伸肌和腓肠肌中高40%~50%,其中腓肠肌中Rac1 的表达量比趾长伸肌高30%,这可能与慢肌纤维中GLUT4 含量较高相关,而人类比目鱼肌和腓肠肌的Rac1 表达情况与小鼠相似,且PAK1 mRNA和蛋白表达水平在比目鱼肌中更高(Sylow et al.,2013)。
Rac1/PAK1/p38 MAPK 信号通路促进运动引起的葡萄糖摄取(Sylow et al.,2014)。与野生型(wild type,WT)小鼠相比,Rac1 基因敲除(Rac1 knockout,Rac1 mKO)小鼠进行跑台运动后,胫骨前肌中葡萄糖摄取量减少65%,且GLUT4 的含量显著降低。在进食条件下,Rac1 mKO 小鼠和WT 小鼠的最大跑步能力相似,然而在糖原耗尽的状态下,Rac1 mKO 小鼠的运动能力比WT 小鼠降低了20%。Rac1 mKO 小鼠在运动后进行糖耐量测试的结果表明,在注射胰岛素前进行运动能够完全恢复由于缺失Rac1 引起的胰岛素抵抗,因此运动改善胰岛素敏感性的机制不受Rac1 缺失的影响(Sylow et al.,2016a)。由此说明,尽管2 型糖尿病患者骨骼肌内Rac1 的功能失常,但体育锻炼依然对该类人群具有积极的作用。相比抗阻运动,有氧运动对Rac1 引起的葡萄糖摄取和GLUT4 易位更为有效(Sylow et al.,2016b),p38 MAPK 通过诱导编码葡萄糖转运蛋白GLUT1 和GLUT4 的基因转录,以胰岛素非依赖性方式促进葡萄糖转运,并改善胰岛素介导的葡萄糖转运(Sylow et al.,2015)。
此外,当人类和小鼠进行中等强度有氧运动时,Rac1通过激活NADPH 氧化酶2(NADPH oxidase 2,NOX2)释放的ROS 调节葡萄糖的转运能力以控制新陈代谢(Henríquez-Olguin et al.,2019),并提高成肌细胞的融合效率(Youm et al.,2019)。运动激活Rac1/PAK1/p38 MAPK信号通路后,促进下游信号传导,调控肌动蛋白细胞骨架,上调MyoD 和MyoG 的表达,重新激活卫星细胞,促进肌源性分化,因此该通路可能作为调节衰老骨骼肌可塑性的重要途径(Tomida et al.,2020)。Rader 等(2020)发现,小鼠运动后胫骨前肌内炎症因子的表达量增多,白细胞迁移运动增强,与PAK1 等基因上调显著相关,表明该通路也可参与诱导炎症因子的激活,从而调节运动引起的早期损伤后的骨骼肌组织再生。
由此可见,Rac1、PAK1 和p38 MAPK 均能与多种效应蛋白结合以参与细胞生长、蛋白激酶的激活、细胞分泌及肌动蛋白重塑等细胞事件。运动能够调控Rac1/PAK1/p38 MAPK 信号通路相关蛋白的表达,并改善骨骼肌生成和糖代谢过程。运动后该通路使得下游成肌细胞融合相关的调节因子MyoD 和MyoG 表达增多,因而有助于肌纤维融合与再生。同时,活化的PAK1、p38 MAPK 促进骨骼肌内GLUT4 对葡萄糖的转运,从而维持血糖稳态(图3)。
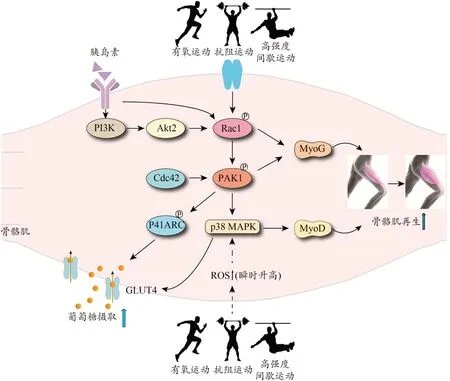
图3 运动对Rac1/PAK1/p38 MAPK信号通路的可能调控机制Figure 3.Possible Regulation Mechanism of Exercise on Rac1/PAK1/p38 MAPK Signaling Pathway
5 结论与展望
Rac1/PAK1/p38 MAPK 信号通路可通过促进骨骼肌再生和改善葡萄糖代谢能力,从而促进骨骼肌健康。由于Rac1 强烈受代谢状态调节,运动创设的代谢重编程环境可以激活Rac1,从而调节Rac1/PAK1/p38 MAPK 信号通路的功能状态,发挥其在骨骼肌功能改善中的作用。对Rac1/PAK1/p38 MAPK 信号通路的系统认识能够为运动或药物维护骨骼肌健康、改善慢性代谢性疾病提供思路,未来的研究或可把该通路作为肌肉衰减症、肌营养不良、肥胖等疾病的潜在治疗靶点。本研究仅提供了运动通过Rac1/PAK1/p38 MAPK 信号通路促进骨骼肌健康的综合分析和理论假设,其影响的程度及实际效果仍需要实验验证。

