中国被毛孢醇提物通过MAPK/NF-κB 通路双向调控巨噬细胞的免疫功能研究
李琪琪,王雪娇,初英杰,刘 霞,禹艳丽,王 遥*,贾 鑫*
1. 北京中医药大学中药学院,北京 100027
2. 北京中医药大学生命科学学院,北京 100027
冬虫夏草Cordycepssinensis(Berk.) Sacc.属于麦角菌科真菌,是我国特有的中草药,并被用于肾虚精亏、阳痿遗精、腰膝酸痛、久咳虚喘等症[1-3]。研究表明,冬虫夏草具有调血脂、抗衰老、抗疲劳、抗肿瘤等多种药理学活性。中国被毛孢是冬虫夏草的无性型菌株,也是其药理活性成分的主要来源和唯一代表性真菌。
冬虫夏草对机体的免疫调节及其药理功能发挥具有重要意义。冬虫夏草可发挥类似于免疫佐剂的功能,被用于改善移植病变和器官移植患者免疫力低下的辅助治疗[4]。研究发现,虫草水提取物具有治疗和改善辐射诱导的免疫抑制的功效[5]。此外,冬虫夏草表现出显著的抗炎作用,虫草水提取物通过抑制趋化因子表达,在免疫球蛋白 A(immunoglobulin A,IgA)肾病中发挥抗炎功能;虫草水提取物通过抑制细胞凋亡和促炎因子表达,从而减轻肝损伤和肝脏的局部炎症[6-8]。虫草多糖和虫草素是冬虫夏草(中国被毛孢菌丝体)水提物中的主要药效成分[9-10]。其中,虫草多糖可通过抗氧化和调血脂作用,发挥对非酒精性脂肪肝ApoE-/-小鼠的保护作用,并有效缓解博来霉素引起的小鼠肺纤维化[11-16]。虫草素通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路和抑制信号转导和转录激活因子1(signal transducers and activators of transcription 1,STAT1)磷酸化抑制过度炎症浸润,从而有效改善非酒精性脂肪肝[17-18]。然而,目前关于冬虫夏草醇提取物的免疫药理功能仍鲜有报道,探究其醇提物中的主要成分和免疫药理作用具有现实意义。本研究利用巨噬细胞和小鼠模型,探究中国被毛孢醇提物(Hirsutellasinensisalcohol extract,HSAE)的免疫调控功能和机制。
1 材料
1.1 细胞
小鼠巨噬细胞RAW264.7 购自美国ATCC。
1.2 动物
SPF 级C57BL/6 雄性小鼠,体质量18~20 g,6~8 周龄,购自斯贝福(北京)实验动物科技有限公司,许可证号SCXK(京)2019-0010。小鼠饲养于温度18~22 ℃、湿度50%~60%、12 h 光暗交替的环境中,自由进食饮水。所有动物实验和研究经北京中医药大学实验动物伦理委员会批准(批准号BUCM-2022-041303-2016),并严格按照动物实验相关章程执行。
1.3 药品与试剂
HSAE 冻干粉由云南大学与云南白药集团股份有限公司提供;去离子水为实验室Milli-Q(18.2 MΩ)自制超纯水、DMEM 高糖培养基(批号C11995500CP)、胎牛血清(批号2358184P)、BCA蛋白定量试剂盒(批号23227)、质谱级乙腈及甲酸购自美国Thermo Fisher Scientific 公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号D4540)、20×TBST溶液(批号T1082)、5×Tris-甘氨酸电泳缓冲液(批号T1070-500 mL)购自北京索莱宝科技有限公司;CCK-8 细胞增殖-毒性检测试剂盒(批号CK04)购自东仁化学科技(上海)有限公司;Trizol 试剂(批号15596018)购自Invitrogen 公司;Evo M-MLV RT Kit(批号AG11711)、0.25%胰蛋白酶/EDTA 细胞消化液(批号T1300)、SYBR®Green Premix Pro Taq HS qPCR Kit(批号AG11701)购自湖南艾科瑞生物工程有限公司;都氏试剂(批号R22785-100 mL)、绵羊红细胞(4%,批号R21900-100 mL)、补体(正常豚鼠血清,批号S27068-1 mL*10)、匹多莫德(批号S80183-5 g)购自上海源叶生物科技有限公司;PAGE 凝胶快速制备试剂盒(批号PG212)购自上海雅酶生物医药科技有限公司;超敏ECL 发光液(批号WBKLS0500)购自美国Millipore 公司;甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号60004-1-Ig)购自英国Abcam 公司;c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)抗体(批号9252S)、p-JNK抗体(批号 9251S)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)抗体(批号9102L)、p-ERK 抗体(批号9106S)、p38 抗体(批号9212S)、p-p38 抗体(批号9211S)购自美国CST 公司;HRP 标记的山羊抗兔IgG 抗体(批号M21002S)、HRP 标记的山羊抗小鼠IgG 抗体(批号M21001S)购自艾比玛特生物医药(上海)有限公司;脂多糖(lipopolysaccharide,LPS,批号L4391)购自美国Sigma 公司。
1.4 仪器
CFX96 型荧光定量PCR 仪、T100 型PCR 仪、SCl-VS 型可调式混匀仪(美国Scilogex 公司);PowerPac 型基础电泳仪(美国Bio-Rad 公司);UPLC-QE-Orbitrap-MS 质谱仪(Xcalibur 质谱工作站)、NANODROP ONEc 型分光光度计、Sorvall™Legend™ Micro 21R 型微量离心机、1300 Series A2型生物安全柜、Heracell 150i 型CO2培养箱(美国Thermo Fisher Scientific 公司);SpectraMax i3x 型多功能酶标仪[美谷分子仪器(上海)有限公司];Mill-Q 超纯水仪(美国Millipore 公司);ZHCH-C1115B型超净工作台(上海智城分析仪器制造有限公司);DK-8D 型电热恒温水槽(上海一恒科技有限公司);SK-L180-Pro 型数控线性摇床[大龙兴创实验仪器(北京)股份公司];EPS-300 型数显式稳压稳流电泳仪(上海天能公司);CKX53 型倒置显微镜(日本Olympus 公司)。
2 方法
2.1 药物配制
取HSAE 冻干粉100 mg,加入1 mL DMSO 充分振荡混匀,即为100 μg/μL 母液,分装后储存于-80 ℃待用。
2.2 细胞培养
RAW264.7 细胞用含1%青霉素-链霉素混合液和10%胎牛血清的DMEM 培养基,在5% CO2、37 ℃的培养箱中培养,待细胞密度为90%左右时,按1∶5 的比例进行传代。
2.3 液质联用色谱-质谱分析
2.3.1 样品溶液的制备 精密称取HSAE 冻干粉20 mg 于1.5 mL EP 管,加入1 mL 甲醇涡旋溶解,12 000 r/min 离心10 min,取上清液,用0.22 μm 微孔滤膜滤过,取续滤液,即得样品溶液。
2.3.2 液相条件 Waters HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~30 min,5%~95% B。柱温40 ℃;体积流量0.2 mL/min;进样量2 μL。
2.3.3 质谱条件 离子源为电喷雾电离源(ESI);正负离子同时扫描;扫描模式为Full scan/dd MS2,扫描范围m/z100~1500;毛细管温度350 ℃;正离子模式喷雾电压3500 V,负离子模式喷雾电压3000 V;鞘气35 arb,辅助气15 arb;标准化碰撞能为35%;一级质谱分辨率为70 000,二级质谱分辨率为17 500。
2.4 CCK-8 法检测细胞增殖活性
RAW264.7 细胞以9×104/孔接种于96 孔板,培养箱中过夜使细胞完全贴壁且细胞密度为80%~90%。用DMEM 完全培养基稀释HSAE 母液至相应质量浓度(1×10-4、1×10-3、0.01、0.1、1、10、100、1000、1×104μg/mL),将稀释好的HSAE 溶液加入细胞中,每孔100 μL,同时设置仅加入DMEM 完全培养基(无细胞)的空白组和加入1%DMSO 的溶剂对照组(有细胞),每组设置3 个复孔,于5% CO2、37 ℃的细胞培养箱中培养24 h;每孔加入10 μL CCK-8 试剂,于培养箱中孵育30 min,待培养基变为橙黄色后,酶标仪测定450 nm处的吸光度(A)值,计算细胞存活率,绘制细胞增殖曲线。
2.5 细胞吞噬活性检测
RAW264.7 细胞以9×104/孔接种于96 孔板,培养箱中过夜使细胞完全贴壁且细胞密度为80%~90%。用DMEM 完全培养基稀释HSAE 母液至相应质量浓度(1×10-4、1×10-3、0.01、0.1、1、10、100、1000、1×104μg/mL),分别用稀释好的HSAE溶液和LPS(500 ng/mL,阳性对照)处理细胞,每组设置3 个复孔,于5% CO2、37 ℃的细胞培养箱中培养24 h 后,弃去上清,每孔加入100 μL 1%中性红溶液,培养箱中孵育1 h,用PBS 洗涤3 次,每孔加入100 μL 细胞裂解缓冲液(无水乙醇-冰醋酸1∶1),4 ℃静置过夜,酶标仪测定570 nm 处的A值,计算细胞吞噬活性。
2.6 小鼠体内血清溶血素测定实验
将小鼠分为空白组(PBS)、匹多莫德(100 mg/kg)组和HSAE 低、中、高剂量(50、100、200 mg/kg)组,每组5 只。各组小鼠ig 200 μL 相应药物,1 次/d,连续21 d;实验结束前5 d 开始,各组小鼠ip 0.2 mL 绵羊红细胞致敏,直至实验结束,小鼠摘眼球取血后脱颈椎处死。血液放置30 min 后经离心分离得到血清,将血清与生理盐水按1∶500 的比例混匀,吸取0.5 mL 稀释后的血清,与0.25 mL绵羊红细胞混合,在低温下加入0.5 mL 豚鼠血清混合。设置不加血清的对照组,37 ℃恒温箱中孵育30 min,随后立即移至0 ℃冰箱结束反应,3000 r/min离心5 min,取上清液,酶标仪检测540 nm 处的A值。将0.25 mL 绵羊红细胞与3.75 mL 都氏试剂混合后测定A值,代表绵羊红细胞的半数溶血值(half value of hemolysin,HC50)。
2.7 qRT-PCR 检测HSAE 对细胞因子表达的影响
RAW264.7 细胞以4×105/孔接种于24 孔板,过夜培养使其完全贴壁。设置浓度梯度加药和时间梯度加药实验。用DMEM 完全培养基稀释HSAE母液(100 μg/μL)至相应质量浓度(25、50、100、200 μg/mL),加或不加LPS(500 ng/mL)共同孵育2 h,收集细胞。
用DMEM 完全培养基稀释HSAE 母液(100 μg/μL)至200 μg/mL,加或不加LPS(500 ng/mL)共同孵育30、60、90 min,收集细胞。按照试剂盒说明书提取细胞总RNA 并合成cDNA,进行qRTPCR 分析。肿瘤坏死因子(tumor necrosis factor,Tnf)、CXC 趋化因子配体10(CXC chemokine ligand 10,Cxcl10)和干扰素β1(interferon beta 1,Ifnb1)的引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.8 Western blotting 检测HSAE 对p-p38、p38、p-p65、p65、p-JNK、JNK、p-ERK 和ERK 蛋白表达的影响
RAW264.7 细胞以8×105/孔接种于12 孔板,过夜培养使其完全贴壁。按“2.7”项下方法给药,过夜培养使其完全贴壁。按“2.7”项下方法给药,收集细胞,使用IP 裂解液使细胞充分裂解,离心后取上清,加入5×Loading Buffer,100 ℃使蛋白变性,BCA 法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭后加入一抗,4 ℃孵育过夜,室温孵育二抗,显影。
2.9 统计学分析
所有数据使用GraphPad Prism 9.0 软件进行统计学分析,使用单因素方差分析进行组间比较,结果采用±s表示。
3 结果
3.1 HSAE 的成分测定
利用HPLC-MS 技术鉴定分析HSAE 中所含成分,HPLC-MS 基峰图见图1。《中国药典》2020 年版规定腺苷为鉴定冬虫夏草的主要有效成分[21],HSAE 所含成分主要包含核苷、氨基酸类以及虫草酸等。其中腺苷为核苷类的主要成分,但未鉴定出虫草多糖和虫草素成分(表2)。虫草多糖为极性分子,多包含于水提物成分[9-10];此外,多个团队也报道冬虫夏草中不含虫草素成分[22-27]。

图1 HSAE 的HPLC-MS 基峰图Fig. 1 HPLC-MS base peak map of HSAE

表2 HSAE 主要成分及分类Table 2 Main components and classification of HSAE
3.2 HSAE 对巨噬细胞活性的影响
使用CCK-8 法检测不同质量浓度的HSAE 处理24 h 对RAW264.7 细胞存活率的影响,并绘制量-效关系曲线,计算得到HSAE 对细胞的半数抑制浓度(half inhibitory concentration,IC50)为933.3 μg/mL(图2)。选取5、50、100、200 μg/mL 4 个质量浓度进行后续细胞实验。

图2 HSAE 对巨噬细胞存活率的影响 (±s, n = 3)Fig. 2 Effect of HSAE on survival rate of macrophages(±s, n = 3)
3.3 HSAE 可以增加巨噬细胞的吞噬能力
巨噬细胞吞噬入侵的病原体并递呈抗原,分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和IL-1β 等促炎细胞因子,从而激活招募多种免疫细胞共同抵抗病原体的入侵。巨噬细胞可吞噬中性红染料,其吞噬能力可通过定量巨噬细胞吞噬中性红后的吸光度变化所反映。在HSAE 或LPS(阳性对照,LPS 具有激活巨噬细胞吞噬的功能)处理后的细胞中加入中性红溶液,1 h 后除去,再将细胞裂解,静置过夜后检测A值的变化。如图3 所示,HSAE 处理能够显著增加巨噬细胞的吞噬能力,并呈剂量相关性(P<0.01、0.001),其促进吞噬的作用强于阳性对照LPS处理组。

图3 HSAE 对巨噬细胞吞噬能力的增强作用 (±s, n = 3)Fig. 3 Enhancement of phagocytosis of macrophages by HSAE (±s, n = 3)
3.4 HSAE 对小鼠脏器指数和免疫功能的影响
如图4 所示,各给药组小鼠肾、脾和胸腺脏器指数均显著升高(P<0.05、0.01、0.001),匹多莫德组和HSAE 低剂量组肝脏器指数显著升高(P<0.05、0.01),各给药组均可增强小鼠的血清溶血素水平。
3.5 HSAE 能激活静息状态下巨噬细胞中免疫因子的表达
促炎细胞因子的分泌对于维持和调节免疫系统稳态至关重要。因此,考察HSAE 单独刺激时对细胞因子表达的影响,如图5 所示,与对照组比较,HSAE 诱导Tnf、Cxcl10和Ifnb1基因表达增加(P<0.01、0.001),且呈剂量和时间相关性,表明HSAE能够促进静息巨噬细胞中促炎细胞因子的表达。

图4 HSAE 对小鼠的抗炎及免疫调节作用 (±s, n = 5)Fig. 4 Anti-inflammatory and immunomodulatory effects of HSAE on mice (±s, n = 5)

图5 HSAE 诱导巨噬细胞中相关细胞因子基因的表达 (±s, n = 3)Fig. 5 HSAE induced cytokine gene expressions in macrophages (±s, n = 3)
3.6 HSAE 能抑制LPS 诱导炎症激活的巨噬细胞中免疫因子的表达
LPS 是一种常用的细菌内毒素,巨噬细胞识别LPS 后,激活细胞信号转导,转录并释放多种促炎细胞因子,激活炎症反应。HSAE 与LPS 共处理后,检测细胞中促炎细胞因子与干扰素的表达,如图6所示,与单独LPS 刺激组相比,在RAW264.7 细胞中HSAE 与LPS 共处理后,Tnf、Cxcl10、Ifnb1mRNA表达随着药物质量浓度升高而下降(P<0.05、0.01、0.001),抑制效果呈时间相关性。以上结果表明,HSAE 可以抑制炎症激活后巨噬细胞中促炎细胞因子和干扰素的mRNA 表达,从而发挥其抗炎效应。
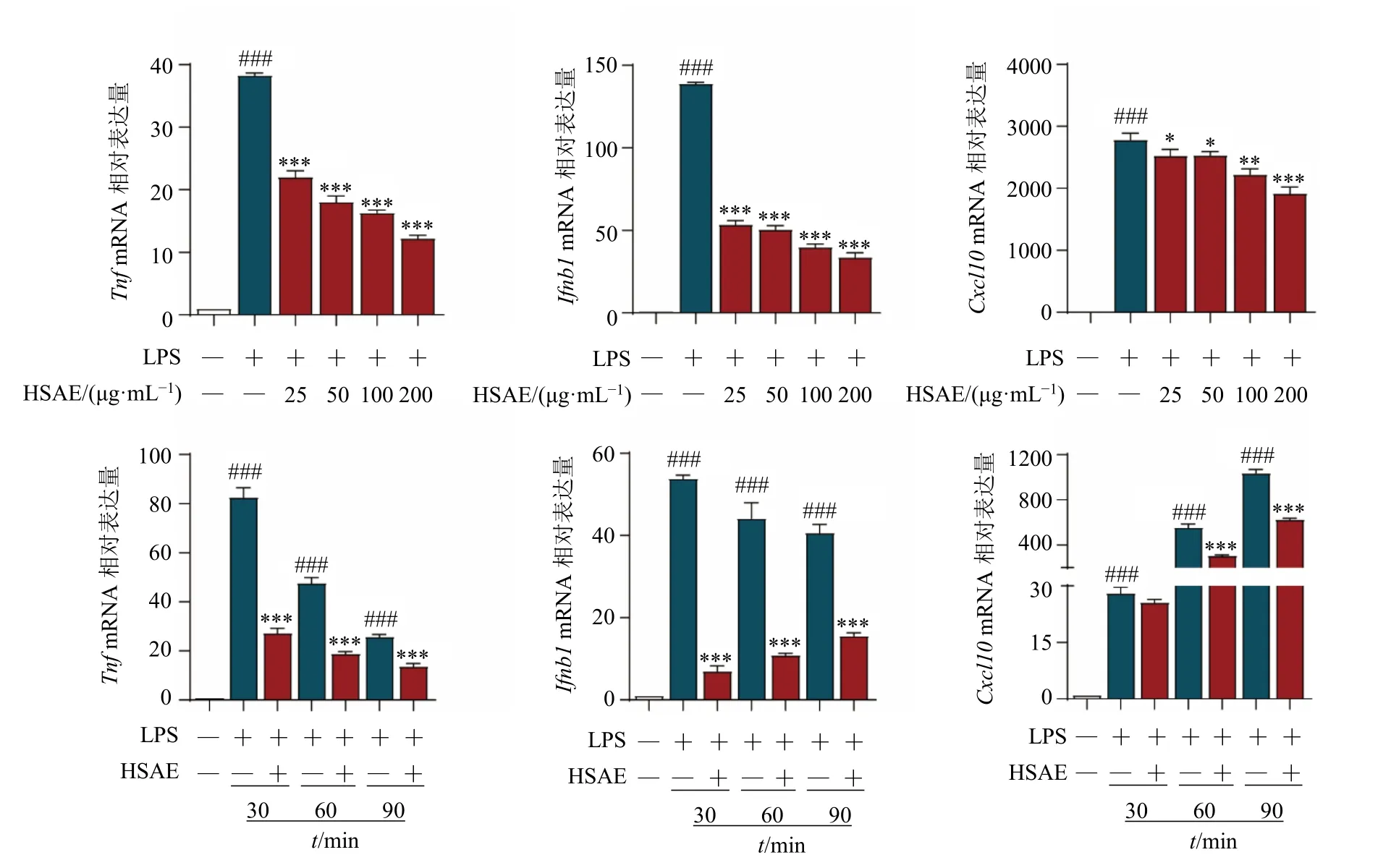
图6 HSAE 抑制LPS 诱导的炎症因子表达 (±s, n = 3)Fig. 6 HSAE inhibited expressions of inflammatory factors induced by LPS (±s, n = 3)
3.7 HSAE 通过调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)通路介导免疫双向调控功能
为了探究HSAE 的免疫调控功能的分子机制,采用Western blotting 检测MAPK 通路关键因子JNK、ERK、p38 和NF-κB 通路的重要亚基p65 的磷酸化变化。如图7-A 所示,静息状态下的RAW264.7 细胞中,随着HSAE 质量浓度的升高,细胞中p-JNK、p-ERK 和p-p65 的蛋白磷酸化水平相对逐步增强,与对照组相比具有显著差异(P<0.05、0.01);而HSAE 不同时间点处理后,p-JNK、p-ERK 和p-p65 的蛋白磷酸化水平随时间增加而减弱(图7-B)。

图7 HSAE 激活MAPK 通路和NF-κB 通路 (±s, n = 3)Fig. 7 HSAE activated MAPK pathway and NF-κB pathway (±s, n = 3)
如图7-C 所示,在LPS 诱导的炎症激活模型中,加入HSAE 处理不同时间,LPS 激活的p-JNK、p-ERK、p-p38 和p-p65 蛋白磷酸化水平逐步抑制,与LPS 刺激组比较差异显著(P<0.01、0.001)。以上结果表明,HSAE 的免疫双向调控与其对MAPK通路和NF-κB 通路的调控密切相关。
4 讨论
免疫系统的严密调控是维持人体健康的充分必要条件。机体免疫力低下,其免疫应答不足或不及,可造成病原微生物入侵并在宿主体内增殖、复制,诱发病原感染性疾病。此外,宿主免疫识别病原入侵信号后,激活炎症相关信号通路,诱发炎症反应。适度的炎症反应是机体清除病原微生物的重要方式,然而,当炎症信号过度或持续激活,则会导致炎症性的组织损伤,诱发机体的系统性病变和肿瘤发生。因此,探究冬虫夏草的免疫双向调控功能及其作用的分子机制,具有重要的科学意义和临床应用价值。
巨噬细胞是固有免疫中一类重要的抗原递呈细胞,具有吞噬杀伤病原体和递呈病原体抗原的作用,其通过分泌多种细胞因子,在调控机体的固有免疫和适应性免疫应答中发挥着不可或缺的作用[19-20]。病原体感染或组织损伤时,巨噬细胞通过细胞膜上和细胞质中的模式识别受体(pattern recognition receptor,PRRs)识别病原体的病原相关分子模式(pathogen-associated molecular patterns,PAMP),激活MAPK 亚家族的成员,包括ERK、p38 和JNK亚家族以及NF-κB 的磷酸化诱导TNF-α、IL-1β、IL-6 等促炎细胞因子表达,从而发挥调控固有免疫和适应性免疫的功能。
研究表明,虫草多糖单独处理可以诱导巨噬细胞中IL-1β、IL-6 和TNF-α 等细胞因子的分泌,增强巨噬细胞的吞噬活性[9-10]。本研究发现,HSAE 可以促进静息状态下RAW264.7 细胞的吞噬能力,并显著增加Tnf、Cxcl10等基因的表达。表明HSAE在体外具有明确的免疫激活作用。利用LPS 刺激的巨噬细胞炎症模型,发现HSAE 显著下调Tnf、Cxcl10的mRNA 表达水平,并呈剂量和时间相关性。此外,HSAE 单独处理促进了RAW264.7 巨噬细胞MAPK 和NF-κB 信号通路激活,并在炎症激活后抑制了MAPK 和NF-κB 信号通路关键因子的磷酸化。上述结果与虫草素的免疫双向调控功能的报道一致。
本研究首次阐明HSAE 的双向免疫调控功能,初步发现该活性可能与其对MAPK 和NF-κB 通路的调控有关,为中国被毛孢的临床应用和药理学研究提供了实验数据支撑。
利益冲突所有作者均声明不存在利益冲突

