多黏菌素B相关肾毒性的研究进展Δ
王 静,吴轩宇,朱怀军,2#
(1.南京中医药大学鼓楼临床医学院药学部,南京 210008; 2.南京大学医学院附属鼓楼医院药学部,南京 210008)
多黏菌素类抗菌药物在20世纪50年代后期被临床用于治疗革兰阴性菌感染,但由于不良反应发生率高,其逐渐被其他更安全的抗菌药物取代。近年来,多重耐药革兰阴性菌(MDR-GNB)感染的发病率呈升高趋势,尤其是肠杆菌科、铜绿假单胞菌和不动杆菌[1]。多黏菌素作为治疗MDR-GNB感染的一线药物,又重新进入临床使用。多黏菌素类抗菌药物主要包括5种,临床上常用的是多黏菌素B和多黏菌素E[2]。多黏菌素B和多黏菌素E具有相似的活性和化学结构。多黏菌素E为前体药物,需在体内进行转化才具有抗菌活性;而多黏菌素B给药形式就是活性药物,药动学变异相对较小[3]。另外,美国食品药品监督管理局不良事件报告系统数据显示,与多黏菌素B相比,多黏菌素E的肾毒性报告率更高[4]。因此,多黏菌素B在许多医疗机构得到了广泛应用。
多黏菌素B相关肾毒性一直是临床医师在使用该药时面临的挑战,特别是对于危重症感染患者,病情复杂,危险因素多,可能会进一步增加肾毒性的发生风险,严重影响患者预后[5-6]。有文献报道,发生多黏菌素B相关性肾损伤的患者,用药后第1年的死亡率高达46.1%,且仅1/3的患者能在1年内恢复基线肾功能[7]。因此,医师和药师需要加强对多黏菌素B相关肾毒性的认识。本文对多黏菌素B相关肾毒性的发生率、发生机制、危险因素和降低肾毒性策略进行综述,以期为减少肾毒性的发生提供帮助。
1 多黏菌素B相关肾毒性的发生率
既往文献报道,多黏菌素B相关肾毒性的发生率为17%~67.7%。肾毒性评估统一标准的缺乏,可能是发生率报道差异的原因。最初制定的肾毒性评估标准是“风险、损伤、失败、损失、终末期肾病”(RIFLE)分级诊断标准,由于肾小球滤过率评价困难,在此标准的基础上,学者们又提出了急性肾损伤网络诊断标准。后来,为了进一步提高诊断的准确性,改善全球肾脏预后组织(KDIGO)又发布了新的诊断标准。肾毒性定义的不一致,会影响发生率结果的可比性。近期的一项Meta分析使用RIFLE标准对多黏菌素的肾毒性进行评价,研究共纳入48个队列,6 199例成年患者,结果发现多黏菌素B的肾毒性发生率为38%,该研究为多黏菌素B相关肾毒性发生率提供了科学的汇总结果[8]。除了肾毒性诊断标准不同,给药剂量和给药频次也会影响肾毒性发生率。陈丽娟等[9]对90例患者进行分组分析,结果显示,高剂量组急性肾损伤(acute kidney injury,AKI)发生率高于标准剂量组,两组患者AKI发生率的差异具有统计学意义(P<0.05)。Okoduwa等[10]的研究结果表明,与1日2次给药相比,1日1次给药更有可能导致肾毒性的发生。另外,种族差异会影响药动学,也会造成肾毒性发生率结果的不同[11]。多黏菌素B相关AKI的发生率和危险因素汇总见表1。
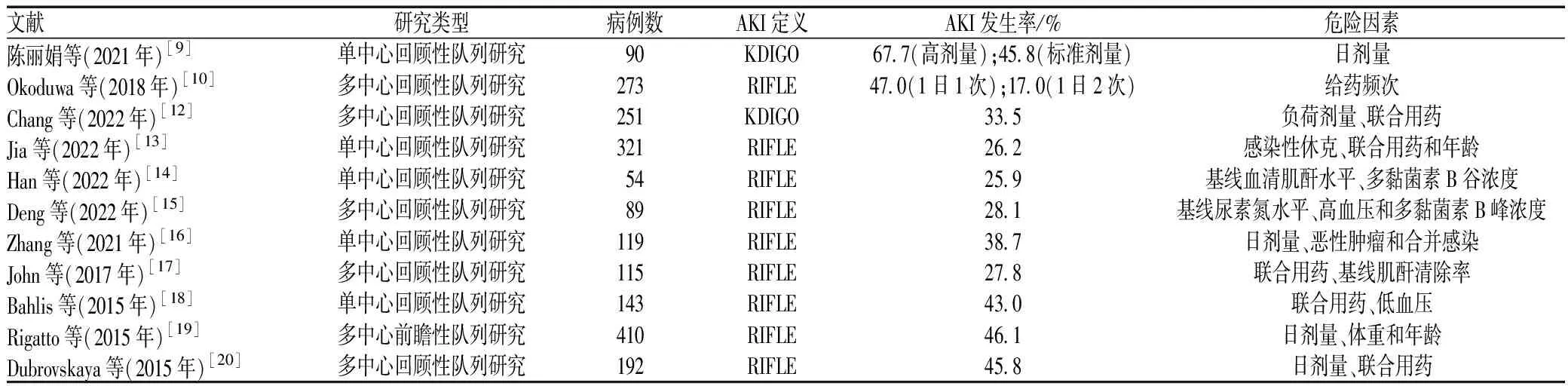
表1 多黏菌素B相关AKI的发生率和危险因素汇总Tab 1 Summary of incidence and risk factors of polymyxin B-associated nephrotoxicity
2 多黏菌素B相关肾毒性的发生机制
多黏菌素B相关肾毒性的起始因素是药物在近端肾小管细胞的高度累积。研究结果证实,多黏菌素B给药后6 h,大鼠肾组织与血清药物浓度比值为19.62[21]。早期研究认为肾毒性的发生机制是细胞膜通透的增加,近期研究发现与巨噬细胞毒性及肾小管细胞的凋亡相关。此外,氧化应激也参与多黏菌素B诱导的肾毒性过程。
2.1 细胞膜和细胞毒性
Berg等[22]的研究结果表明,多黏菌素B能增加细胞膜通透性,使阳离子、阴离子和水的流入增加,导致细胞肿胀和破裂,直至死亡。近期的研究发现,多黏菌素B对巨噬细胞具有选择性,能够引发巨噬细胞坏死,导致白细胞介素1β和高迁移率族蛋白1过度释放,诱导肾毒性的发生[23]。
2.2 细胞凋亡
药物在肾脏的蓄积会诱导细胞凋亡,细胞凋亡的主要途径包括死亡受体激活途径和线粒体损伤途径[24-25]。死亡受体途径是细胞损伤过程中最敏感的途径之一。多黏菌素B可诱导胱天蛋白酶(Caspase)-3、Caspase-8和Caspase-9激活,而Caspase级联的激活是细胞凋亡过程中的关键事件。多黏菌素B以浓度和时间依赖性方式诱导大鼠肾小管细胞凋亡相关因子配体(FasL)表达,使细胞死亡表面受体(Fas)与FasL相互结合,触发启动子Caspase-8的激活,随后引发Caspase-3激活,Caspase-3是DNA断裂和细胞凋亡破坏阶段的主要执行者[26-27]。Yun等[28]在多黏菌素B诱导细胞死亡途径的研究中也发现,其引起的肾毒性与DNA损伤有关,可导致染色体错误分离和基因组不稳定。另一条是Caspase-8激活线粒体途径,使线粒体氧化应激增强,从而引起细胞色素C释放,细胞色素C与凋亡蛋白酶激活因子1和Caspase-9结合,促使Caspase-9激活,进而激活Caspase-3。另外,细胞凋亡过程中,多黏菌素B以浓度和时间依赖性方式诱导线粒体形态学发生损伤,从正常的丝状形态转变为碎片状态[24]。
2.3 氧化应激损伤
氧化应激是指体内氧化和抗氧化作用的失衡状态,是导致疾病发生的重要影响因素。Vattimo等[29]的研究结果表明,多黏菌素B可以诱导活性氧自由基(ROS)生成增加,过量的ROS会使调节细胞氧化还原状态的抗氧化酶活性降低,导致细胞死亡。Azad等[30]的小鼠模型研究发现,蛋氨酸对多黏菌素诱导的肾毒性具有保护作用,而蛋氨酸的衍生物具有很强的抗氧化活性,可清除ROS和活性氮,间接证实了氧化应激参与肾毒性的发生。
3 多黏菌素B导致肾毒性的危险因素
国内外已有多项研究探索多黏菌素B导致肾毒性的危险因素(见表1),结果表明,血药浓度、给药剂量、年龄和联合用药等多个因素都会导致患者发生肾毒性的风险增加[9-10,12-20]。
3.1 血药浓度
多黏菌素的治疗窗窄,血药浓度监测不仅可以提高抗菌效果,也能减少不良反应[31]。《多黏菌素类合理应用国际共识指南》[32]推荐,平均血浆浓度维持在2~4 mg/L,有助于降低肾毒性发生的风险。Han等[14]分析了多黏菌素B稳态谷浓度与肾毒性的关系,发现当谷浓度≥3.13 mg/L时,发生AKI的概率>50%。然而,Deng等[15]的研究结果显示,与谷浓度相比,稳定状态下的多黏菌素B峰浓度是预测AKI发生的良好指标。上述研究结果表明,多黏菌素B在体内的暴露与肾毒性发生具有相关性,但最佳检测指标仍有待更多的研究。
3.2 给药剂量
多黏菌素B的负荷剂量和维持剂量都与肾毒性具有相关性。Chang等[12]证实了多黏菌素B负荷剂量是发生AKI的独立危险因素。负荷剂量可能会导致肾小管细胞在短时间内重吸收大量药物,进而诱导细胞凋亡。此外,多项研究揭示了不同给药策略与多黏菌素B肾毒性的关系。Zhang等[16]分析了119例患者的肾毒性危险因素,结果表明,多黏菌素B的维持剂量≥200 mg/d与严重肾损害发生相关。Rigatto等[19]发现,多黏菌素B的维持剂量≥150 mg/d时,AKI的发生风险增加2倍。而Dubrovskaya等[20]的研究结果提示,基于体重来计算维持剂量也会增加药物发生肾毒性的风险。虽然多黏菌素引起的肾毒性具有浓度依赖性,但是通过减少给药剂量来降低肾毒性是不科学的,因其不仅会影响临床疗效,同时可能造成耐药亚群的扩大[33]。因此,迫切需要更大规模的群体药动学研究优化给药方案,降低肾毒性。
3.3 年龄
高龄是多黏菌素B诱导肾毒性的危险因素。Jia等[13]考察了患者年龄与多黏菌素B相关肾毒性的关系,结果表明,年龄≥60岁是AKI的独立危险因素,≥60岁患者的AKI发生率为<60岁患者的1.84倍。Rigatto等[19]也认为,年龄与AKI的发生独立相关。然而,年龄对AKI的风险是否存在线性关系目前尚不清楚,需要进一步研究证实[34]。
3.4 联合用药
多黏菌素B与其他药物联合应用有助于提高临床疗效,降低死亡率。《多黏菌素类合理应用国际共识指南》[32]也建议,使用多黏菌素B联合1种或1种以上其他药物治疗难治性肠杆菌科细菌感染或鲍曼不动杆菌感染。然而,有证据表明2种或多种肾毒性药物与多黏菌素B联合应用是肾毒性发生的独立危险因素[12]。Jia等[13]发现,多黏菌素B与万古霉素或袢利尿剂同时使用会增加AKI的发生风险。其他相关研究结果同样证实,多黏菌素B联合其他肾毒性药物如氨基糖苷类抗菌药物、两性霉素B等,会增加患者发生AKI的风险[17-18,20]。因此,临床医师需对多黏菌素B联合肾毒性药物治疗的患者加强监测,并及时进行用药剂量调整。
3.5 其他因素
有文献报道,并发症是AKI发生的影响因素,如感染性休克、恶性肿瘤、血压过高或过低等[13,15-16,18]。基线血清肌酐水平和基线尿素氮水平也曾被证实是诱导AKI的独立危险因素[14-15]。此外,也有研究者发现,较高的体重与AKI风险增加独立相关[19]。使用多黏菌素B期间存在以上潜在的危险因素时,临床医师需要提高警惕。
4 降低肾毒性的新策略
4.1 多黏菌素衍生物的开发
近年来,许多研究者致力于多黏菌素衍生物的开发,以改善抗菌活性和降低毒性。Chen等[35]评估了多黏菌素衍生物AL-6对体内外耐药的鲍曼不动杆菌的活性,发现AL-6比多黏菌素具有更高的活性,且高剂量的AL-6还可以提高小鼠的存活率。Roy等[36]比较了新型多黏菌素B制剂VRP-034与多黏菌素B的毒性,结果表明,新型制剂可以显著降低多黏菌素B诱导大鼠肾损伤的风险。此外,多黏菌素B九肽等衍生物的开发也为降低肾毒性提供了新的研究方向[37]。
4.2 群体药动学模型的应用
群体药动学模型将药动学基本原理和统计学模型结合起来,考察药物在体内处置过程的影响因素,从而制定合理的个体化给药方案,减少不良反应的发生。对于不同类型的患者,国内外已开发多个多黏菌素B群体药动学模型,包括肾功能不全患者、肥胖患者、重症感染患者和囊性纤维化患者等[38-40]。基于群体药动学模型进行剂量调整,在减少不良反应方面的应用价值,仍需要进一步的临床实践探究。
4.3 代谢组学技术的应用
代谢组学生物标志物可以动态、灵敏地揭示生物体生理和病理状态的代谢差异。代谢组学技术已被用于探索药物性肾损伤的机制,发现与肾毒性相关的潜在或早期生物标志物,为疾病的诊断、治疗和预后提供支持。Locci等[41]在动物实验中通过代谢组学技术探索与多黏菌素B肾毒性相关的代谢标志物,发现牛磺酸与肾损伤分子具有相关性,牛磺酸可能是多黏菌素B引起AKI的早期信号。该研究为肾损伤的早期发现开辟了新思路,药物代谢组学技术将成为患者个体化给药的重要工具。
5 总结
综上,本文对多黏菌素B相关肾毒性的发生率、发生机制、危险因素和降低肾毒性策略进行综述,解释了肾毒性评估标准不同可能会引起发生率的差异,也对肾毒性发生机制提出了新的补充。另外,已往发表的综述大多局限于剂量、体重和给药频次等因素对肾毒性的影响,药物在体内的暴露与肾毒性的关系尚不完全清楚,本文在此基础上,更全面地阐释了多黏菌素B诱导肾毒性的危险因素。由于所有的研究均为回顾性研究,部分研究的样本量较小,需要前瞻性大样本研究进一步阐明上述问题。临床医师应严格制定给药策略,既要避免AKI的发生风险,又不能影响抗菌活性,特别是对于老年人、联合应用肾毒性药物、有多种并发症以及肥胖的患者。同时,本文也进一步探讨了降低多黏菌素B相关肾毒性的方法,可为多黏菌素B在临床上的合理应用提供参考。

