自拟祛浊清源汤用于临床期糖尿病肾病患者的疗效观察Δ
高福顺,史红星,张 静,王 鑫,陈立祥
(1.衡水市中医医院内分泌肾病科,河北 衡水 053000; 2.衡水市中医医院药剂科,河北 衡水 053000; 3.衡水市中医医院医务科,河北 衡水 053000)
糖尿病肾病(diabetic nephropathy,DN)是由于糖尿病患者肾脏血流灌注异常、脂质代谢紊乱和炎症细胞因子作用等多种因素导致的继发性肾损害,初期症状较轻,以微量蛋白尿为主要表现,随着DN进展至临床期,蛋白尿大量增多,肾小球硬化等病理损害进行性加重,直至发展为肾衰竭,需要维持性透析或肾脏移植[1-2]。如何延缓临床期DN进程,促进患者肾功能恢复成为临床治疗的难点。近年来的研究结果显示,多种中药复方联合血管紧张素转化酶抑制剂(ACEI)用于DN可发挥明显的减毒增效作用,可使患者的蛋白尿和肾损伤得到进一步缓解[3-4]。DN属于中医学“消渴”之变证,以浊毒内潜,肾络受损为其病机关键,治疗当以逐瘀剔浊、清源固本为原则。祛浊清源汤是我院以“浊郁肾络”为理论基础所拟定的临床效验方,在前期临床观察及实践中用于DN患者的疗效明显。本研究进一步评价祛浊清源汤联合常规ACEI治疗对临床期DN的疗效及安全性,并观察其不同疗程对DN患者糖脂代谢及促炎因子水平的影响,以期为临床期DN的防治提供新思路。
1 资料与方法
1.1 资料来源
选取2019年9月至2021年3月我院收治并确诊的临床期DN患者共120例。诊断标准:(1)西医诊断标准参考《中国成人糖尿病肾脏病临床诊断的专家共识》[5]中DN的诊断标准,即糖尿病病史≥5年,尿白蛋白排泄率(UAE)6个月内连续2次≥30 mg/24 h,空腹血糖(FBG)≥7.0 mmol/L,分期为Ⅳ期(UAE持续200 μg/min,或尿蛋白>0.5 g/24 h);(2)中医诊断标准参考《糖尿病及其并发症中西医诊治学》[6]中DN的中医辨证标准,即表现为口渴引饮、消谷善饥、水肿、眩晕、倦怠乏力、腰膝酸软和夜尿频多。纳入标准:符合上述西医、中医诊断标准;糖化血红蛋白(HbA1c)<8%;收缩压≤140 mm Hg(1 mm Hg=0.133 kPa),舒张压≤90 mm Hg;病例资料完善。排除标准:肾动脉狭窄或其他肾脏损伤疾病者;存在心、脑、肝和造血系统严重原发病或恶性肿瘤患者;并发感染、心力衰竭者;对本研究用药过敏或过敏体质者。
根据患者就诊顺序编号为1—120,采用SPSS 20.0软件按计算机随机数字分组法将其分为对照组和治疗组,各60例。对照组患者年龄48~75岁,DN病程2~16年,糖尿病病程5~17年。治疗组患者年龄50~77岁,DN病程3~19年,糖尿病病程4~20年。两组患者的基线资料均衡性较好,具有可比性,见表1。本研究所有内容均经我院伦理委员会审核批准(伦理审批号:2019-030-07)。患者均自愿参与并对研究内容知情。

表1 两组患者基线资料比较Tab 1 Comparison of baseline data between two groups
1.2 方法
对照组患者采用常规西医治疗:胰激肽原酶肠溶片1次240 U,1日口服3次;雷公藤多苷片1次20 mg,1日口服3次;同时参照《中国糖尿病肾脏病防治指南(2021年版)》[7]控制饮食,予以降糖(利格列汀片,1次5 mg,1日口服1次)、调脂(阿托伐他汀钙片1次10 mg,1日口服1次)和降压(马来酸依那普利片,1次5 mg,1日口服1次)等基础治疗。
治疗组患者在常规西医治疗基础上加服祛浊清源汤。祛浊清源汤组方:威灵仙30 g,穿山龙30 g,首乌藤30 g,水蛭6 g,土鳖虫6 g,红景天20 g,灵芝20 g,晚蚕砂20 g,三棱15 g,莪术15 g,土茯苓15 g,车前子15 g;根据患者症状随证加减,其中痰浊偏盛者(15例)表现为头晕、咳嗽痰多,加皂角刺10 g;湿浊偏盛者(18例)表现为头重如裹、身体困重、口腻,加佩兰30 g;瘀浊偏盛者(17例)表现为舌有瘀斑瘀点、脉涩,加地龙10 g;虚浊并重者(10例)表现为腰膝酸软,精神不振,加红芪30 g。将药物常规水煎至400 mL,分早、晚2次,于餐后30 min至1 h温服。
两组患者均以8周为1疗程,共治疗3个疗程。
1.3 观察指标
(1)肾功能、血糖指标:于治疗前,治疗8、16及24周后,分别检测两组患者的FBG、餐后2 h血糖(2 hBG)和HbA1c水平,观察患者24 h尿蛋白量(24 h UPR)变化,采用全自动生化分析仪检测血肌酐(SCr)、尿素氮(BUN)水平;基于CKD-EPI公式,根据SCr结果计算肾小球滤过率(eGFR)。(2)血脂指标:于治疗前,治疗8、16及24周后,取两组患者空腹静脉血,采用全自动生化分析仪检测总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)水平。(3)血清炎症因子:于治疗前,治疗8、16及24周后,取两组患者空腹静脉血,采用酶联免疫吸附试验检测血清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和转化生长因子-β1(TGF-β1)水平。(4)疗程期间密切观察两组患者药品不良反应情况,记录出现时间、具体表现和转归,计算不良反应发生率。(5)分别于治疗前,治疗8、16及24周后,观察两组患者口渴引饮、倦怠乏力和腰膝酸软等主要中医证候,分别按症状的严重程度记为0分(无)、2分(轻)、4分(中)及6分(重)。
1.4 疗效评定标准
参照《中药新药临床研究指导原则:试行》[8]制定疗效标准,于3个疗程结束后对两组患者的临床疗效进行评价:显效,治疗后临床症状、体征完全消失,肾功能指标恢复如常,血糖改善>75%;有效,治疗后临床症状、体征有明显改善,肾功能、血糖指标改善30%~75%;无效,治疗后临床症状、体征较前未见明显好转,肾功能、血糖指标改善<30%;临床总有效率=(显效病例数+有效病例数)/总病例数×100%。
1.5 统计学方法

2 结果
2.1 临床疗效
3个疗程结束后,治疗组患者的临床总有效率为91.7%,明显高于对照组(80.0%),差异有统计学意义(P<0.05),见表2。

表2 两组患者临床疗效比较[例(%)]Tab 2 Comparison of clinical efficacy between two groups [cases (%)]
2.2 中医证候积分变化
治疗前,两组患者中医证候积分的差异无统计学意义(P>0.05)。治疗8、16和24周后,两组患者的中医证候积分均低于本组治疗前;与对照组比较,治疗组患者治疗8、16和24周后的中医证候积分降低更明显,差异均有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后中医证候积分比较分)Tab 3 Comparison of traditional Chinese medicine syndrome score between two groups before and after
2.3 肾功能指标水平
治疗前,两组患者SCr、BUN、24 h UPR和eGFR水平的差异均无统计学意义(P>0.05)。治疗8、16和24周后,两组患者的SCr、BUN和24 h UPR水平均明显低于治疗前,eGFR水平较前明显升高(P<0.05);与对照组比较,治疗组患者治疗8、16和24周后的SCr、BUN和24 h UPR水平降低更明显,eGFR水平升高更明显(P<0.05),差异均有统计学意义,见表4。

表4 两组患者治疗前后肾功能指标水平比较Tab 4 Comparison of renal function indicators between two groups before and after treatment
2.4 血糖水平
治疗前,两组患者FBG、2 hBG和HbAlc水平的差异均无统计学意义(P>0.05)。治疗8、16和24周后,两组患者的FBG、2 hBG和HbAlc水平均明显低于治疗前(P<0.05);与对照组比较,治疗组患者治疗8、16和24周后的FBG、2 hBG和HbAlc水平降低更明显(P<0.05),差异均有统计学意义,见表5。
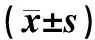
表5 两组患者治疗前后血糖水平比较Tab 5 Comparison of blood glucose levels between two groups before and after treatment
2.5 血脂水平
治疗前,两组患者TC、TG和LDL-C水平的差异均无统计学意义(P>0.05)。治疗8、16和24周后,两组患者的TC、TG和LDL-C水平均明显低于治疗前(P<0.05);与对照组比较,治疗组患者治疗8、16和24周后的TC、TG和LDL-C水平降低更明显(P<0.05),差异均有统计学意义,见表6。
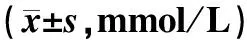
表6 两组患者治疗前后血脂水平比较Tab 6 Comparison of blood lipid levels between two groups before and after treatment
2.6 炎症指标水平变化
治疗前,两组患者血清IL-6、TNF-α和TGF-β1水平的差异均无统计学意义(P>0.05)。与治疗前相比,两组患者治疗8、16和24周后的IL-6、TNF-α和TGF-β1水平均明显降低(P<0.05);治疗组患者治疗8、16和24周后的IL-6、TNF-α和TGF-β1水平明显低于对照组(P<0.05),差异均有统计学意义,见表7。
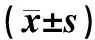
表7 两组患者治疗前后炎症指标水平比较Tab 7 Comparison of inflammatory indicators between two groups before and after treatment
2.7 不良反应发生情况
疗程期间,治疗组患者发生恶心呕吐、便秘各1例,皮肤瘙痒2例,不良反应总发生率为6.7%(4/60);对照组患者发生恶心呕吐2例,皮肤瘙痒、便秘各3例,不良反应总发生率为13.3%(8/60)。治疗组患者的不良反应总发生率明显低于对照组,差异有统计学意义(χ2=10.102,P<0.05)。
3 讨论
我国糖尿病患病人数高居全球首位,约1.14亿,每年新增病例仍不断攀升,预计2028年患病人数将达到1.49亿[9]。DN为糖尿病患者较为严重的慢性并发症之一,DN患者占糖尿病患者的20%~40%,其中15%~20%的DN患者会发展为终末期肾病[10]。DN以微血管病变进行性加重为特征,目前已取代慢性肾小球肾炎,成为导致终末期肾病及肾衰竭的首要因素[11]。然而,现代医学仍缺乏能够有效抑制其进展的治疗方案,常采用ACEI/血管紧张素Ⅱ受体阻断剂减少尿蛋白、降低舒张压,以延缓病情进展,但药物作用较为局限,且不良反应较多[12]。中医药在DN的临床干预中具有多途径作用的特色优势,可缓解DN症状,控制病情进展,收效良好且安全性高[13]。
DN为中医学“消渴”之变证,消渴病脾肾气阴两虚,湿热、浊毒内聚,迁延日久,湿浊不能及时排出而阻于肾络,肾体为浊所困,使肾功能进一步虚损,发为DN[14]。我院马艳东主任医师认为,DN基本病位在肾之络脉,以“浊郁肾络”为主要病因病机,“浊”既是病理产物又是致病因素,祛浊方可固本扶正。以“祛浊剔浊、清源固本”为其治疗大法,首当以搜剔之品深入肾络,肾络通达则血行气畅,清升浊化,使肾体浊毒从二便而解。祛浊清源汤为基于“浊郁肾络”病理机制而拟定的DN基础方,方药组成参考张仲景的抵挡汤、大黄蛰虫丸等活血化瘀通络方剂,在应用虫类药物等搜剔之品基础上,酌配祛湿化浊药物以达祛浊剔浊、清源固本之效。方中以威灵仙、穿山龙和首乌藤祛风活血,补肾通络;配合水蛭、土鳖虫破血通经,逐瘀剔浊而为君药,使肾络久瘀浊邪得除。红景天、灵芝扶正固本,理气化瘀;晚蚕砂祛湿化浊,活血止痛;三药既助君药化浊之力,又益气固肾,升清降浊而为臣药。三棱、莪术破血消积;土茯苓、车前子利湿祛浊;四药引药入出,使邪有出路而为佐使。现代药理学研究结果表明,威灵仙、穿山龙、首乌藤及水蛭等虫类药均有抗凝、抗血栓和改善肾血流等功效;红景天、灵芝具有降糖、降脂、抗炎和抗氧化等药理活性,可明显改善DN大鼠的肾功能[15-20]。
本研究以临床期DN患者为观察对象,在常规西医治疗基础上加服祛浊清源汤,观察祛浊清源汤对DN的综合疗效及安全性。结果显示,祛浊清源汤治疗3个疗程后,临床总有效率较单纯西医治疗明显提高,同时改善了患者的中医症状。检测治疗前及治疗8、16和24周后的肾功能和血糖指标可见,加用祛浊清源汤治疗不同疗程后,患者的SCr、BUN和24 h UPR等肾功能指标,FBG、2 hBG和HbAlc等血糖指标水平均明显低于单纯西医治疗,eGFR水平则明显提高,提示祛浊清源汤可有效改善临床期DN患者的症状,控制血糖水平,减轻肾损伤并提高肾小球滤过功能,对延缓DN病情具有较好的增效作用。高血脂状态所引发的脂代谢异常可使肾小球处于高灌注、高滤过状态,加剧DN蛋白尿和肾脏损伤[21]。检测治疗前及不同疗程后的血脂指标可见,患者经祛浊清源汤治疗后TC、TG及LDL-C水平均明显下调,提示祛浊清源汤可通过调节DN患者的血脂水平,纠正脂代谢异常,以促进肾功能的修复。目前,DN的发病机制尚未完全明晰,研究结果发现,DN是一种炎症性疾病,而在炎症反应过程中所生成的炎症介质是造成其炎症损伤的关键因素。DN患者持续的糖代谢紊乱状态可促使外周血中IL-6、TNF-α和TGF-β1等炎症因子过度分泌,进而促进炎症巨噬细胞浸润,造成全身微炎症状态。随着炎症的长期发展,刺激细胞外基质不断增多,最终导致肾小球硬化和肾脏纤维化[22-24]。本研究中,DN患者经祛浊清源汤治疗不同疗程后血清IL-6、TNF-α和TGF-β1水平均明显降低,提示祛浊清源汤可有效抑制炎症因子高表达,改善机体炎症状态,减轻肾脏炎症损伤。应用胰激肽原酶可引起皮疹、瘙痒症状及肠胃症状;雷公藤多苷的不良反应主要涉及消化系统,表现为消化道不适,通过联合用药能够减轻其毒性[25-26]。疗程期间,两组均有部分患者出现轻微过敏及消化系统症状,应用祛浊清源汤降低了不良反应发生率,可能与方中土茯苓、车前子等药物的祛湿止痒作用及威灵仙、红景天等补肾益精类中药协调消化系统功能的效果相关。
综上所述,祛浊清源汤用于临床期DN患者,可有效减轻中医证候,纠正糖代谢、脂代谢紊乱状态,改善肾脏炎症损伤,同时减轻不良反应,具有较好的安全性和有效性。

