垂体腺瘤患者Delta 样蛋白1 同源物、母系表达基因3、母系表达基因8 基因表达水平及其临床意义研究
吴炜,刘永亮,王彦,董晓柳,张利,马思伟,张欢,高华,董伟
垂体腺瘤是起源于鞍内垂体前叶的肿瘤,是最常见的颅内肿瘤之一,根据临床症状可分为功能性腺瘤和无功能腺瘤[1],其中功能性腺瘤又可分为生长激素(growth hormone,GH)腺瘤、泌乳素瘤、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)腺瘤。《2022年世界卫生组织垂体腺瘤/垂体神经内分泌肿瘤分类概述》[2]提出了细胞谱系概念,认为垂体腺瘤主要分为PIT1谱系、类固醇激素因子1(steroidogenic factor 1,SF-1)谱系和T盒转录因子19(T-box transcription factor 19,TPIT)谱系。除PIT1起源的泌乳素瘤外,其他功能性腺瘤(GH腺瘤和ACTH腺瘤)的药物治疗效果不佳,因此探讨垂体腺瘤的发生发展机制,对其临床治疗具有重要意义[3]。
Delta样蛋白1同源物(Delta like non-canonical Notch ligand 1,DLK1)/母系表达基因(maternally expressed gene,MEG)3基因座位于14号染色体32.2区域,其包含3个蛋白编码基因(即DLK1、反转录转座子1、脱碘酶3基因)和大量母系表达的长链非编码RNA(long non-coding RNA,lncRNA)(包括lncRNA MEG3和超过50个miRNA的集群)[4]。文献报道,DLK1/MEG3基因座在细胞分化和组织发育中发挥着重要作用,其可参与机体多种病理生理学过程[5]。研究显示,与野生型小鼠相比,过表达DLK1的转基因小鼠垂体GH分泌增加、胰岛素抵抗者占比升高;此外,过表达DLK1基本不影响垂体泌乳素和ACTH的分泌[6]。MEG3和MEG8在不同亚型垂体腺瘤中呈差异表达,二者均具有抑制肿瘤生长的作用[7-8]。本研究旨在分析垂体腺瘤患者DLK1、MEG3、MEG8基因表达水平及其临床意义,以期为垂体腺瘤患者的临床诊疗提供理论依据。
1 对象与方法
1.1 研究对象 选取2015年6月至2019年12月于唐山市人民医院行手术切除的垂体腺瘤患者92例为研究对象。纳入标准:(1)年龄≥18岁;(2)伴有头痛、视力下降、视野缺损等垂体腺瘤的典型临床症状,MRI检查显示T1WI和T2WI低信号,强化明显,经病理检查诊断为垂体腺瘤;(3)原发性肿瘤。排除标准:(1)合并其他肿瘤者;(2)合并严重的呼吸、循环系统疾病者;(3)合并其他类型代谢疾病者;(4)合并认知障碍或精神类疾病者;(5)入院1个月内参与其他临床试验者。本研究获得唐山市人民医院伦理委员会批准(审批号:RMYY-LLKS-2020-013),所有患者或家属签署知情同意书。
1.2 研究方法
1.2.1 一般资料收集 收集患者一般资料,包括性别、年龄、肿瘤体积、肿瘤增殖状态(Ki67指数≥3%为高增殖,<3%为低增殖)、肿瘤侵袭性(Knosp分级Ⅲ~Ⅳ级为侵袭性生长,Knosp分级Ⅰ~Ⅱ级为非侵袭性生长)、病理类型(分为GH腺瘤和无功能腺瘤)。
1.2.2 RT-qPCR法检测肿瘤组织DLK1、MEG3、MEG8、POU类1同源框1(POU class 1 homeobox 1,POU1F1)、类固醇生成因子1(steroidogenic factor 1,SF-1)基因表达水平 RNA抽提试剂盒购自凯杰企业管理(上海)有限公司,反转录试剂盒和实时荧光定量PCR试剂盒购自美国Thermo Fisher Scientific。取10 mg左右肿瘤组织标本,利用一步法提取细胞总RNA,反转录合成cDNA;以cDNA为模板进行实时荧光定量PCR。PCR扩增条件为:50 ℃ 20 min,95 ℃ 10 min、95 ℃10 s、60 ℃ 1 min,共40个循环。引物由北京合生基因科技有限公司合成,引物序列如下:DLK1正向引物为5′-ACGAGTGCTGTACATGACCA-3′,反向引物为5′-GGCTCTCTCTGACTGACACA-3′;MEG3正向引物为5′-TCTTCAAGGAGGTCACGGAC-3′,反向引物为5′-GGACACATCAAATCGCTGCT-3′;MEG8正向引物为5′- GGGCCCTGTTAGTCTGACTT-3′,反向引物为5′-CAAAGTCAGACCCAGGCAAC-3′;POU1F1正向引物为5′-TCCTGACCACACCTTGAGTC-3′,反向引物为5′-GCCTCCCCAACATTTGTCTG-3′;SF-1正向引物为5′- TCTGAGTACCCGGAGCCTTA-3′,反向引物为5′-TGGAGATGAAGGTCTGGTCG-3′;内参GAPDH正向引物为5′-CCAAGGAGTAAGACCCCTGG-3′,反向引物为5′-TGGTTGAGCACAGGGTACTT-3′。采用2-ΔΔCt法计算目标基因表达水平。
1.2.3 免疫组织化学染色检测肿瘤组织GH、PIT1、SF-1表达情况 采用10%中性甲醛固定肿瘤组织,进行梯度乙醇脱水、二甲苯透明、常规石蜡包埋、连续切片(5 μm),将切片置于60 ℃的烤箱烤1 h,梯度脱蜡,抗原修复后采用羊血清封闭30 min,滴加GH、PIT1、SF-1一抗(购自英国Abcam公司),4 ℃孵育过夜,PBS洗3次,加入二抗(购自北京中杉金桥生物技术有限公司)室温孵育1 h,PBS洗3次,采用DAB显色试剂盒(购自北京中杉金桥生物技术有限公司)显色后用自来水冲洗,进行苏木素复染、梯度脱水、二甲苯透明、中性树胶封固,于显微镜下观察染色情况,以细胞内出现棕色和棕褐色染色颗粒为阳性。随机挑选5个高倍(×400)视野,统计阳性细胞数量和细胞总数。结果判断标准:(1)阴性:阳性细胞占比≤1%;(2)弱阳性:1%<阳性细胞占比≤5%;(3)阳性:阳性细胞占比>5%。
1.2.4 ELISA检测血清GH、胰岛素样生长因子1(insulin like growth factor 1,IGF-1)水平 采集患者空腹静脉血0.5 ml,3 000 r/min离心5 min(离心半径13.5 cm),采用移液器取10 μl血清,按照ELISA试剂盒说明书进行操作,检测GH、IGF-1水平。
1.3 统计学方法 采用SPSS 19.0软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验,单向有序分类指标比较采用秩和检验;两变量间的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 92例垂体腺瘤患者中,男63例,女29例;年龄21~75岁,平均(50.7±1.2)岁;肿瘤体积0.04~155.30 cm3,平均(10.80±2.20)cm3;肿瘤高增殖28例,肿瘤低增殖64例;肿瘤侵袭性生长32例,肿瘤非侵袭性生长60例;病理类型:GH腺瘤28例,无功能腺瘤64例;肿瘤组织DLK1、MEG3、MEG8、POU1F1、SF-1基因表达水平分别为(0.077±0.015)、(0.066±0.017)、(0.010±0.002)、(0.331±0.060)、(0.125±0.014);肿瘤组织GH表达情况:阳性25例,弱阳性3例,阴性64例;肿瘤组织PIT1表达情况:阳性27例,弱阳性20例,阴性45例;肿瘤组织SF-1表达情况:阳性63例,弱阳性14例,阴性15例;血清GH水平为(5.0±1.1)ng/ml;血清IGF-1水平为(266.5±31.1)ng/ml。
2.2 GH腺瘤与无功能腺瘤患者一般资料比较 GH腺瘤患者男性占比、年龄低于无功能腺瘤患者,差异有统计学意义(P<0.05);GH腺瘤与无功能腺瘤患者肿瘤体积、肿瘤高增殖者占比、肿瘤侵袭性生长者占比比较,差异无统计学意义(P>0.05),见表1。
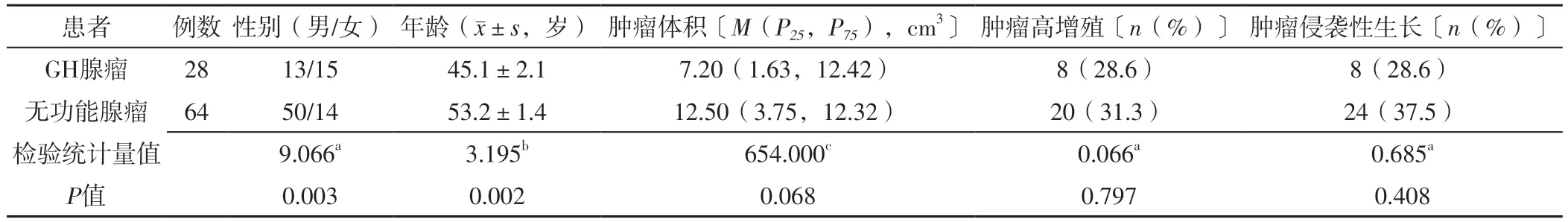
表1 GH腺瘤与无功能腺瘤患者一般资料比较Table 1 Comparison of general information between patients with GH adenomas and non-functioning adenoma
2.3 不同临床特征垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平比较 男性垂体腺瘤患者肿瘤组织DLK1、MEG8基因表达水平低于女性垂体腺瘤患者,差异有统计学意义(P<0.05);男性与女性垂体腺瘤患者肿瘤组织MEG3基因表达水平比较,差异无统计学意义(P>0.05)。年龄≤52岁垂体腺瘤患者肿瘤组织DLK1基因表达水平高于年龄>52岁垂体腺瘤患者,差异有统计学意义(P<0.05);年龄≤52岁与年龄>52岁垂体腺瘤患者肿瘤组织MEG3、MEG8基因表达水平比较,差异无统计学意义(P>0.05)。不同肿瘤体积、肿瘤增殖状态、肿瘤侵袭性垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平比较,差异无统计学意义(P>0.05)。GH腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平高于无功能腺瘤患者,差异有统计学意义(P<0.05),见表2。
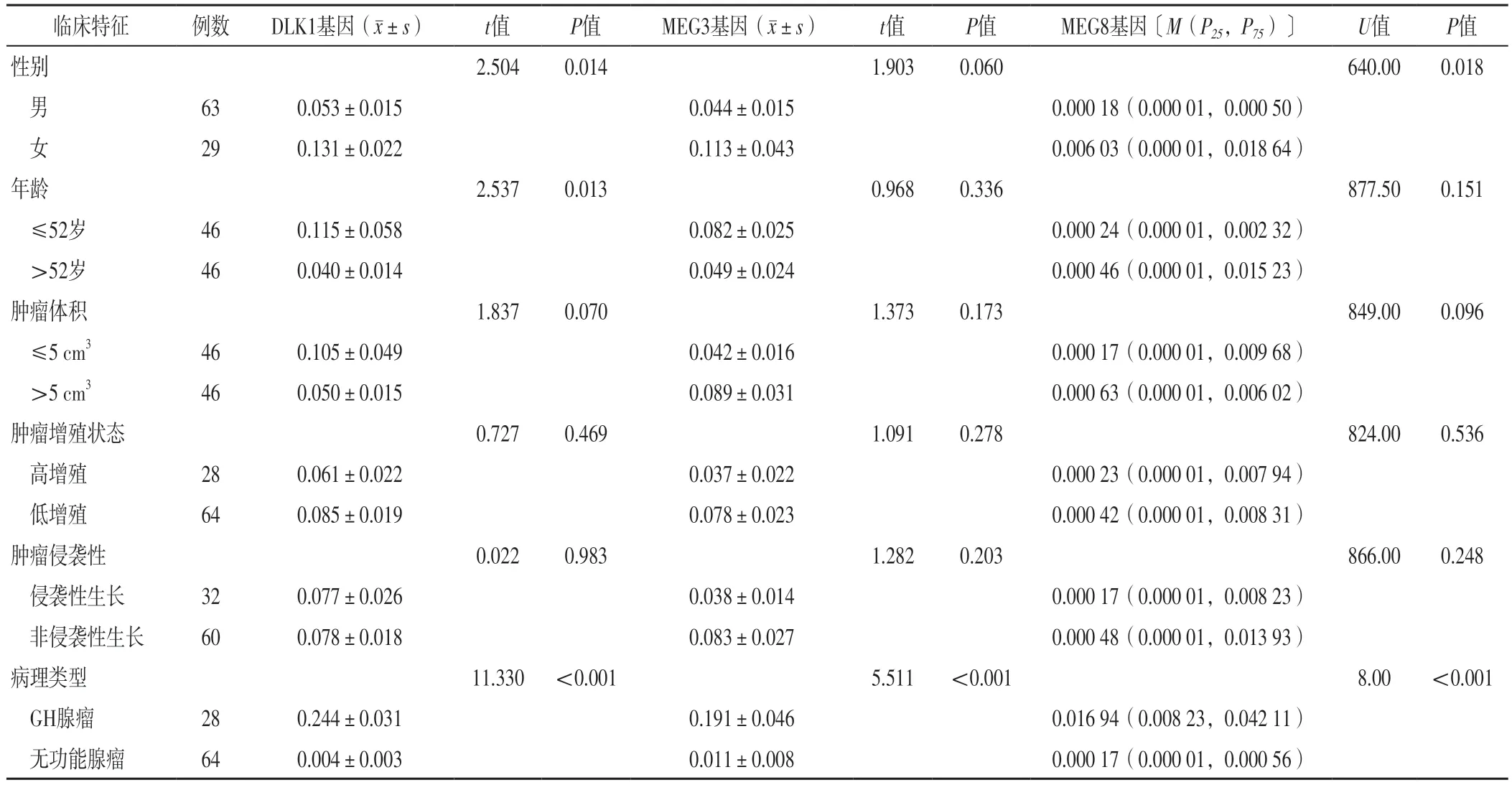
表2 不同临床特征垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平比较Table 2 Comparison of expression levels of DLK1,MEG3,and MEG8 gene in tumor tissues of patients with pituitary adenomas of different clinical characteristics
2.4 垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与肿瘤组织POU1F1、SF-1基因表达水平的相关性 Pearson相关分析结果显示,垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与肿瘤组织POU1F1基因表达水平均呈正相关,与肿瘤组织SF-1基因表达水平均呈负相关(P<0.05),见表3。

表3 垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与肿瘤组织POU1F1、SF-1基因表达水平的相关性Table 3 Correlation between expression levels of DLK1,MEG3,and MEG8 gene in tumor tissue of pituitary adenoma patients and expression levels of POU1F1 and SF-1 gene in tumor tissue
2.5 不同肿瘤组织DLK1、MEG3、MEG8基因表达水平垂体腺瘤患者肿瘤组织GH、PIT1、SF-1表达情况比较 根据肿瘤组织DLK1、MEG3、MEG8基因表达水平的中位数,分别将患者分为DLK1基因高表达组(DLK1基因表达水平≥0.000 15,46例)和DLK1基因低表达组(DLK1基因表达水平<0.000 15,46例)、MEG3基因高表达组(MEG3基因表达水平≥0.000 11,46例)和MEG3基因低表达组(MEG3基因表达水平<0.000 11,46例)、MEG8基因高表达组(MEG8基因表达水平≥0.000 08,46例)和MEG8基因低表达组(MEG8基因表达水平<0.000 08,46例)。DLK1基因高表达组与DLK1基因低表达组、MEG3基因高表达组与MEG3基因低表达组、MEG8基因高表达组与MEG8基因低表达组肿瘤组织GH、PIT1、SF-1表达情况比较,差异有统计学意义(P<0.05)。DLK1基因低表达组肿瘤组织GH、PIT1阳性者占比及SF-1弱阳性、阴性者占比低于DLK1基因高表达组,GH、PIT1阴性者占比及SF-1阳性者占比高于DLK1基因高表达组,差异有统计学意义(P<0.05);MEG3基因低表达组肿瘤组织GH、PIT1阳性者占比及SF-1弱阳性、阴性者占比低于MEG3基因高表达组,GH、PIT1阴性者占比及SF-1阳性者占比高于MEG3基因高表达组,差异有统计学意义(P<0.05);MEG8基因低表达组肿瘤组织GH、PIT1阳性者占比及SF-1弱阳性、阴性者占比低于MEG8基因高表达组,GH、PIT1阴性者占比及SF-1阳性者占比高于MEG8基因高表达组,差异有统计学意义(P<0.05),见表4~6。
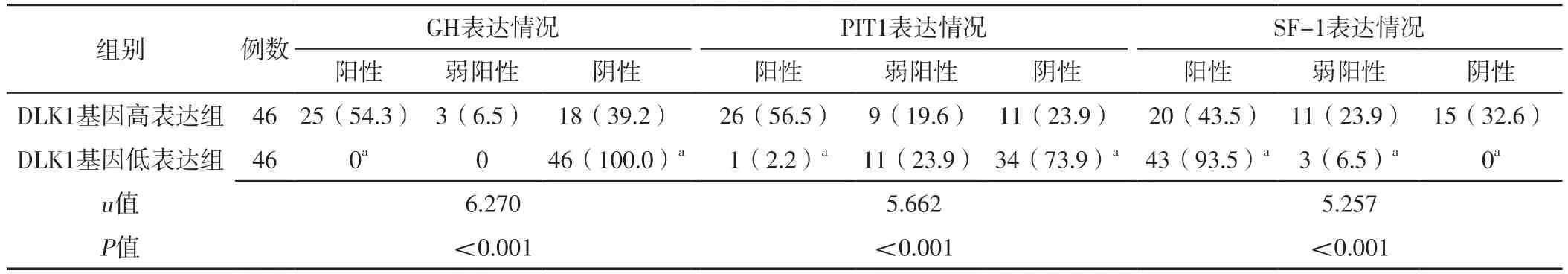
表4 DLK1基因高表达组与DLK1基因低表达组肿瘤组织GH、PIT1、SF-1表达情况比较〔n(%)〕Table 4 Comparison of GH,PIT1,and SF-1 expression in tumor tissues between DLK1 gene high expression group and DLK1 gene low expression group

表5 MEG3基因高表达组与MEG3基因低表达组肿瘤组织GH、PIT1、SF-1表达情况比较〔n(%)〕Table 5 Comparison of GH,PIT1,and SF-1 expression in tumor tissues between MEG3 gene high expression group and MEG3 gene low expression group
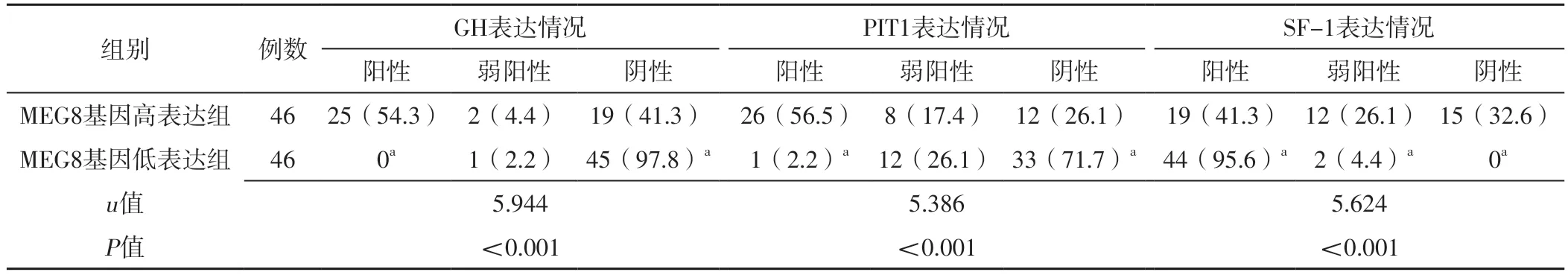
表6 MEG8基因高表达组与MEG8基因低表达组肿瘤组织GH、PIT1、SF-1表达情况比较〔n(%)〕Table 6 Comparison of GH,PIT1,and SF-1 expression in tumor tissues between MEG8 gene high expression group and MEG8 gene low expression group
2.6 GH腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与血清GH、IGF-1水平的相关性 GH腺瘤患者血清GH、IGF-1水平分别为(4.4±1.0)ng/ml、(401.0±45.6)ng/ml。Pearson相关分析结果显示,GH腺瘤患者肿瘤组织DLK1基因表达水平与血清GH水平呈正相关(P<0.05),与血清IGF-1水平无直线相关关系(P>0.05);GH腺瘤患者肿瘤组织MEG3、MEG8基因表达水平与血清GH、IGF-1水平均无直线相关关系(P>0.05),见表7。

表7 GH腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与血清GH、IGF-1水平的相关性Table 7 Correlation between the expression levels of DLK1,MEG3,MEG8 gene in tumor tissue and serum GH and IGF-1 levels in patients with GH adenoma
3 讨论
基因组印迹指根据亲本来源进行单等位基因表达的表观遗传现象,与早期胚胎发育、癌变和肿瘤易感性密切相关,是目前肿瘤研究的热点之一[9]。在不同病理类型垂体腺瘤中,DLK1/MEG3基因座呈差异表达,且DLK1水平与GH水平有关[5]。在无功能腺瘤中,MEG3通过诱导细胞凋亡而发挥抑制肿瘤细胞增殖和侵袭的作用[10]。本研究旨在分析垂体腺瘤患者DLK1、MEG3、MEG8基因表达水平及其临床意义。
本研究结果显示,92 例垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8 基因表达水平分别为(0.077±0.015)、(0.066±0.017)、(0.010±0.002),均低于正常人群[11]。本研究结果还显示,男性垂体腺瘤患者肿瘤组织DLK1、MEG8基因表达水平低于女性垂体腺瘤患者,提示DLK1、MEG8水平升高可能参与女性垂体腺瘤的发生。年龄≤52岁垂体腺瘤患者肿瘤组织DLK1基因表达水平高于年龄>52岁垂体腺瘤患者,提示DLK1基因表达水平可能与年龄有关,其在高龄患者中降低。不同肿瘤体积、肿瘤增殖状态、肿瘤侵袭性垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平比较,差异无统计学意义,提示DLK1、MEG3、MEG8基因表达水平可能与肿瘤体积、增殖状态和侵袭性无关。
《2022年世界卫生组织垂体腺瘤/垂体神经内分泌肿瘤分类概述》[2]提出了细胞谱系概念,将垂体腺瘤定义为垂体神经内分泌肿瘤,指出其主要表现为垂体的良性增生,并根据转录因子水平将其重新分为三类七型。据报道,PIT1可促进垂体细胞向泌乳素细胞、GH细胞和促甲状腺素细胞分化,而SF-1可促进垂体细胞向促性腺激素细胞分化,并与促性腺激素细胞腺瘤有关[2,12]。本研究结果显示,垂体腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平与肿瘤组织POU1F1基因表达水平均呈正相关,与肿瘤组织SF-1基因表达水平均呈负相关;DLK1基因低表达组肿瘤组织PIT1阳性者占比及SF-1弱阳性、阴性者占比低于DLK1基因高表达组,PIT1阴性者占比及SF-1阳性者占比高于DLK1基因高表达组;MEG3基因低表达组肿瘤组织PIT1阳性者占比及SF-1弱阳性、阴性者占比低于MEG3基因高表达组,PIT1阴性者占比及SF-1阳性者占比高于MEG3基因高表达组;MEG8基因低表达组肿瘤组织PIT1阳性者占比及SF-1弱阳性、阴性者占比低于MEG8基因高表达组,PIT1阴性者占比及SF-1阳性者占比高于MEG8基因高表达组;提示DLK1、MEG3、MEG8基因表达水平与垂体腺瘤转录因子的表达有关,即随着DLK1、MEG3、MEG8基因表达水平的增加,转录因子POU1FA表达水平升高,SF-1表达水平降低。本研究结果还显示,GH腺瘤患者肿瘤组织DLK1、MEG3、MEG8基因表达水平高于无功能腺瘤患者,笔者推测DLK1、MEG3、MEG8基因表达水平升高可促进垂体腺瘤细胞向PIT1谱系分化,临床表现为GH腺瘤表型;其降低可促进垂体腺瘤细胞向SF-1谱系分化,临床表现为无功能腺瘤表型。但本研究结果还显示,GH腺瘤患者男性占比、年龄低于无功能腺瘤患者,这可能对本研究结果产生一定影响,尚需要大样本量的研究进一步证实。
2021年2月《垂体协会肢端肥大症诊治指南》[13]更新版发布,其明确指出术后动态监测GH、IGF-1水平有助于了解疾病进展情况[14]。且研究显示,GH-IGF轴中的GH与DLK1存在共定位[15]。本研究结果显示,DLK1基因低表达组、MEG3基因低表达组、MEG8基因低表达组肿瘤组织GH阳性者占比分别低于DLK1基因高表达组、MEG3基因高表达组、MEG8基因高表达组,GH阴性者占比分别高于DLK1基因高表达组、MEG3基因高表达组、MEG8基因高表达组,提示DLK1、MEG3、MEG8基因表达水平升高可能促进垂体腺瘤肿瘤细胞中GH的合成。本研究Pearson相关分析结果显示,GH腺瘤患者肿瘤组织DLK1基因表达水平与血清GH水平呈正相关,与既往研究结果[5]一致;GH腺瘤患者肿瘤组织DLK1基因表达水平与血清IGF-1水平无直线相关关系,GH腺瘤患者肿瘤组织MEG3、MEG8基因表达水平与血清GH、IGF-1水平均无直线相关关系,提示DLK1/MEG3基因座中的DLK1基因是调控GH分泌的关键基因,而MEG3、MEG8基因与GH分泌无关,且三者均对来源于肝脏的IGF-1释放没有影响,推测DLK1可能作为GH腺瘤患者的治疗靶点,这对丰富GH腺瘤患者的治疗选择具有积极意义。
综上所述,垂体腺瘤患者的DLK1、MEG3、MEG8基因表达水平低于正常人群。DLK1、MEG3、MEG8基因表达水平升高可促进垂体腺瘤细胞向PIT1谱系分化,临床表现为GH腺瘤表型;其降低可促进垂体腺瘤细胞向SF-1谱系分化,临床表现为无功能腺瘤表型。DLK1基因是调控GH分泌的关键基因,其可能作为GH腺瘤患者的治疗靶点。由于泌乳素瘤患者常规选择药物治疗且效果较好,ACTH腺瘤为罕见病,临床收集这两类垂体腺瘤的标本非常困难,本研究并未分析泌乳素瘤、ACTH腺瘤患者DLK1、MEG3、MEG8基因表达水平,且本研究样本量较小,因而本研究结论尚需要大样本量的研究进一步证实。
作者贡献:吴炜进行文章的构思与设计,撰写论文;高华进行研究的实施与可行性分析、文章的质量控制及审校;刘永亮、王彦、张欢进行数据收集;张利进行数据整理;董晓柳进行统计学处理;马思伟负责结果的分析与解释;吴炜、高华、董伟进行论文的修订;董伟对文章整体负责、监督管理。
本文无利益冲突。

