磨玻璃结节型肺腺癌的HRCT特征与脏层胸膜侵犯的相关性
习 伟, 张蓓蓓, 杨淑辉, 周中华, 张鹏举
肺癌是全球发病率和死亡率最高的恶性肿瘤之一[1]。近些年,随着高分辨CT(high-resolution computed tomography, HRCT)的广泛应用,越来越多的早期肺癌被检出,尤其又以磨玻璃结节(ground-glass nodule, GGN)表现的肺腺癌最为常见[2]。GGN是指薄层CT肺窗上肺内局灶的密度增高影,不掩盖其内走行的血管及支气管影[3]。脏层胸膜侵犯(visceral pleural invasion,VPI)是非小细胞肺癌(nonsmall cell lung cancers, NSCLC)一个重要的预后不良因素[4-6]。第8版TNM分期中,VPI的出现将使下期肿瘤提升到T2期,5年生存率从86%降至62.7~70%[7]。Okada等[8]研究显示VPI对实性结节有负面影响,而不影响GGN的预后,但也有研究[9]显示GGN中出现VPI是肿瘤复发的高风险因素。目前有关VPI的CT报道绝大多数都是将叶间胸膜与非叶间胸膜作为一个整体研究,而没有单独分析他们各自发生VPI的影像特征[9-11]。本研究主要探讨HRCT下邻近非叶间胸膜的GGN型肺腺癌所引起的胸膜改变与病理上VPI的相关性。
1 对象与方法
1.1 对象 收集2019年1-12月解放军总医院第四医学中心胸外科手术切除直径≤3 cm的GGN(0≤CTR≤0.5)且病理为早期肺腺癌的患者219例,其中男71例,女148例,年龄29~80岁,平均(54.2±9.1)岁。由1名放射科主治医师筛选入组病例,纳入标准:(1)CT上结节最大径≤3 cm的GGN,且实性肿瘤比(consolidation-to-tumor ratio, CTR)≤0.5;(2)结节边缘距非叶间裂胸膜最短垂直距离≤1 cm;(3)术前1个月内在本院行常规CT检查,且有1~1.25 mm薄层图像;(4)术前CT检查前未进行任何放化疗或CT穿刺活检。排除标准:(1)CT上有严重肺气肿和弥漫性间质性肺病;(2)病理记录不完整,未进行弹力纤维染色;(3)病变累及叶间胸膜。本研究经解放军总医院伦理委员会批准(S2022-177-01号)。
1.2 病理诊断 所有切除的肿瘤标本均经10%甲醛溶液固定和苏木精伊红染色(HE),对切片厚度为0.5 cm的所有肿瘤切片和受累胸膜的显微镜标本进行评价。按照Hammer分级标准,以弹力纤维染色切片评价VPI程度:(1)PL0表示肿瘤侵入胸膜下肺实质或脏层胸膜弹力层下的结缔组织;(2)PL1是指肿瘤侵入脏层胸膜弹性层但未侵透脏层胸膜表面;(3)PL2是指肿瘤侵透脏层胸膜表面,但未侵及壁层胸膜;(4)PL3表示肿瘤侵犯壁层胸膜或胸壁。PL1和PL2代表VPI侵犯。本研究中发生VPI的病例内84例PL1,1例PL2。
1.3 CT检查与征象分析 采用Philips iCT 256或GE Optima 64排螺旋CT扫描仪进行常规胸部CT检查,扫描参数:管电压120 kV,螺距0.993,矩阵768×768,扫描层厚5 mm,重建层厚1 mm或1.25 mm,肺窗(窗宽1500 HU,窗位600 HU);纵隔窗(窗宽400 HU,窗位40 HU)。所有患者仰卧位充分吸气,扫描范围为胸廓入口水平至肋膈角下水平。将重建的薄层图像发送到图像存档和通信系统。
由2名15年以上从事胸部影像诊断的放射科医师利用计算机终端阅片,在不知病理结果的情况下,对薄层及重建图像进行分析,如果出现分歧,二人会进行讨论并达成共识。评估病变的直径、CT值、GGN类型、病变胸膜关系(relation of the lesion to the adjacent pleura, RLP)。直径是取结节最大截面上最长径及与其垂直的最大短径之和的平均值。CT值是选择最大横断面和上下相邻层面,测量范围尽可能包括整个结节,但尽量避开血管、支气管及较大含气腔隙,取3次测量的平均值。GGN类型是根据结节内是否含有实性成分分为纯磨玻璃结节(pure GGN, pGGN)和混合磨玻璃结节(mixed GGN, mGGN)。RLP分为5种类型:(1)Ⅰ型,病变与胸膜不接触;(2)Ⅱ型,病变与胸膜有1条或多条细线影相连,伴或不伴胸膜端尖角状突起;(3)Ⅲ型,病变胸膜侧喇叭状胸膜凹陷,窄颈与病变相连;(4)Ⅳ型,病变宽基底与胸膜接触,不伴胸膜凹陷、移位;(5)Ⅴ型,病变宽基底与胸膜接触,并伴有胸膜凹陷、移位。当同一病变存在多种胸膜征象类型时,记录最高等级。

2 结 果
2.1 肺腺癌病理亚型及分组情况 共纳入219例GGN型肺腺癌,组织学类型包括3例不典型腺瘤增生(atypical adenomatous hyperplasia, AAH)、3例原位腺癌(adenocarcinoma in situ, AIS)、44例微浸润腺癌(minimally invasive adenocarcinoma, MIA)、112例贴壁为主型腺癌(lepidic predominant adenocarcinoma,LPA)、50例腺泡为主型腺癌(acinar predominant adenocarcinoma, APA)、7例乳头为主型腺癌(papillary predominant adenocarcinoma, PPA)。85例GGN发生VPI,发生率为 38.8%,纳入VPI(+)组;134例未发生VPI,纳入VPI(-)组。
2.2 肺腺癌VPI发生单因素分析 患者的性别、年龄、病变的位置在两组的比较中差异无统计学意义(P>0.05)。结节直径、CT值、GGN类型、RLP在两组的比较中差异有统计学意义(P<0.05)。VPI(+)组中病变直径更大、CT值更高、mGGN更多见(表1)。
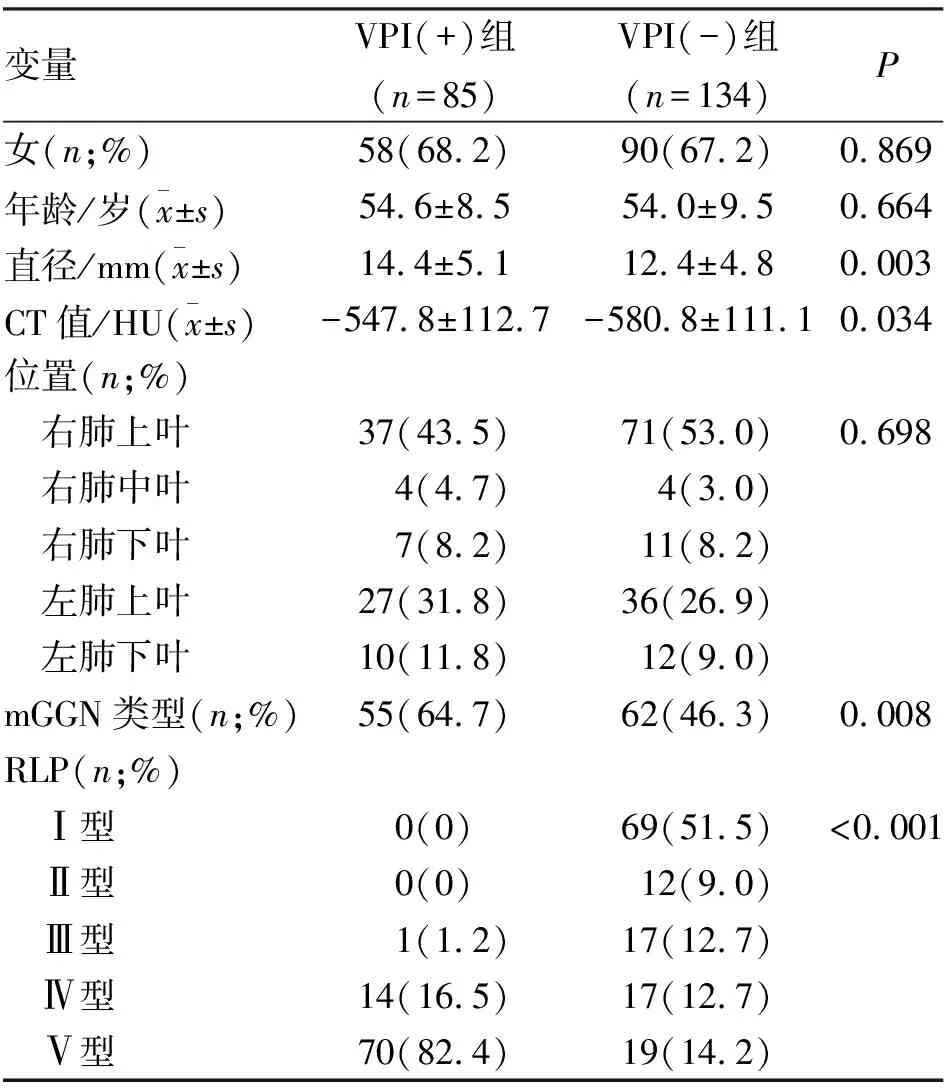
表1 两组肺腺癌临床病理资料和CT征象分析
2.3 肺腺癌VPI发生Logistic回归分析 对单因素分析中有意义的直径、CT值、GGN类型、RLP变量进一步多因素分析,结果显示RLP中Ⅳ型和Ⅴ型是预测VPI的独立危险因素[P<0.001,OR=72.449,95%CI(8.743~600.333);P=0.003,OR=4.576,95%CI(1.688~12.409)]。观察者间RLP有高度的一致性(κ=0.919,P<0.001)。
3 讨 论
VPI与淋巴结转移密切相关,对NSCLC患者预后起到负面作用[7]。脏层胸膜内富含淋巴、血管,在肺表面形成一个相互交流的网络,这个网络穿透到肺实质,连接到支气管淋巴管,引流到各种肺门淋巴结[12]。目前VPI的诊断主要依赖于活检或者手术标本的病理弹力纤维染色检测和免疫组化,这些方法需要术后等待较长的时间,无法在术中快速病理中实现确诊,无法指导手术的即时决策[13,14]。鉴于VPI在肺腺癌精准诊治中的重要地位,通过术前HRCT评估GGN的VPI情况对早期肺腺癌精准诊治和手术方案的确定有重要的指导意义。
据报道,淋巴结阴性的3 cm GGN的VPI发生率为8.9%~25.6%[9,10,15],本研究VPI发生率(38.8%)高于之前报道,推测一是本研究选择的GGN均距胸膜不超过10 mm,病变胸膜距离越近,VPI的可能性越大;二是所有病例都有弹力纤维染色的病理结果。本研究病变与胸膜关系Ⅰ型和Ⅱ型中所有病变不发生VPI,同样在Yang等[16]研究的GGN中这两种类型也不发生VPI。Kim等[9]研究显示即使实性肺癌,不与胸膜接触也不发生VPI。然而在Qi等[17]的研究中这两型却存在VPI(9.5%;37.9%),考虑这与其研究的是5 mm层厚图像、容积效应较重有关,而本研究是1~1.25 mm薄层图像,薄层图像更有利于VPI的诊断。
既往研究表明,胸膜凹陷征(pleural indentation, PI)是预测胸膜侵犯的危险因素,最早由Simon在1962年发现,随后由Rigler在1965年全面描述[9, 16]。PI是由于肺的小叶间隔增厚而从病变表面延伸至胸膜表面的一条或多条线状影,胸膜向内凹陷呈三角形或喇叭状突起,其主要病理基础为肿瘤内纤维组织增生和瘢痕形成产生牵拉,收缩力通过肺的纤维支架结构传导至脏层胸膜从而引起凹陷[18,19]。本研究中Ⅲ型和Ⅴ型有典型的PI,Ⅴ型明显较Ⅲ型更易发生VPI(78.7%vs.5.6%),考虑Ⅴ型中病变与胸膜宽基底接触的同时出现PI,而Ⅲ型中病变与胸膜接触面积小,PI仅以窄颈与病变相连,接触面越大越容易发生VPI,符合Ebara等[20]研究得出的结论。Zhao等[10]研究的GGN中将有PI肿瘤归为一组,得出VPI的发生率为38.1%,介于本研究Ⅲ型和Ⅴ型之间是合理的。Kim等[9]对GGN的研究中同样将PI分成两组,两组VPI的发生率分别为3.4%、22%,前组的结果与本研究中Ⅲ型接近,但后组预测VPI的能力明显低于本研究Ⅴ型。推测一是与研究图像的层厚有关,Kim选择的CT图像层厚范围宽于本研究,分别为1~3 mm、1~1.25 mm,厚层图像的容积效应会降低阳性征象的显示;二是研究对象有所差别,Kim将叶间胸膜与非叶间胸膜作为一个整体来研究,而本研究局限于非叶间胸膜的VPI。非叶间胸膜是单层脏层胸膜,而叶间胸膜是双层脏层胸膜组成,解剖上的差异可能使VPI在影像上存在差异。Yang等[16]研究也证实非叶间胸膜和叶间胸膜在发生VPI时的胸膜改变是不同的。有趣的是,89例Ⅴ型病例中尚有19例显示VPI阴性,提示了Ⅴ型RLP与VPI并不是绝对共存关系。既往研究中胸膜附着型(pleural attachment, PA)在以往VPI的发生率为3.8%~25.5%[9,15,17],低于本研究中Ⅳ型VPI的发生率(45.2%),推测这与本研究选择图像层厚更薄,空间分辨率更高有关,也与研究的非叶间胸膜远较叶间胸膜更不容易发生移位有关。多因素分析显示Ⅳ型和Ⅴ型是VPI的独立预测因素,两型中病变均与胸膜宽基底接触,随着与胸膜接触面积增大,接触面肿瘤细胞不断叠加,脏层胸膜弹力纤维层解剖结构出现重叠、皱缩和破坏,伴成纤维细胞增生而形成VPI。
既往研究证实, 直径、CT值是预测肿瘤浸润性的危险因素[2,6,21]。本研究中直径、CT值在单因素分析中差异具有统计学意义,VPI(+)组病例直径、CT值明显大于VPI(-)组,但两组的数据重叠较多,且病变距胸膜距离远近也是VPI发生的重要因素,因此多因素分析中不能作为预测VPI的独立危险因素。mGGN中VPI的发生率明显高于pGGN(47%vs.29.4%),符合浸润性腺癌更多见于mGGN的看法,但结节内浸润部分距胸膜的距离可能影响VPI的发生,因此不能作为VPI的独立预测因素。一些研究认为pGGN中不发生VPI[9, 15],出现此类情况推测与研究样本数量和研究方式不同有关。pGGN通常被认为侵袭性较低,但以往研究表明浸润性肺腺癌也可以表现为pGGN[22,23],所以pGGN中出现VPI是合理的。有趣的是,本研究GGN中胸膜侵犯主要是PL1级,仅1例达到PL2级,Zhao等[10]报道的GGN中也很少出现PL2级VPI,但在Ebara等[20]研究3 cm以下实性结节中PL2、PL3级胸膜侵犯均可出现,可见GGN的侵袭力明显弱于实性结节。
综上所述,HRCT下RLP对GGN型肺腺癌VPI的发生具有一定的预测价值。Ⅰ~Ⅲ型RLP中病变与胸膜不接触或接触范围小,VPI发生率较低;Ⅳ~Ⅴ型中病变与胸膜宽基底接触,VPI发生率较高,尤其Ⅴ型中伴有胸膜凹陷征,VPI更容易发生。由此可见,病变与胸膜接触面大对提高VPI的诊断起到至关重要的作用。

