苦荞醋饮的安全性初步研究
张昕 王晨尧 司霞 朱瑞芳 曹妍 冯耀清 韩世范


Abstract Objective:To study whether buckwheat vinegar drink fermented from buckwheat for both medicine and food has acute oral toxicity and subacute oral toxicity,to provide animal test basis for safe food.Methods:In the acute oral toxicity test,the dose group was given 100 times of the recommended intake of the Tartary buckwheat vinegar drink by intragastric administration at a volume of 20 mL/kg,and the control group was given distilled water by gavage.The mice were observed for 14 days after gavage.To record the data on general observation,body weight changes,gross anatomical examination results,and organ coefficients data of the mice.In the 28?day oral toxicity test,the high,medium,and low dose groups were respectively given 100 times,50 times,25 times of the recommended intake of the Tartary buckwheat vinegar drink by intragastric administration at a volume of 10 mL/kg for 28 days continuously,and the control group was given distilled water by gavage.During the experiment,the general observation,body weight change,food intake,and food utilization rate of each group were recorded.At the end of the experiment,hematology examination,blood biochemical examination,gross anatomy examination,organ coefficient measurement,and histopathological examination were performed.Results:The mice did not appear symptoms of poisoning,and no death.Compared with the control group,there was no significant difference in the body weights and organ coefficients of major organs of the mice in the dose group (P>0.05).The rats did not appear symptoms of poisoning,and no death.The WBC of female rats in the low?dose group and the absolute weight of the spleen of male rats in the middle?dose group were significantly different from those in the control group (P<0.05), but they were all within the normal range,so they had no clinical significance.There was no significant difference in other indicators compared with the control group (P>0.05).Conclusion:This study proves that the Tartary buckwheat vinegar drink has no acute oral toxicity and subacute oral toxicity,and it is a safe and non?toxic food.
Keywords tartary buckwheat vinegar drink; acute oral toxicity test; 28?day oral toxicity test; safety; medicinal and edible substance
摘要 目的:研究药食两用物质苦荞发酵而成的苦荞醋饮有无急性经口毒性和亚急性经口毒性,为安全的食品提供动物实验依据。方法:在急性经口毒性试验中,剂量组灌胃人体推荐摄入量100倍的苦荞醋饮,对照组灌胃蒸馏水,灌胃体积为20 mL/kg,灌胃后连续观察14 d,记录小鼠的一般情况、体重变化、大体解剖检查结果及脏器系数等数据;在28 d经口毒性试验中,高、中、低剂量组分别灌胃人体推荐摄入量100倍、50倍、25倍的苦荞醋饮,对照组给予蒸馏水,连续灌胃28 d,灌胃体积为10 mL/kg,试验期间记录大鼠的一般情况、体重变化、摄食量和食物利用率等数据,试验结束时进行血液学检查、血生化检查、大体解剖检查及脏器系数的测定、组织病理学观察。结果:小鼠未出现中毒症状,也未出现死亡。与对照组相比,剂量组小鼠的体重、主要器官的脏器系数差异均无统计学意义(P>0.05);大鼠未出现中毒表现,也未出现死亡,低剂量组雌性大鼠的白细胞计数、中剂量组雄性大鼠的脾脏绝对重量与对照组比较差异有统计学意义(P<0.05),但均在正常范围内,无临床意义,其余指标与对照组比较差异均无统计学意义(P>0.05)。结论:苦荞醋饮无急性经口毒性和亚急性经口毒性,是安全、无毒的食品。
关键词 苦荞醋饮;急性经口毒性试验;28 d经口毒性试验;安全性;药食两用物质
doi:10.12102/j.issn.1009-6493.2023.07.021
非酒精性脂肪性肝病 (non?alcoholic fatty liver disease,NAFLD)是一种众所周知的慢性肝脏疾病,经检查可发现肝细胞中有大量脂质蓄积[1]。在一份专家共识声明中,国际专家小组提议以“代谢相关脂肪性肝病”(metabolic associated fatty liver disease,MAFLD)代替NAFLD的相关定义[2]。亚太肝脏研究协会(APASL)公布的《代谢相关脂肪性肝病诊断和治疗的临床实践指南》中提到,代谢相关性脂肪性肝病的一线治疗方法的关键在于改变病人不健康的生活习惯(包括减肥、饮食调节和运动锻炼)[3]。饮食干预对于改善代谢相关性脂肪性肝病的效果是显著的,研究证明苦荞醋饮联合沙棘醋饮可以显著改善脂肪肝分级。此外,对部分代谢相关脂肪性肝病病人具有降血压、抗疲劳、解酒、改善便秘、提高睡眠质量和改善颈动脉硬化等功效[4]。该苦荞醋饮是由药食两用物质苦荞和高粱、大麦、豌豆、麸皮等山西老陈醋原材料发酵而成的有特定功效的饮品,富集苦荞黄酮。苦荞黄酮具有降脂[5]、降糖[6]、抗氧化[7]、抗炎[8]、抗肿瘤[9]、抗心脑血管疾病[10]和抑菌[11]等生物活性作用。苦荞是食用历史悠久的药食两用物质,且经过大量安全性评价证明其属于无毒级物质,但苦荞醋饮是利用发酵技术再加工形成的产品。同时鉴于该苦荞醋饮的属性,即在饮食护理过程中由护士推荐给代谢相关性脂肪肝等慢性病病人,辅助促进病人健康,故其安全性研究至关重要。本研究为横向课题内容,前期通过小样本临床试验研究已证明苦荞醋饮联合沙棘醋饮可以显著改善代谢相关脂肪性肝病病人的脂肪肝分级。为了更加明确苦荞醋饮的食用安全性和具体功效,使代谢相关脂肪性肝病等慢性病病人广泛受益,本课题组拟通过动物实验研究完成对苦荞醋饮的安全性和功效研究。根据对苦荞醋饮的文献调研和专家会议结果,本研究拟通过急性经口毒性试验和28 d经口毒性试验完成对苦荞醋饮安全性的初步研究。
1 材料与方法
1.1 试剂与仪器设备 试剂:蒸馏水、生理盐水、4%多聚甲醛固定液、20%乌拉坦溶液、乙醇、苏木素?伊红染色剂、石蜡。仪器设备:ME203E/02电子天平(梅特勒?托利多仪器上海有限公司);D3024R台式高速冷冻离心机(大龙兴创实验仪器北京股份公司);PE?6800全自动血细胞分析仪(深圳普康医疗器械有限公司);S700轮转式切片机(深圳市瑞沃德生命科技有限公司);Arcadia H全自动包埋机、HI1210摊片机、HI1220烘片机、DM1000 LED电子生物显微镜(Leica公司);S03030丙氨酸氨基转移酶(ALT)测定试剂盒、S03040天门冬氨酸氨基转移酶(AST)测定试剂盒、S03038碱性磷酸酶测定试剂盒、S03043白蛋白测定试剂盒、S03022总蛋白测定试剂盒、S03036尿素测定试剂盒、S03076肌酐测定试剂盒、S03027三酰甘油测定试剂盒、S03042总胆固醇测定试剂盒、S03039葡萄糖测定试剂盒(深圳雷杜生命科学股份有限公司)。
1.2 受试物 苦荞醋饮由山西新醋科技有限公司提供,食品生产许可证编号:SC10314070112628,符合《食品安全国家标准 饮料》(GB 7101—2015)。
1.3 受试动物 急性经口毒性试验共40只ICR小鼠,体质量为18~22 g;28 d经口毒性试验共80只Sprague?Dawley(SD)大鼠,体质量为 50~100 g。雌雄各半,级别为清洁级,均由山西医科大学实验动物中心提供,实验动物合格证号:SCXK(晋)2019?0004。
1.4 实验环境 山西医科大学实验动物中心屏障环境[实验动物设施合格证号:SYXK(晋)2019?0007]。实验环境为无特定病原体(SPF)级,温度为20~24℃,相对湿度为50%~60%,自然采光,12 h昼夜交替。小鼠按组分性别分笼饲养,每笼5只,大鼠按组分性别单笼饲养。動物可自由活动、自由摄食和饮水。
1.5 试验方法 本实验研究参考《食品安全国家标准急性经口毒性试验:GB 15193.3—2014》[12]和《食品安全国家标准28天经口毒性试验:GB 15193.22—2014》[13]。
1.5.1 急性经口毒性试验 将40只清洁级ICR小鼠(雌雄各半)按体质量随机分为剂量组和对照组,每组各20只,雌雄各半,其中剂量组灌胃人体推荐摄入量100倍的苦荞醋饮(利用冷冻浓缩的方法将苦荞醋饮浓缩至原体积的4/7),对照组灌胃蒸馏水。正式实验前空腹6 h(禁食不禁水),苦荞醋饮分2次灌胃给予剂量组小鼠,灌胃时间间隔5 h,灌胃体积为20 mL/kg,灌胃后小鼠需禁食1~2 h。连续观察14 d,记录小鼠的精神状态变化、中毒表现及死亡情况,若小鼠出现明显且持续的痛苦反应或处于濒死状态,则直接处死并进行解剖检查。每天固定时间称量小鼠的体质量,连续称重14d,记录小鼠的体质量变化。实验结束时,解剖各组所有小鼠,观察小鼠的心脏、肝脏、脾脏、肾脏和胃等主要器官有无异常变化,同时对主要器官进行称量并计算脏器系数(脏器系数=脏器重量/动物体重×100%)。
1.5.2 28 d经口毒性试验 将80只清洁级SD大鼠(雌雄各半)按体质量随机分为高、中、低3个剂量组和1个对照组,每组各20只,雌雄各半,其中高剂量组灌胃人体推荐摄入量100倍的苦荞醋饮(浓缩至原体积的2/7),中剂量组灌胃人体推荐摄入量50倍的苦荞醋饮(浓缩至原体积的4/7),低剂量组灌胃人体推荐摄入量25倍的苦荞醋饮,对照组灌胃蒸馏水。连续灌胃28 d,灌胃体积为10 mL/kg。连续观察28 d,记录大鼠的自主活动和行为表现变化、中毒表现及死亡情况,如大鼠体质弱应单独隔离,大鼠出现明显且持续的痛苦反应或处于濒死状态,则直接处死并进行解剖检查。每周固定时间称量大鼠的体质量,记录大鼠的体质量变化。每周固定时间测定3次大鼠摄食量(每周摄食量=本周3 d摄食量之和/3×7),计算食物利用率(食物利用率=同期体质量增长量/同期摄食量×100%)。实验结束后,禁食16 h,麻醉后经腹主动脉采血进行血液学检查和血生化检查,其中血液学检查指标包括红细胞计数(RBC)、白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、红细胞比容(HCT)、淋巴细胞百分比(LYMP%)和中性粒细胞百分比(NEUT%),血生化检查指标包括谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、白蛋白(ALB)、总蛋白(TP)、尿素(UREA)、肌酐(Cr)、三酯甘油(TG)、总胆固醇(TC)和血糖(GLU)。取血后对所有大鼠解剖取心脏、肝脏、脾脏、肾脏和胃等主要脏器,肉眼观察脏器有无异常变化,称重并计算脏器系数。脏器称重后,将高剂量组和对照组大鼠的心脏、肝脏、脾脏、肾脏和胃等主要脏器制成组织切片置于光学显微镜下进行观察。若在高剂量组和对照组中发现病变,则需对中剂量组和低剂量组进行组织病理学检查。
1.6 统计学方法 采用SPSS 28.0软件对所得数据进行统计处理。所有数据均符合正态分布,采用均数±标准差(x±s)表示,通过独立样本t检验对急性经口毒性试验中剂量组和对照组的各项观察指标进行分析;通过单因素方差分析处理28 d经口毒性试验中大鼠体重变化、摄食量、食物利用率、血液学检查结果、血液生化学检查结果和脏器系数等数据,进一步进行事后多重比较(Dunnett?t检验),分析各剂量组与对照组之间差异是否有统计学意义。以P<0.05为差异有统计学意义。
2 结果
2.1 急性经口毒性试验
2.1.1 一般情况 在14 d实验期间,各组小鼠精神状态良好,未出现中毒症状,也未出现死亡。
2.1.2 体质量变化 剂量组小鼠生长发育状况均良好,两组体重比较差异无统计学意义(P>0.05)。见表1。
2.1.3 大体解剖检查及脏器系数 实验结束时,肉眼观察小鼠心脏、肝脏、脾脏、肾脏和胃等主要器官未见异常;同时,剂量组主要器官的脏器系数和对照组比较差异无统计学意义(P>0.05)。见表2和表3。
2.2 28 d经口毒性实验
2.2.1 一般情况 实验期间,各组大鼠自主活動和行为表现均正常,未出现中毒症状,也未出现死亡。
2.2.2 体质量变化 各剂量组大鼠生长发育状况均良好,两组体重比较差异无统计学意义(P>0.05)。见表4和表5。
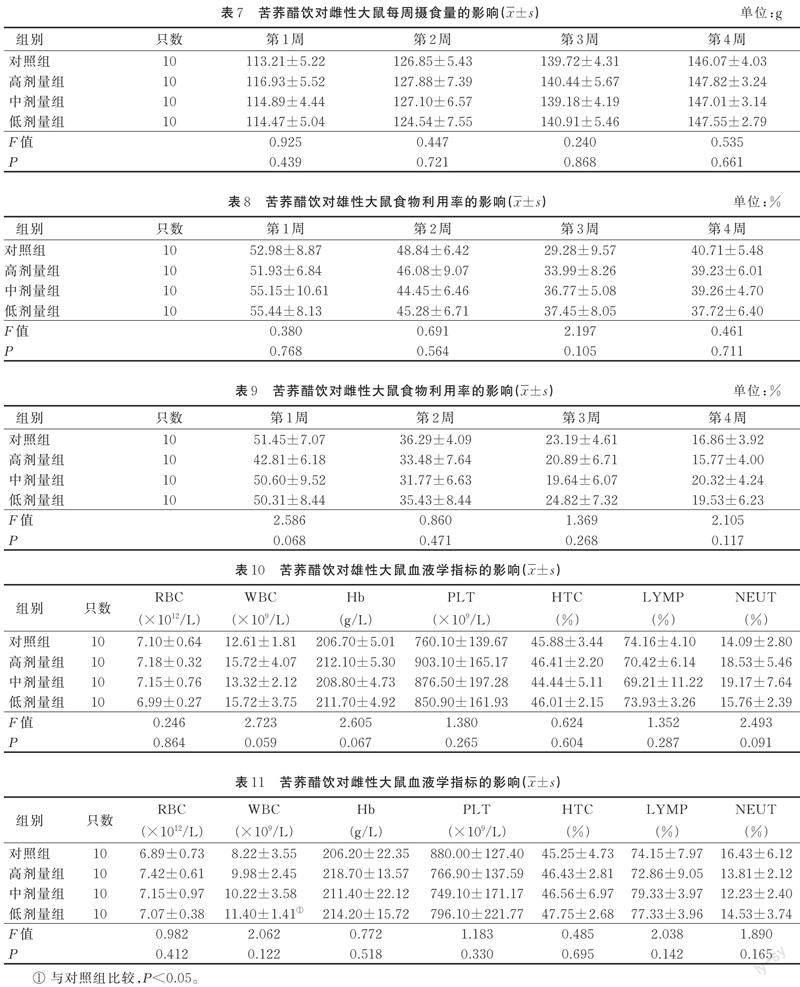
2.2.3 摄食量和食物利用率 各剂量组的摄食量与对照组相比差异无统计学意义(P>0.05)。见表6和表7。各剂量组的食物利用率与对照组比较,差异无统计学意义(P>0.05)。见表8和表9。
2.2.4 血液学检查 与对照组相比,低剂量组雌性大鼠的白细胞计数高于对照组,差异有统计学意义(P<0.05),但仍在正常范围(5.2~17.8)×109/L[14]内,故无临床意义,其余各剂量组的血液学指标与对照组相比差异均无统计学意义(P>0.05)。见表10和表11。
2.2.5 血生化指标检查 与对照组相比,各剂量组的肝功能生化指标、肾功能及其他生化指标比较差异均无统计学意义(P>0.05)。见表12~表15。
2.2.6 大体解剖检查及脏器系数的测定 实验结束时,肉眼观察大鼠心脏、肝脏、脾脏、肾脏和胃等主要器官未见异常,同时,与对照组相比,中剂量组雄性大鼠的脾脏绝对重量偏低,差异有统计学意义(P<0.05),但仍在正常范围(0.31~0.78 g)[15]内,故无临床意义,其余各剂量组脏器绝对重量、脏器系数与对照组相比差异均无统计学意义(P>0.05)。见表16和表17。
2.2.7 组织病理学检查 高剂量组的心脏、肝脏、脾脏、肾脏和胃等主要脏器未见异常。检查结果显示,心内膜和心外膜无增生,无炎症细胞浸润,心肌间质未见炎症细胞浸润,心肌细胞未见变性及坏死;肝脏被膜完整光滑无增厚,肝小叶、汇管区结构完整清晰,肝细胞排列有序,未见肝细胞变性和肝小叶坏死,汇管区无胆管增生,肝间质未见炎症细胞浸润和纤维组织增生;脾脏被膜完整光滑无增厚,可见清晰的红髓和白髓,脾脏小梁未见异常,脾窦未见充血扩张;肾脏被膜完整光滑无增厚,肾小球和肾小管结构正常,细胞形态正常,肾小管未见管型,肾间质无炎症细胞浸润;胃黏膜无炎症细胞浸润,无渗出,无肠上皮化生,胃壁未见出血和溃疡,胃黏膜上皮细胞无变性及坏死,胃黏膜下层未见充血水肿,胃黏膜腺体未见增生肥大及萎缩。
3 讨论
3.1 急性经口毒性实验 急性经口毒性是指受试动物1次或24 h内多次经口接触受试物后,在较短时间内出现的毒性作用,是初步判断一个物质是否具有毒性,以及粗略估计毒性强度的最基本的试验。体质量变化和脏器系数变化是毒性试验中的重要指标。正常情况下受试动物体质量随年龄逐步增长,当受试物影响受试动物对食物的吸收和利用、损伤动物脏器或导致腹水时,动物体质量会迅速增加;当受试物引起受试动物的食欲下降或消化功能减弱、影响动物对食物和水的吸收和利用或损伤动物脏器时,动物体质量则会增长缓慢甚至减轻[16]。脏器系数能够客观反映动物器官重量的变化,方便在不同体质量变化的动物间进行比较,当脏器出现出血、充血、水肿、增生和肿大等病理改变时,脏器重量可能会增加;当脏器出现萎缩、脱水、坏死和腐坏等病理改变时,脏器重量则会减轻[17]。
根据苦荞醋饮的急性经口毒性试验结果,人体推荐摄入量100倍的苦荞醋饮未对小鼠产生毒性作用,未导致小鼠死亡,未对小鼠的体质量产生不良影响,同时未影响小鼠主要脏器的生长发育。以上结果证明苦荞醋饮无急性经口毒性,并为下一阶段28 d经口毒性试验的剂量浓度和毒性检测指标的选择提供了参考依据。
3.2 28 d经口毒性试验 28 d经口毒性试验是指受试动物连续28 d经口接触受试物后所引起的中毒效应,该试验是在急性毒性试验基础上进行的一项安全性评价试验。体质量几乎是开展各种动物实验中都需要测量的一项基础指标,除了可以依据体质量指标计算染毒或给药剂量,体质量还是一项客观、直接的毒性评价指标,可根据体质量变化判断是否产生了毒性效应[18]。摄食量和食物利用率可反映受试动物的食欲以及对食物的消化、吸收、利用情况。血常规和血生化指标是判断受试物有无对受试动物血液产生毒性效应的重要指标,并可作为外推于人的重要依据[19]。其中血常规检查主要检测血小板、红细胞和白细胞是否存在量和质的变化,当这三者发生改变后,可能会引起全身各个器官相应生理功能的变化[20]。对于肝功能指标,常以ALT、AST作为肝损伤的指标,可反映肝损伤、脂肪肝或氧化应激等病理变化[21];对于肾功能指标,反映肾小球滤过功能的指标包括尿素和血肌酐,故可通过其水平变化判断肾代谢功能[22]。此外,脏器系数同样是毒理学试验中的重要指标,可反映动物的生理状态变化[23]。组织病理学检查可明显发现病变组织的具体异常情况,提供病理学证据。
根据苦荞醋饮的28 d经口毒性试验结果,人体推荐摄入量100倍、50倍、25倍的苦荞醋饮未对大鼠产生毒性效应,未导致大鼠死亡,未对大鼠的体质量、摄食量和食物利用率、血常規指标、血生化指标产生不良影响,同时未影响大鼠主要脏器的生长发育,对脏器无损害作用。以上结果证明苦荞醋饮无短期毒性效应和毒作用特征,是安全的食品。
4 小结
苦荞醋饮的急性毒性试验和28 d经口毒性试验结果说明苦荞醋饮未对受试动物产生毒性效应,初步验证苦荞醋饮无急性经口毒性和亚急性经口毒性,是安全无毒的食品,可为本课题组后续进行关于苦荞醋饮的大样本临床试验研究的伦理审查提供参考资料。由于受时间、人力及经费等因素限制,本研究目前进行了苦荞醋饮的急性经口毒性试验和28 d经口毒性试验2项试验,后续可继续进行苦荞醋饮的遗传毒性试验、90 d经口毒性试验、致畸试验等毒性研究,为苦荞醋饮的安全性验证提供更强有力的证据。
参考文献:
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.非酒精性脂肪性肝病防治指南(2018更新版)[J].中华肝脏病杂志,2018,26(3):195-203.
Chinese Society of Hepatology Fatty Liver and Alcoholic Liver Disease Group,Chinese Medical Association Fatty Liver Disease Expert Committee.Guidelines for prevention and treatment of non-alcoholic fatty liver disease[J].Chinese Journal of Hepatology,2018,26(3):195-203.
[2] ESLAM M,NEWSOME P N,SARIN S K,et al.A new definition for metabolic dysfunction-associated fatty liver disease:an international expert consensus statement[J].Journal of Hepatology,2020,73(1):202-209.
[3] ESLAM M,SARIN S K,WONG V W S,et al.The Asian Pacific Association for the study of the liver clinical practice guidelines for the diagnosis and management of metabolic associated fatty liver disease[J].Hepatology International,2020,14(6):889-919.
[4] 刘梦玥.苦荞醋饮、沙棘醋饮组合对代谢相关性脂肪肝患者的作用研究[D].太原:山西医科大学,2021.
LIU M Y.Study on the effect of the combination of Tartary buckwheat vinegar drink and seabuckthorn vinegar drink on patients with metabolic-related fatty liver[D].Taiyuan:Shanxi Medical University,2021.
[5] 郭怡,李毅腾,吴海清,等.苦瓜皂苷与南瓜多糖或苦荞黄酮联合作用对高脂血症大鼠糖脂代谢的影响[J].天津农学院学报,2021,28(2):51-55.
GUO Y,LI Y T,WU H Q,et al.Effect of bitter melon saponins with pumpkin polysaccharides or buckwheat flavones on glucose and lipid metabolism in hyperlipidemia rats[J].Journal of Tianjin Agricultural University,2021,28(2):51-55.
[6] LEE D G,JANG I S,YANG K E,et al.Effect of rutin from Tartary buckwheat sprout on serumglucose-lowering in animal model of type 2 diabetes[J].Acta Pharm,2016,66(2):297-302.
[7] PANCHAL S K,POUDYAL H,BROWN L.Quercetin ameliorates cardiovascular,hepatic,and metabolic changes in diet-induced metabolic syndrome in rats[J].J Nutr,2012,142(6):1026-1032.
[8] LEE M S,SHIN Y,JUNG S,et al.The inhibitory effect of Tartary buckwheat extracts on adipogenesis and inflamm ponse[J].Molecules,2017,22(7):11.
[9] REN W,QIAO Z,WANG H,et al.Tartary buckwheat flavonoid activates caspase 3 and induces HL-60 cell apoptosis[J].Methods & Findings in Experimental & Clinical Pharmacology,2001,23(8):427-432.
[10] HOU Z,HU Y,YANG X,et al.Antihypertensive effects of Tartary buckwheat flavonoids by improvement of vascular insulin sensitivity in spontaneously hypertensive rats[J].Food Funct,2017,8(11):4217-4228.
[11] 吴萌萌,刘怡,严馨,等.苦荞麸皮黄酮提取物及有效成分的抑菌活性[J].食品与生物技术学报,2021,40(11):77-83.
WU M M,LIU Y,YAN X,et al.Antibacterial activities of flavonoid extracts of Tartary buckwheat bran and its effective components[J].Journal of Food Science and Biotechnology,2021,40(11):77-83.
[12] 国家卫生健康委员会.食品安全国家标准急性经口毒性试验:GB 15193.3—2014[S].北京:中国标准出版社,2015:1.
National Health Commission.National standard for food safety acute transoral toxicity test:GB 15193.3-2014[S].Beijing: Standards Press of China,2015:1.
[13] 国家卫生健康委员会.食品安全国家标准28天经口毒性试验:GB 15193.22—2014[S].北京:中国标准出版社,2015:1.
National Health Commission.National standard for food safety 28-day oral toxicity test:GB 15193.22-2014[S].Beijing:Standards Press of China,2015:1.
[14] 林健,郑丽红,张荣标,等.大鼠血常规正常参考值范围及评价方法的探讨[J].海峡预防医学杂志,2007,13(4):57-58.
LIN J,ZHENG L H,ZHANG R B,et al.Discussion on the reference range and evaluation method of normal blood routine in rats[J].Strait Journal of Preventive Medicine,2007,13(4):57-58.
[15] 樊林花,李丹,樊平花,等.清洁级SD大鼠体重和主要脏器系数正常参考值研究及相关性分析[J].中国卫生检验杂志,2012,22(4):750-752.
FAN L H,LI D,FAN P H,et al.Study and correlation analysis of normal reference range of body weight and the main organs coefficient of clean SD rat[J].Chinese Journal of Health Laboratory Technology,2012,22(4):750-752.
[16] 关爽.杜香提取物的制备及部分毒理药理作用[D].长春:吉林大学,2009.
GUAN S.Preparation of Ledum extract and partial toxicological and pharmacological action[D].Changchun:Jilin University,2009.
[17] 袁本利.药物安全评价中脏器系数的意义及不足[J].中国新药杂志,2003,12(11):960-963.
YUAN B L.The significance and shortcoming of organ/body weight ratio used in drug safety evaluation[J].Chinese New Drugs Journal,2003,12(11):960-963.
[18] 陈巍,侯粉霞,杨慧芳.5周龄至109周龄Wistar大鼠体质量的正常参考值及增长速度[J].实验动物科学,2019,36(6):50-54.
CHEN W,HOU F X,YANG H F.The normal reference value of body weight and the rate of body weight gain in Wistar rats aged from 5 to 109 weeks[J].Laboratory Animal Science,2019,36(6):50-54.
[19] 刘科亮,郑华,高俊,等.2种取血方式下SD大鼠血常规及生化指标变化的探讨[J].预防医学情报杂志,2016,32(4):383-386.
LIU K L,ZHENG H,GAO J,et al.Difference of two blood collecting methods on blood biochemical indicators and blood routine test of SD rats[J].Journal of Preventive Medicine Information,2016,32(4):383-386.
[20] 张宇.血常规检测的临床意义[J].中国医药指南,2012,10(17):390-391.
ZHANG Y.Clinical significance of blood routine test[J].Guide of China Medicine,2012,10(17):390-391.
[21] BEEK J,MHMD M,GEUS E,et al.The genetic architecture of liver enzyme levels:GGT,ALT and AST[J].Behavior Genetics,2013,43(4):329-339.
[22] 张祥.蝙蝠蛾參鹿麦冬胶囊安全性毒理学评价[D].长春:吉林大学,2018.
ZHANG X.A toxicological evaluation on the safety of the compound capsule of ginseng,pilose antler,PHM,and Ophiopogon[D].Changchun:Jilin University,2018.
[23] 曾丽海,郑杰蔚,谢植伟,等.SD大鼠28 d重复剂量经口毒性试验生物学指标实验室历史对照值研究[J].中国职业医学,2021,48(3):247-252.
ZENG L H,ZHENG J W,XIE Z W,et al.Study on the laboratory historical control values of biological indicators in SD rats with 28-day repeated dose oral toxicity tests[J].China Occupational Medicine,2021,48(3):247-252.
(收稿日期:2022-05-11;修回日期:2023-02-20)
(本文编辑 崔晓芳)

