LPS通过促进FGFR1磷酸化诱导肺上皮细胞炎症反应及凋亡*
吴跃明,楼天正,徐俊龙(丽水市人民医院重症医学科,浙江丽水 323000)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症医学领域的常见疾病,革兰阴性杆菌感染是引起ALI/ARDS的主要原因之一。脂多糖(lipopolysaccharide,LPS)是革兰阴性杆菌细胞壁的重要成分,研究证实,LPS作用于肺泡上皮细胞并引起炎症反应及凋亡的过度激活,是导致ALI/ARDS的重要生物学环节[1-2]。LPS刺激肺泡上皮细胞是目前临床上研究ALI及ARDS的常用细胞模型[3-4],研究LPS诱导肺上皮细胞炎症反应及凋亡激活的分子机制有助于深入认识ALI/ARDS的病理生理机制。成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)是一种受体酪氨酸激酶,参与细胞凋亡与增殖、炎症反应、血管生成等生物学环节的调控。有学者通过对肾损害及肝损害的细胞实验证实,磷酸化FGFR1(p-FGFR1)的表达水平在LPS诱导的肾小管上皮细胞损伤模型及肝细胞损伤模型中均明显增加,并进一步证实了FGFR1磷酸化的选择性抑制剂AZD4547可显著减轻LPS诱导的肾小管上皮细胞损伤和肝细胞损伤[5-6]。为深入认识FGFR1在ALI/ARDS中的生物学作用,本研究拟通过在LPS诱导肺上皮细胞炎症反应及凋亡激活的模型中观察FGFR1的表达水平变化,以及FGFR1抑制剂AZD4547对炎症反应及凋亡的调控作用。
1 材料与方法
1.1细胞系、仪器与试剂 人肺泡上皮细胞系Beas-2B购自中国科学院上海生命科学研究院细胞资源中心。LPS、FGFR家族抑制剂AZD4547(美国Sigma公司),细胞裂解液、核蛋白提取试剂盒、CCK8法细胞增殖检测试剂盒、Tunel法细胞凋亡检测试剂盒(上海碧云天生物科技公司),小鼠抗人FGFR1、p-FGFR1、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、切割型半胱氨酸天冬氨酸蛋白水解酶-3(cleaved caspase-3)、p65 NF-κB、核纤层蛋白B(Lamin B)、β微管蛋白(β-Tubulin)单克隆抗体(美国Abcam公司),TNF-α、IL-1β、IL-6 ELISA法试剂盒(上海酶联科技公司)。150i型细胞培养箱(美国Thermo公司),FLX800型酶标仪(美国Bio-tek公司),GenoSens 2000型凝胶成像系统(上海勤翔科学仪器公司)。
1.2方法
1.2.1细胞培养及分组 取生长状态良好的人肺泡上皮细胞系Beas-2B,常规细胞复苏后在含10%胎牛血清的BEGM培养基中贴壁培养,每2天更换1次培养基,当细胞融合度达80%~90%时,用2.5 g/L胰蛋白酶消化90 s,1 000 r/min离心10 min后弃去上清,收集细胞沉淀,按照1∶2比例传代。传代后的细胞根据不同实验目的,接种至不同规格培养板内常规培养,贴壁24 h后进行分组给药。对照组用不含药物的培养基处理,LPS组用含5 mg/L LPS的培养基处理,建立LPS诱导肺上皮细胞炎症反应及凋亡激活的模型,不同浓度的AZD4547组用含5 mg/L LPS及2.5、5.0、10.0 μmol/L AZD4547的培养基处理。每组均在连续给药处理24 h后进行相关指标检测。
1.2.2总蛋白、核蛋白提取 按照1×105个/孔的细胞密度将Beas-2B细胞接种至12孔培养板中,按照1.2.1的方法分组给药,处理24 h后收集细胞,加入预冷的细胞裂解液100 μL,在冰上裂解并提取总蛋白质,采用核蛋白提取试剂盒分离核蛋白,采用BCA法检测蛋白质浓度。根据蛋白质浓度检测结果,取20 μg蛋白质用于Western blot。
1.2.3Western blot检测
1.2.3.1总蛋白中p-FGFR1、Bcl-2、Bax、cleaved caspase-3的检测 配制10% SDS-PAGE分离胶,将总蛋白质样品按200 μg的量进行聚丙烯酰胺凝胶电泳(积层胶采用100 V电压20 min,分离胶采用120 V电压70 min)。电泳结束后在350 mA恒流条件下(100 V、90 min)将蛋白质转移至PVDF膜上。转膜结束后将膜置于50 g/L脱脂牛奶中室温封闭1 h,洗膜3次后将硝酸纤维素膜置于小鼠抗人FGFR1(1∶600稀释)、p-FGFR1(1∶400稀释)、Bcl-2(1∶1 000稀释)、Bax(1∶1 000稀释)、cleaved caspase-3(1∶500稀释)、β-Tubulin(1∶2 000稀释)单克隆抗体,4 ℃温育过夜;次日,洗膜3次后加入辣根过氧化物酶标记的IgG二抗(1∶2 000稀释)室温温育硝酸纤维素膜1 h,在凝胶成像系统中进行化学显影,用Image J软件扫描蛋白质条带的灰度值,以β-Tubulin为内参照,按照目标蛋白灰度值/β-Tubulin灰度值计算FGFR1、p-FGFR1、Bcl-2、Bax、cleaved caspase-3的表达水平。每组重复4次。
1.2.3.2核蛋白中p65 NF-κB表达的检测 配制10% SDS-PAGE分离胶,将核蛋白样品按200 μg的量进行聚丙烯酰胺凝胶电泳、电转至硝酸纤维素膜,电泳、电转、封闭、洗膜条件同上。将硝酸纤维素膜置于小鼠抗人p65 NF-κB(1∶1 000稀释)、Lamin B(1∶3 000稀释)单克隆抗体过夜,次日,洗膜3次后加入辣根过氧化物酶标记的IgG二抗(1∶2 000稀释)室温温育硝酸纤维素膜1 h,在凝胶成像系统中进行化学显影,用Image J软件扫描蛋白质条带的灰度值,以Lamin B为内参照,按照p65 NF-κB灰度值/Lamin B灰度值计算p65 NF-κB的表达水平。每组重复4次。
1.2.4CCK8法检测细胞增殖能力 按照5×103个/孔的细胞密度将Beas-2B细胞接种至96孔培养板中,每孔体积100 μL,贴壁培养24 h后按照1.2.1的方法分组给药,处理24 h后在每个培养孔中加入10 μL CCK8试剂,继续培养4 h,用FLX800型酶标仪检测各个培养孔450 nm波长的吸光度(A450 nm)值。每组重复4次。
1.2.5Tunel法检测细胞凋亡 按照5×104个/孔的密度将Beas-2B细胞接种至12孔培养板中,每孔体积0.5 mL,贴壁培养24 h后按照1.2.1的方法分组给药,处理24 h后弃去培养基,用4%多聚甲醛固定细胞2 h,按照Tunel试剂盒说明书进行细胞凋亡率检测,用抗荧光猝灭封片液封片后在显微镜下随机观察3个高倍视野,对视野内Tunel阳性细胞和DAPI阳性细胞进行计数,计算两者比值即为细胞凋亡率。每组重复4次。
1.2.6ELISA法检测细胞因子含量 按照105个/孔的细胞密度将Beas-2B细胞接种至12孔培养板中,每孔体积1.0 mL,贴壁培养24 h后按照1.2.1的方法分组给药,处理24 h后收集培养基,按照TNF-α、IL-1β、IL-6 ELISA法试剂盒及FLX800型酶标仪说明书操作检测TNF-α、IL-1β、IL-6的浓度;提取细胞总蛋白,采用BCA法检测蛋白质浓度。计算培养基细胞因子浓度/细胞总蛋白浓度的比值作为细胞因子的含量。每组重复4次。

2 结果
2.1western blot检测各组p-FGFR1的表达水平 对照组、LPS组以及2.5、5、10 μmol/L AZD4547组Beas-2B细胞中p-FGFR1的表达水平分别为0.29±0.06、1.05±0.12、0.86±0.07、0.67±0.05和0.44±0.06,各组间差异有统计学意义(F=65.083,P<0.05)。进一步进行组间两两比较结果表明,LPS组Beas-2B细胞中p-FGFR1的表达水平显著高于对照组(t=11.329,P<0.05);而2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞中p-FGFR1的表达水平低于LPS组(t分别为2.735、5.846、9.690,P<0.05)。见图1。

图1 Western blot检测各组p-FGFR1的表达水平
2.2CCK8法检测各组细胞增殖能力 对照组、LPS组以及2.5、5、10 μmol/L AZD4547组Beas-2B细胞A450 nm值分别为1.05±0.11、0.36±0.05、0.55±0.06、0.72±0.06和0.93±0.10,各组间差异有统计学意义(F=45.012,P<0.05)。进一步进行组间两两比较结果表明,LPS组显著低于对照组(t=11.421,P<0.05);而2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞的A450 nm水平显著高于LPS组(t分别为8.111、9.218、10.197,P<0.05)。
2.3Tunel法检测各组的细胞凋亡率 对照组、LPS组以及2.5、5、10 μmol/L AZD4547组Beas-2B细胞凋亡率(%)分别为5.41±0.72、29.41±5.21、20.12±3.21、13.22±1.94、8.48±0.94,各组间差异有统计学意义(F=43.527,P<0.05)。进一步进行组间两两比较结果表明,LPS组Beas-2B细胞的凋亡率高于对照组(t=9.126,P<0.05);而2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞的凋亡率低于LPS组(t分别为3.036、5.824、7.907,P<0.05)。见图2。
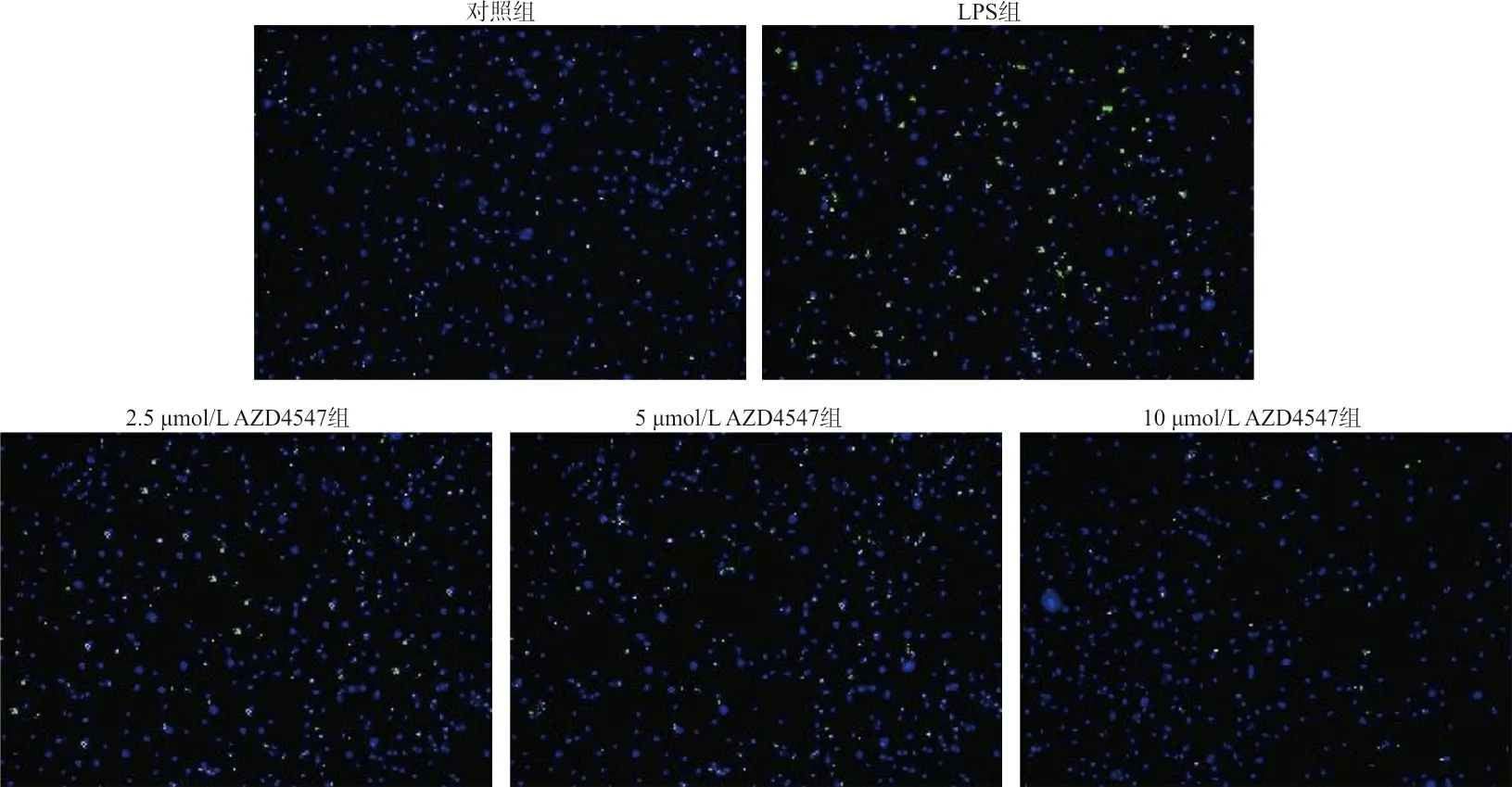
图2 Tunel法检测对照组、LPS组、AZD4547组的细胞凋亡率
2.4Western blot 检测各组凋亡蛋白的表达 LPS组Beas-2B细胞总蛋白中Bax、cleaved caspase-3水平显著高于对照组,而Bcl-2水平低于对照组(P<0.05);此外,2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞总蛋白中Bax、cleaved caspase-3水平显著低于LPS组,而Bcl-2蛋白水平高于LPS组(P<0.05)。见图3、表1。
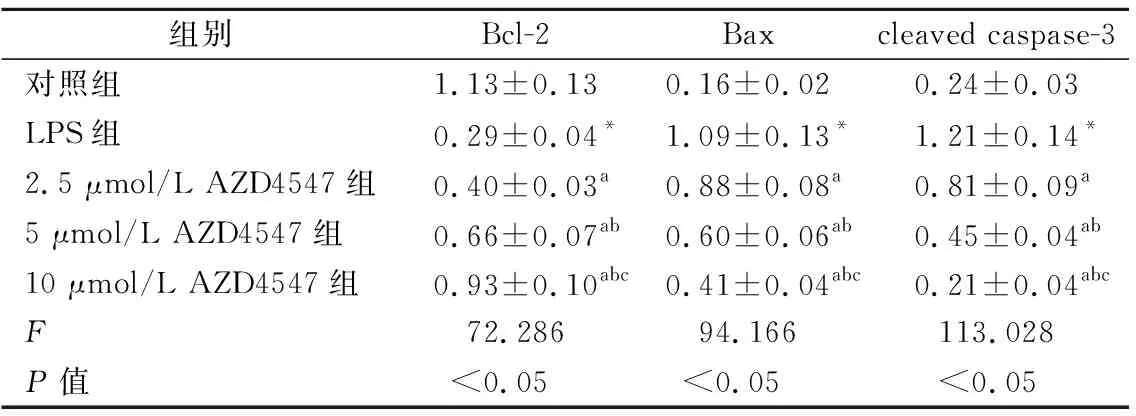
表1 各组细胞总蛋白中凋亡蛋白表达水平的比较
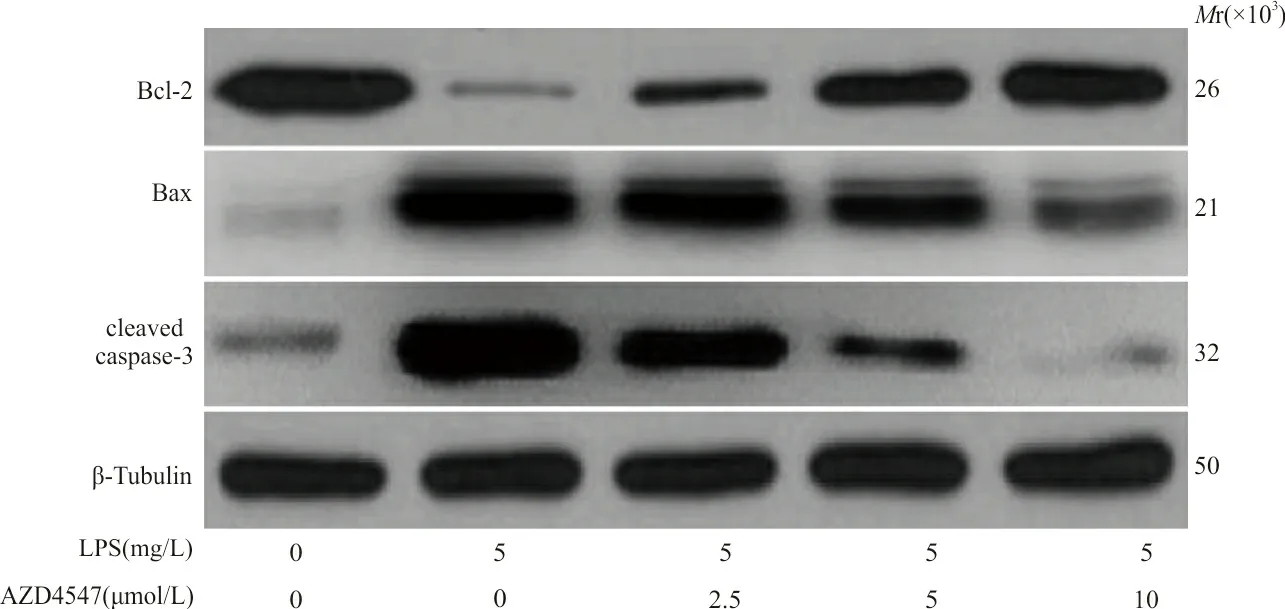
图3 Western blot检测各组Bcl-2、Bax、cleaved caspase-3蛋白的表达
2.5ELISA法检测各组炎症细胞因子的含量 LPS组Beas-2B细胞培养基中TNF-α、IL-1β、IL-6的含量显著高于对照组(P<0.05);而2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞培养基中TNF-α、IL-1β、IL-6的含量显著低于LPS组(P<0.05)。见表2。
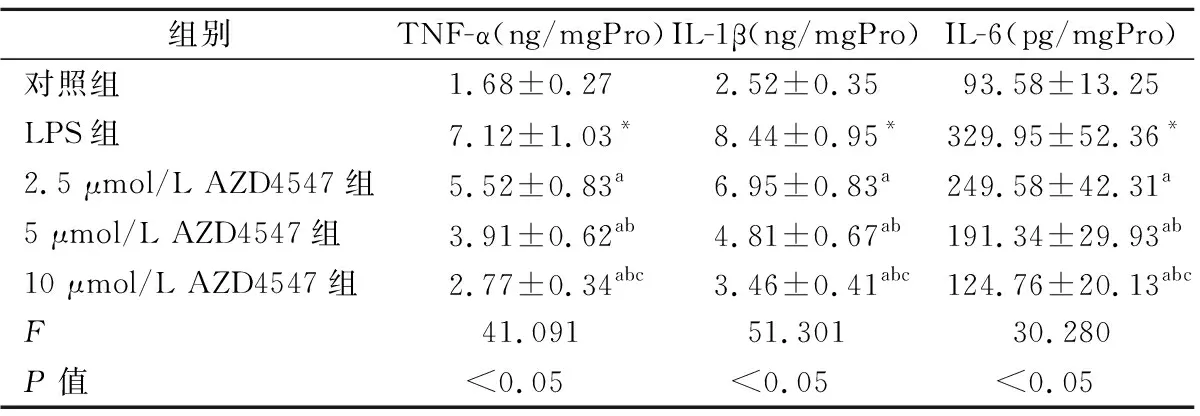
表2 各组细胞培养基中炎症细胞因子含量的比较
2.6Western blot检测抑制p-FGFR1对LPS刺激Beas-2B细胞模型中NF-κB核转位的影响 对照组、LPS组及2.5、5、10 μmol/L AZD4547组Beas-2B细胞核蛋白中p65 NF-κB的表达水平分别为0.10±0.02、0.94±0.11、0.74±0.08、0.41±0.06和0.28±0.04,各组间差异有统计学意义(F=102.515,P<0.05)。进一步进行组间两两比较结果表明,LPS组Beas-2B细胞核蛋白中p65 NF-κB水平显著高于对照组(t=15.027,P<0.05);而2.5、5、10 μmol/L浓度AZD4547组Beas-2B细胞核蛋白中p65 NF-κB水平显著低于LPS组(t分别为2.941、8.460、11.278,P<0.05)。见图4。
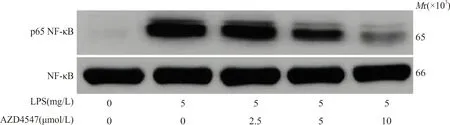
图4 Western blot检测各组p65 NF-κB的表达水平
3 讨论
LPS诱导肺泡上皮细胞炎症反应和凋亡是ALI/ARDS发病的重要病理生理特征。5 mg/L LPS刺激肺泡上皮细胞是研究ALI/ARDS常用的细胞模型[3-4,7-8]。本研究中采用5 mg/L LPS刺激肺泡上皮细胞系Beas-2B后细胞增殖活力减弱,凋亡率及炎症细胞因子TNF-α、IL-1β、IL-6均增加,表明LPS刺激引起肺泡上皮细胞损伤、导致炎症反应及凋亡激活,与既往其他研究的报道基本一致。
本研究进一步在该细胞模型中分析FGFR1的生物学作用。研究表明,FGFR1磷酸化为p-FGFR1后参与炎症反应及细胞凋亡的调控[9-11]。在LPS诱导牙周炎模型及内毒素血症小鼠模型中均发生了FGFR1的过度磷酸化[12-13]。本研究结果显示,LPS刺激肺泡上皮细胞后p-FGFR1表达水平增加,表明在LPS刺激肺泡上皮细胞系Beas-2B的ALI/ARDS细胞模型中存在FGFR1的过度磷酸化,提示FGFR1的磷酸化可能参与LPS诱导肺泡上皮细胞炎症反应及凋亡激活的过程。
AZD4547是FGFR1磷酸化的选择性抑制剂,Lou等[5]和Chen等[6]的研究均使用AZD4547抑制FGFR1的磷酸化,二者的研究结果显示,在LPS诱导肝细胞和肾小管上皮细胞损伤模型中AZD4547显著减轻细胞损伤并抑制炎症反应及细胞凋亡。本研究在LPS刺激肺泡上皮细胞的同时使用不同浓度AZD4547进行干预,结果显示AZD4547以浓度依赖性的方式削弱LPS抑制细胞增殖、促进炎症反应细胞凋亡的作用,这进一步提示了LPS通过促进FGFR1的磷酸化诱导肺泡上皮细胞炎症反应及凋亡的激活。
研究证实,FGFR1调控炎症反应的下游途径是NF-κB[14-15],调控细胞凋亡的下游途径是线粒体凋亡途径[16-18]。本研究的检测结果显示,LPS刺激肺泡上皮细胞后总蛋白中Bcl-2的表达降低,总蛋白中Bax、cleaved caspase-3及核蛋白中NF-κB的表达增加。NF-κB入核后能够促进多种促炎细胞因子的转录并激活炎症反应[14-15];线粒体凋亡途径中Bcl-2/Bax表达水平的变化与线粒体膜对细胞色素C的通透性有关,进入细胞浆的细胞色素C通过级联反应促进cleaved caspase-3的生成,进而介导细胞凋亡[16-18]。ALI/ARDS发病过程中NF-κB通路介导的炎症反应、Bcl-2/Bax介导的线粒体凋亡途径均存在相应变化[19],与本研究的结果相吻合。
为进一步认识FGFR1磷酸化在LPS诱导肺泡上皮细胞炎症反应及凋亡激活中的作用,本研究的分析结果显示,不同浓度AZD4547能够以浓度依赖性的方式削弱LPS刺激对Bcl-2、Bax、cleaved caspase-3及NF-κB的调控作用。这一结果不仅验证了FGFR1磷酸化参与LPS诱导肺泡上皮细胞炎症反应及凋亡的激活,还揭示了p-FGFR1发挥作用的下游途径是NF-κB炎症途径及Bax/Bcl-2线粒体凋亡途径。然而,本研究虽通过细胞实验证实FGFR1过度磷酸化与LPS诱导肺上皮细胞炎症反应及凋亡激活有关,但关于FGFR1在ALI/ARDS中的生物学作用尚缺乏动物实验验证,这是本研究的不足之处。

