新生抗原在肿瘤免疫治疗中的研究进展*
李佳乐,高雯(南京医科大学第一附属医院肿瘤科,南京 210029)
理想的癌症治疗方法不仅可以杀死恶性肿瘤细胞,还可以保留健康组织细胞。越来越多的临床试验证实,免疫治疗对多种肿瘤有效,特别是对于晚期实体瘤,免疫疗法已成为无驱动基因改变肿瘤患者的一种有前途的治疗方法[1-3]。在这个精准医疗的时代,需要利用对癌症生物学和基因组学的更好理解来开发免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的预测性生物学标志物,识别有益临床反应和不良事件风险低的患者,以便患者获益。生物学标志物还将有助于确定适合ICIs的患者,以及决定其应该接受单一疗法还是联合疗法。为了更好地区分对肿瘤免疫治疗敏感患者和非敏感患者,科学家们迫切需要寻找可靠的生物学标志物。程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)、肿瘤突变负荷(tumor mutational burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)等已被证实可以作为预测患者对ICIs治疗反应的生物学标志物[4-5]。笔者介绍一种来源于病毒致癌蛋白或非同义体细胞突变的新生抗原(neoantigen),并证实TMB和MSI均是新生抗原的间接检测指标[6]。新生抗原的特异性识别在抗肿瘤免疫应答中起着重要作用,新生抗原可能是ICIs的一种新兴的预测生物学标志物。笔者总结了新生抗原预测生物学标志物的特点,并讨论了新生抗原在免疫治疗中的应用。
1 新生抗原的定义
肿瘤抗原是肿瘤细胞产生的抗原物质,可引发宿主的免疫反应,目前共发现有15种肿瘤抗原。根据特异性,肿瘤抗原可分为肿瘤相关抗原(tumor associated antigens,TAA)、病毒抗原(virus antigen)、肿瘤特异性抗原(tumor specific antigen,TSA)和非传统肿瘤抗原(unconventional tumor antigens)[7]。
肿瘤特异性抗原也称为新生抗原,它来源于体细胞突变或基因重排蛋白,在单个肿瘤组织中过度表达,可以被T细胞受体特异性识别,包括单个核苷酸突变来源抗原(single nucleotide variants-derived neoantigens),插入突变来源抗原(indel-derived neoantigens),基因融合来源抗原(gene fusion-derived neoantigens),mRNA剪切异常来源抗原(splice variant-derived neoantigens),未注释开放阅读框架来源抗原(translated unannotated ORFs derived neoantigens),线粒体基因组来源抗原(mitochondrial genome derived neoantigens)和热点突变类抗原(hotspot mutation derived neoantigens)[5,8]。图1介绍了不同肿瘤类型形成新生抗原的可能性[3]。与未突变的自身抗原相比,新生抗原真正区别于正常组织,可使免疫系统识别为非自身抗原,避免了自身免疫的风险[7]。新生抗原是由脱氧核苷酸(deoxyribonucleic acid,DNA)损伤和/或DNA修复机制的随机错误引起的零星突变的结果,且肿瘤的新生抗原不能在患者之间共享,这意味着每个癌症患者都有其独特的基因突变,这一个体特异性特征将新生抗原与个体间共享的其他肿瘤抗原区分开来[5]。新生抗原在正常组织中表达很少或没有表达,这预示着新生抗原可能是免疫治疗的潜在靶点,具有高特异性、高有效性和高安全性[9-10]。
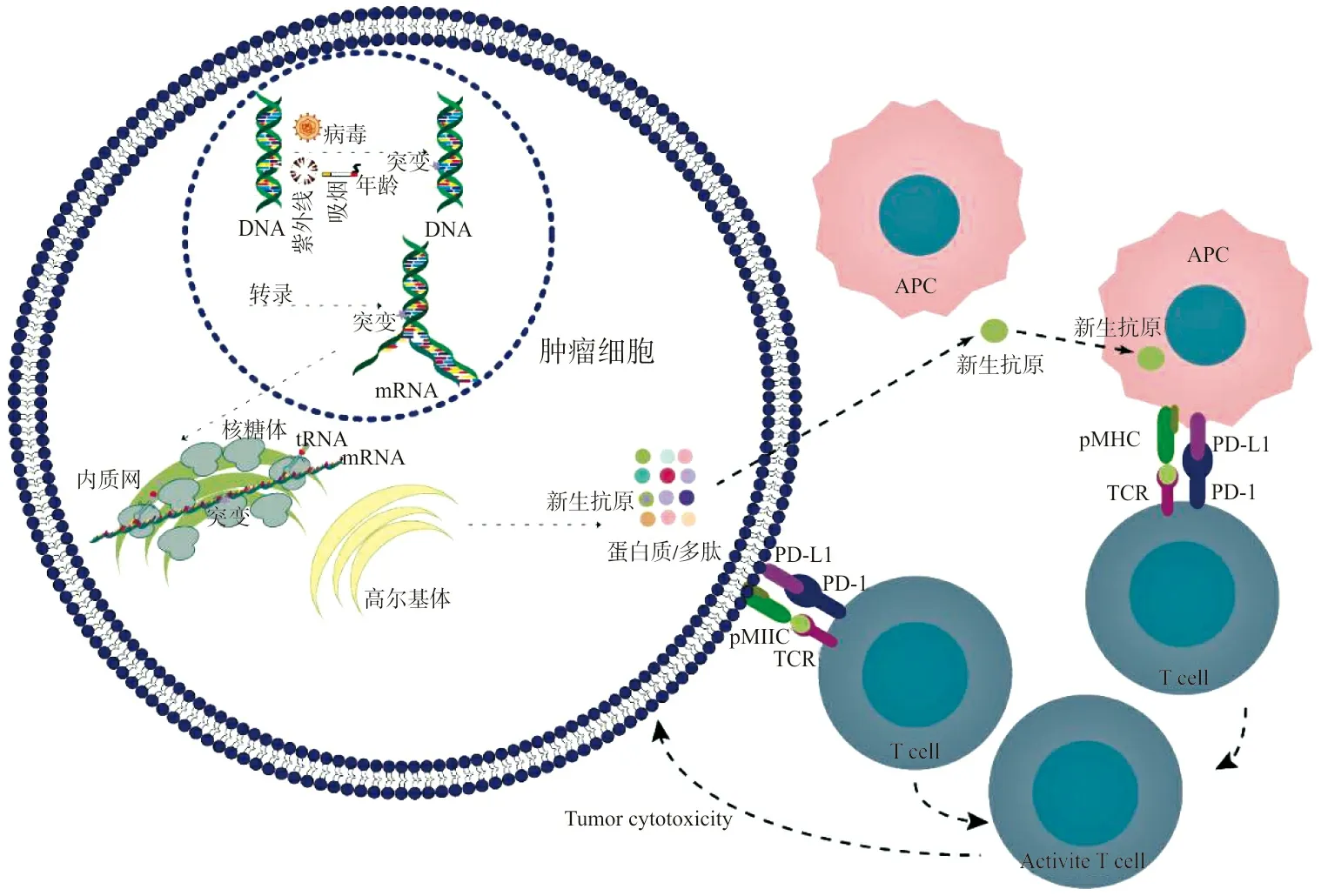
注:任何形式的基因组不稳定都可能导致新生抗原的产生。通过转录、翻译、加工,多肽与MHC结合,组装的p-MHC递呈至细胞表面诱导T细胞的激活。图1 新生抗原的来源示意图
2 新生抗原的优势与不足
随着对肿瘤免疫治疗的认识,人们发现能够产生持久抗肿瘤反应的淋巴细胞大多针对突变基因产生的新生抗原。细胞介导免疫是抗肿瘤免疫应答的主要机制。在这个过程中,体细胞突变产生突变抗原,这些抗原加工成肽,然后该肽与主要组织相容性复合体(major histocompatibility complex,MHC)结合,组装好的肽-MHC (peptide-MHC,p-MHC)被呈现至细胞表面,诱导T细胞启动和激活。T细胞通过T细胞受体(T cell receptor,TCR)和p-MHC的相互作用,特异性识别和结合肿瘤细胞。新生抗原被识别后,肿瘤细胞被肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)杀死[6]。
由于新生抗原在免疫反应中的特殊性,其在免疫治疗中的潜在预测价值引起了许多人的兴趣,并开展了各种各样的研究。越来越多的证据证明,新生抗原与延长患者生存期相关,新生抗原可以成为预测ICIs疗效的生物学标志物[11]。关于新生抗原的不足主要为检测技术的敏感性低和细胞用量大[12-15]。对于无法手术的晚期肿瘤患者,穿刺所获得的新鲜肿瘤组织可能无法获得足够的细胞量以检测新生抗原[12]。
3 新生抗原的检测方法
新生抗原是肿瘤细胞中突变基因通过转录和翻译,包括编辑和修饰,合成的多肽,然后新生抗原被MHC分子识别,在细胞表面加工表达,最后递呈给T细胞。T细胞受体识别特异性p-MHC复合体(MHC Ⅰ呈现给CD8+T细胞,MHC Ⅱ呈现给CD4+T细胞),然后诱导特异性T细胞扩增和免疫应答。概括地说,对新生抗原的检测需要通过3个条件:突变(单个氨基酸突变、移码突变、基因融合、可变剪切、热点突变等),特异性T细胞免疫应答,加工递呈(肿瘤细胞将突变蛋白加工、递呈给MHC,以p-MHC的形式存在于细胞膜表面)。其中关键的步骤是如何验证新生抗原的免疫原性、特异性反应和能否被内源性加工递呈。由于不是所有的非同义突变都能产生T细胞识别的产物,而且免疫原性也不一致,因此识别能引起免疫反应的新生抗原具有很高的价值[16]。通过下一代测序(next-generation sequencing,NGS)发现肿瘤突变,然后通过生物信息法预测新抗原,最后采用传统的免疫学方法筛选和证明新抗原。目前有两种检测方法:间接检测法和直接检测法[7,12-15,17-22]。见图2。
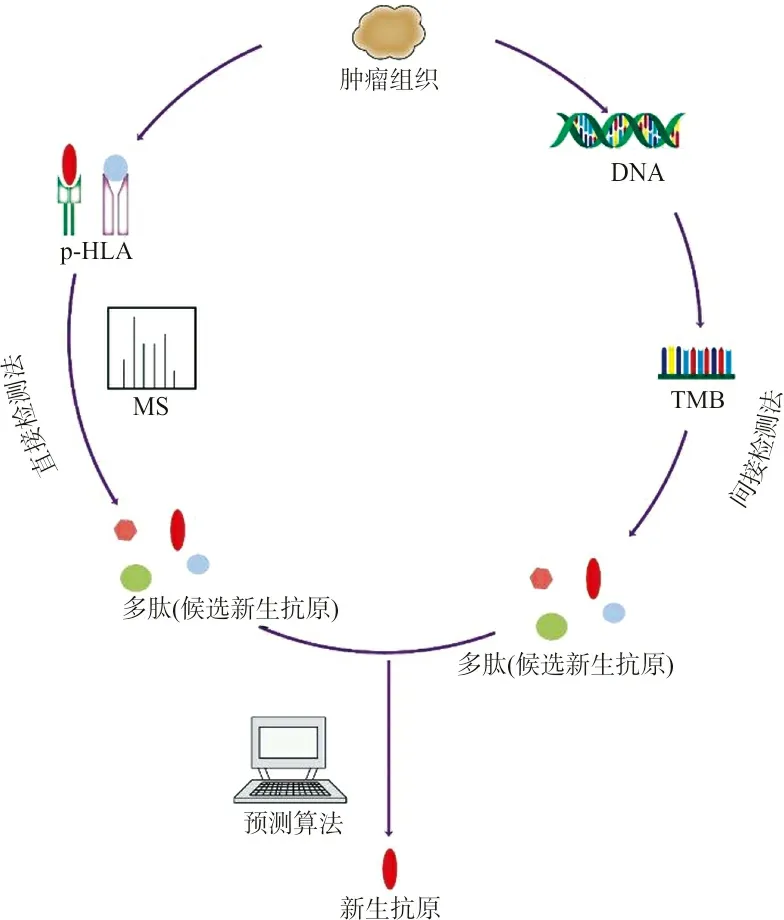
注:直接检测法和间接检测法。图2 新生抗原的检测示意图
3.1间接检测法 Robbins等[17]在TIL疗法的研究中曾报道过新生抗原的检测方式,主要分为五步:外显子测序肿瘤原代细胞系、突变分析、预测特定HLA与突变抗原结合的亲和性、合成亲和力高的肽、T细胞反应分析。该学者首先将测序与突变分析的基因序列用生物学信息软件NetMHCPan 2.4(http://www.cbs.dtu.dk/services/NetMHCpan)进行亲和力预测,将亲和力高的肽加载至抗原递呈细胞(antigen-presenting cells,APC),与回输的TIL细胞共育,然后用ELISA法检测IFN-γ识别出能刺激TIL特异性反应的肽,这是对突变肽免疫原性评价。进一步对特异性反应检测,寻找基因的突变位点,分别转录、翻译野生型肽与突变型肽。随着APC加载肽的浓度增加,具有特异性反应的突变肽可以刺激TIL细胞产生更多的IFN-γ,而野生型肽无法检测出增加的IFN-γ。进一步将APC转染具有突变基因的表达质粒,与TIL共育,检测IFN-γ以验证突变抗原能否被内源性加工提呈。通过上述步骤,Robbins等[17]识别出至少3种新生抗原。间接检测法可以概括为以下几步:首先,通过肿瘤细胞和正常细胞的全基因组测序或外显子测序识别肿瘤中的非同义突变(non-synonymous mutation,NSM),并将其作为候选新生抗原,其中RNA测序可以作为反向鉴定的替代方法。然后根据候选新生抗原的免疫原性进行进一步筛选,将TIL与第一步识别的非同义突变合成的所有候选新生抗原共培养。候选新生抗原的免疫原性可以通过评估T细胞的反应来确定。这种方法主要适用于突变数量有限的肿瘤。通过现有的预测算法可以筛选出与MHC分子更有亲和力的多肽,该算法可以根据肽加工、运输和与MHC Ⅰ结合步骤的生化和生物物理特性,优先考虑更有可能出现在MHC Ⅰ上的候选多肽。因此,现有的预测算法大多是针对MHC Ⅰ限制性肽的预测。虽然预测算法已经取得了很大的进步,但由于预测算法不能将影响免疫原性的所有因素都考虑在内,预测的准确性还需要进一步提高[7,12-13]。另一方面,这些算法建立在每个开发人员设置的特征的基础上,因此最终的结果可能不一致。如何协调和建立统一的标准,仍然是一个有待解决的问题。
3.2直接检测法 体内T细胞通过TCR识别p-MHC发挥免疫作用,MHC结合的肽是T细胞治疗最核心的靶点。基于液相色谱-串联质谱(LC-MS/MS)的蛋白质组学可以直接鉴定与MHC分子TCR结合的肽段。首先将肿瘤细胞裂解,通过抗MHC抗体富集p-MHC,洗脱与MHC分子结合的肽段,然后鉴定被洗脱肽段的氨基酸序列。下一步采用预测算法或评估T细胞反应性以确定候选新生抗原的免疫原性,并确定真正的免疫原性新生抗原[14-15,22]。通过质谱方式获得抗原,极大地提高了MHC Ⅰ类新生抗原预测的准确性,并且通过深度学习可以提高MHC Ⅱ类新生抗原的准确性[13-15]。然而,这种方法在实践中可能会出现错误[7,23]。尽管技术进步很大,但免疫治疗的预测对新生抗原的准确识别有更高的要求。
4 新生抗原的临床应用
新生抗原的肿瘤治疗性疫苗有多种形式,如肽疫苗、RNA疫苗、树突状细胞(dendritic cells,DC)疫苗。新生抗原疫苗可以诱发和增强机体抗肿瘤免疫反应[24-25]。在过继性细胞免疫(adoptive cell transfer,ACT)治疗领域,通过筛选新生抗原可发现T细胞靶点,并在取得不错的疗效[18,20-21]。首个报告的新生抗原的T细胞受体(neoantigen-specific TCR,neoTCR)的细胞疗法临床研究已证明了其安全性[19],其他多种实体瘤的临床试验如NCT03412877还在进行中。
5 总结与展望
由于肿瘤免疫疗法的疗效仅限于一部分肿瘤患者,并且免疫治疗可能诱发免疫相关不良事件,为了克服这些限制,识别ICIs的预测性生物学标志物迫在眉睫。本文讨论的新生抗原是一种新的潜在的肿瘤免疫治疗预测生物学标志物。新生抗原可能会是免疫治疗的关键所在,笔者介绍了目前新生抗原识别的方法和技术。然而,在实际应用中,新生抗原的动态变异和潜在新生抗原的识别等障碍尚未克服,基于NGS和数据库,建立和优化多种新生抗原预测算法是必不可少的。

