急性冷暴露促进C57BL6 幼鼠海马体细胞凋亡
张博熙,金壬顺,吕红明,徐彬,李士泽
(黑龙江八一农垦大学动物科技学院,大庆 163319)
我国北方寒冷地区,冬季漫长且春秋季节气温变化较大,幼龄动物体温调节能力较差,更易受到突如其来的冷空气影响进而诱发低温症导致死亡。有研究指出低于16 ℃的冷环境,会抑制动物自发运动和探究行为,引起焦虑增加[1]。当机体暴露在低温环境下时,机体会通过颤抖、非颤抖和自主活动等,增加热量的产生来抵御冷暴露[2]。低温刺激下,动物容易发生冷应激,而冷应激可能会促进潜在疾病的发生。此外,寒冷造成的应激对动物的行为和人的学习记忆能力等都会造成严重的影响[3-4],影响动物和人的认知表现[4]。因此,冷应激作为易诱发动物疾病的因素是北方畜牧业发展的重要障碍之一。
在以往的研究中,海马体参与构成脑组织边缘系统网络,率先被认为是动物认知中的关键区域,此网络涉及学习、记忆等多个方面。海马也是控制下丘脑-垂体-肾上腺轴(The hypothalamic pituitary adrenal axis,HPA axis)功能的关键大脑区域。早期应激诱导的海马功能障碍会导致HPA 轴失调。海马体在生活中也与情绪处理有关,在受到急性刺激后,HPA轴激活,释放大量应激激素,同时作用于海马体,造成损伤。血清中去甲肾上腺素和多巴胺等均可能升高[1],持续的高水平状态可能会进一步造成脑神经元损伤[5]。生物体对气味的选择性,空间视图能力,听觉判断能力以及情景记忆能力都与海马体功能密不可分,也有研究报道海马依赖性学习记忆与其神经发生和树突形态息息相关[6]。动物幼年时期是身体发育、学习和记忆能力建立的关键时期,海马体作为高级神经活动的重要部位,其发育是至关重要的[7]。虽然大部分大脑发育发生在生命的第一年,但海马体的发育与整个幼年时期持续相关[8],其发育过程中可能会受到多种应激源的影响,例如急慢性的冷热刺激、创伤后应激、药物刺激等。越来越多的研究揭示了冷环境诱导机体稳态的改变及其机制。徐晶等[9]研究发现,急性冷暴露2、6 和12 h,会对断奶仔猪骨骼肌、肺脏、肾脏等造成不同程度的损伤。前期的研究表明,每天3 h 连续7 d 的4 ℃慢性冷暴露会诱导小鼠海马神经元凋亡[10]相关蛋白表达升高。但目前急性冷暴露对幼龄动物海马体是否造成损伤尚未可知。
凋亡作为神经元死亡的一种主要方式,在脑损伤以及神经退行性疾病等一系列复杂的病理过程中扮演着极为重要的角色。细胞凋亡自20 世纪末期被发现后,其相关研究络绎不绝,急性冷应激与细胞凋亡之间存在着紧密的联系[11-13]。细胞凋亡是半胱天冬氨酸蛋白酶(Caspase)介导的程序性细胞死亡过程,在机体中,Caspase 亚家族通常以前体的形式存在,本身无活性,Caspase-9 作为凋亡的触发剂,可激活Caspase-3,活化后直接通过自身介导的信号途径导致细胞发生凋亡[14]。细胞凋亡也与Bcl-2 基因家族有密切关系,Bax 与Bcl-2 基因都属于Bcl-2 基因家族,其中Bax 基因促进凋亡,Bcl-2 基因抑制凋亡。在多细胞生物体的正常生命周期中,通过平衡细胞增殖和死亡来维持一定的机体稳态。当正常的凋亡进程失败或发生过度凋亡时,可能导致海马神经元功能受损,影响正常的学习和记忆功能。
鉴于幼龄动物在北方高寒区畜牧养殖业中更容易受到环境影响,可能伴随着巨大的经济损失风险,探究冷应激对幼龄动物造成的损伤情况变得尤为重要。
1 材料与方法
1.1 实验动物与设计
雄性和雌性C57BL/6 小鼠(8 周龄,22~24 g)购自辽宁长生生物技术股份有限公司。在24±2 ℃的环境温度和40%的相对湿度下,在12 h/12 h 的光照/黑暗周期(从早上8:00 到晚上20:00 开灯)下,在独立通风的笼具(Individually Ventilated Cages,IVC)中预喂食物和水,为期1 周。按照1∶2 的比例将雄性小鼠和雌性小鼠进行合笼饲养,第19 天将怀孕母鼠单独饲并更换充足洁净垫料,第21 天后生产仔鼠,与母代雌鼠共同饲养3 周后分离,选取20 只体态正常的雄性断奶小鼠,随机分成4 组(每组5 只)后饲养3 d,以熟悉环境、建立社会关系和避免断奶应激后,进行急性冷暴露实验。动物分为4 组:室温组和急性冷暴露3、6 和9 h 组(分别称为:RT、CE-3 h、CE-6 h和CE-9 h 组)。冷暴露的方法为将冷暴露组转移到温度为4 ℃的气候室,根据时间不同,取出后立即进行下一步实验。所有实验程序均经黑龙江八一农垦大学实验动物中心管理委员会批准。
1.2 主要试剂
RIPA 裂解液、甲基磺酰氟(PMSF,100 mmol·L-1)、BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶配制试剂盒、SDS-PAGE 5×蛋白上样缓冲液购自中国碧云天生物技术有限公司;ECL 显色液、PVDF 膜(0.22/0.45 μm)购自美国默克密理博公司;TUNEL 细胞凋亡检测试剂盒购自武汉赛维尔生物科技有限公司;Caspase-9 一抗、Caspase-3 一抗、β-actin 一抗、辣根过氧化物酶标记山羊抗小鼠二抗和辣根过氧化物酶标记山羊抗兔二抗购自武汉三鹰生物技术有限公司,Bax 与Bcl-2 一抗购自成都正能生物技术有限责任公司。
1.3 海马体样品采集
急性冷暴露后,随机选取每组内2 只立即采集全脑组织固定于4%甲醛固定液中,待TUNEL 染色试验。另外3 只进行蛋白质印迹分析,于冰上取出全脑组织,刀片纵切后分别剥离左右侧海马体,在预冷的PBS 中洗涤,在液氮中迅速冷冻。并在-80 ℃下储存,直到进一步使用。
1.4 TUNEL 法检测细胞凋亡
将固定好的全脑组织,根据TUNEL 细胞凋亡检测试剂盒说明书中相关方法,脱蜡;通透;孵育Tunel反应液、POD 反应液;DAB 显色;染核;封片;最后镜检拍照。以计数阳性细胞,观察小鼠海马体的凋亡情况,其中凋亡的神经元细胞表现为褐色。
1.5 总蛋白提取及Western blot 检测
将苯甲基磺酰氟(PMSF)和RIPA 裂解液按照1∶100 配制后,取适量与海马组织混匀,使用冷冻混合球磨仪充分研磨后,4 ℃静置30 min,且每10 min充分震荡一次,12 000 r·min-1离心10 min,谨慎将上清吸取出备用。使用BCA 蛋白检测试剂盒测定蛋白浓度,通过计算调整至各组相同。将蛋白样品与5×SDS-PAGE 蛋白上样缓冲液按照4∶1 的比例混合并煮沸10 min,使蛋白质充分变性。
根据目的蛋白的大小,配制适宜的分离胶和浓缩胶,并插入15 孔梳子待凝固备用。加入样品后,首先选用80 V 恒压电泳,待样品完全进入分离胶后,调整为120 V 恒压电泳至结束。于-20 ℃环境中,使用湿转转膜仪转印,根据目的蛋白大小调整转印时间。配制5%脱脂乳,室温封闭1 h。按照抗体说明书配制抗体,Caspase-9(1∶1 000)、Caspase-3(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)与β-actin(1∶1 000),置于4 ℃摇床孵育过夜。次日洗膜5 次,每次5 min。对应二抗(1∶5 000)室温下孵育1 h,然后洗膜5 次,每次5 min。将ECL 显色液按照1∶1 配制,将混匀的显色液均匀覆盖在膜表面,使用ChemiDoc XRS+化学发光成像系统进行观察。
1.6 数据统计分析
应用凝胶成像系统配套分析软件Image J 对目的条带灰度值进行分析。使用SPSS 22.0 软件对数据进行单因素方差分析(one-way ANOVA),使用Graph Pad Prism 8(LaJolla,CA,USA)对数据进行柱状图绘制。所有数据均表示为“mean ± SEM”,P<0.05 具有统计学意义。*P<0.05,**P<0.01,***P<0.001,NS 表示差异不显著。
2 结果与分析
2.1 急性冷暴露对海马体凋亡染色的影响
断奶小鼠海马体TUNEL 染色结果显示,RT 组小鼠海马体中几乎无阳性染色细胞(图1A、1B 和1C),而CE-9 h 组小鼠海马体中有大量阳性染色的细胞(图1D、1E 和1F),以棕黄色的深染状态呈现(图1E 和1F 红色箭头)。
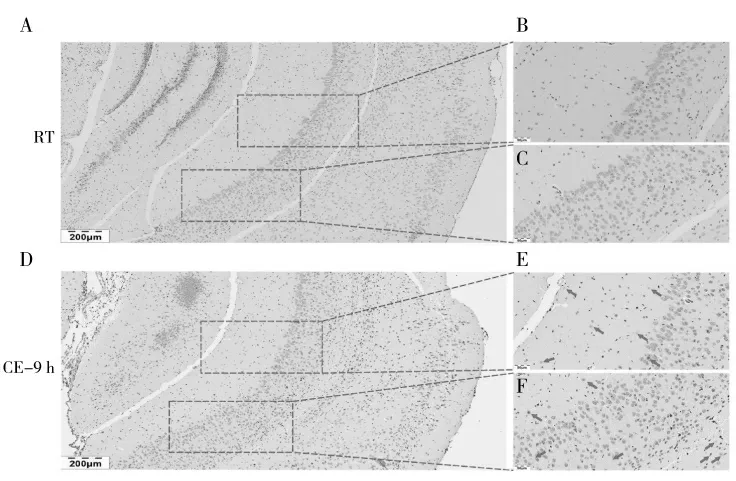
图1 断奶小鼠海马体TUNEL 染色结果Fig.1 Results of TUNEL staining in the hippocampus of weaned mice
2.2 急性冷暴露对Caspase-9 蛋白表达的影响
利用Western blot 对断奶小鼠急性冷暴露后海马组织中Caspase-9 的蛋白表达水平进行检测。如图2 所示,与RT 组相比,Caspase-9 蛋白表达水平在急性冷暴露3、6 和9 h 组均升高,且在急性冷暴露3 和6 h 组极显著升高(图2A 和2B,P<0.001),CE-9h 组显著升高(P<0.05)。结果表明急性冷暴露3、6 和9 h均可以促进Caspase-9 的蛋白表达。
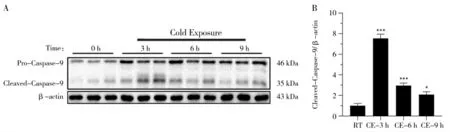
图2 急性冷暴露对海马体Caspase-9 蛋白表达的检测结果Fig.2 Detection results of Caspase-9 protein expression in hippocampus by acute cold exposure
2.3 急性冷暴露对Caspase-3 蛋白表达的影响
利用Western blot 对断奶小鼠急性冷暴露后海马组织中Caspase-3 的蛋白表达水平进行检测。如图3 所示,与RT 组相比,Caspase-3 蛋白表达水平在急性冷暴露3、6 和9 h 组均呈现上升趋势,急性冷暴露3 和6 h 组极显著升高(图3A 和3B,P<0.01),CE-9 h组显著升高(P<0.05)。结果表明急性冷暴露3、6 和9 h均可以促进Caspase-3 的蛋白表达。
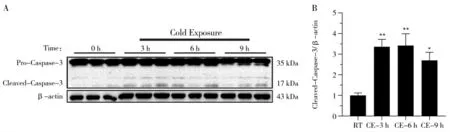
图3 急性冷暴露对海马体Caspase-3 蛋白表达的检测结果Fig.3 Detection results of Caspase-3 protein expression in hippocampus by acute cold exposure
2.4 急性冷暴露对Bcl-2/Bax 蛋白表达的影响
利用Western blot 对关键促凋亡蛋白和抑凋亡蛋白Bax/Bcl-2 蛋白表达的比值水平进行检测。如图4 所示,与RT 组相比,Bax/Bcl-2 蛋白表达的比值水平在急性冷暴露3、6 和9 h 组均显著升高(图4A 和4B,P<0.05)。结果表明急性冷暴露3、6 和9 h 均可以促进Bax/Bcl-2 蛋白表达的比值,并且呈时间依赖性。
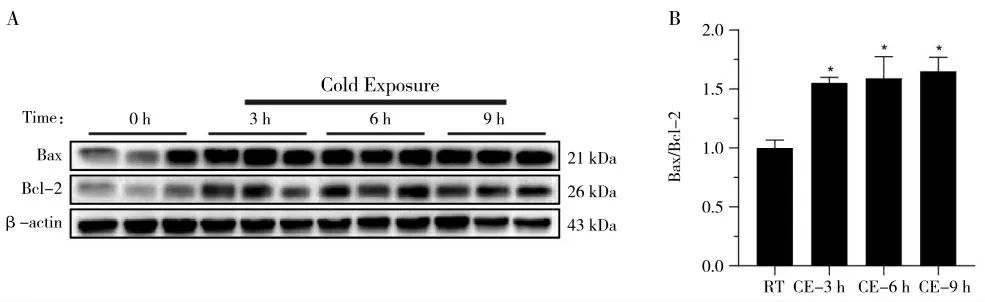
图4 急性冷暴露对海马体Bax/Bcl-2 蛋白表达的比值检测结果Fig.4 The ratio of the expression of Bax/Bcl-2 protein in hippocampus after acute cold exposure
3 讨论
试验使用三周龄断奶小鼠模拟动物幼龄时期,当新生的C57BL/6 小鼠发育至三周龄时,将雄性幼鼠分离,置于25±2 ℃的气候室中饲养3 d 后,避免断奶应激。急性冷暴露后,其神经系统损伤情况可基本反应幼龄动物以及儿童时期冷应激后的潜在危害。建立急性冷应激断奶小鼠模型,检测海马体凋亡相关蛋白,探究急性冷应激后幼龄动物海马神经元细胞凋亡情况,以期为北方寒冷地区畜牧生产中幼龄仔畜预防冷应激提供可靠帮助。
海马体与神经系统相关疾病具有密切的关系,现阶段针对海马体的研究,包括海马神经发生,齿状回中神经元的存活,学习和记忆能力,焦虑程度以及对神经递质系统的影响(如血清素、乙酰胆碱和神经营养因子等),都在神经系统相关疾病中被广泛研究。海马组织作为大脑边缘系统内重要的组成部分,其生理功能尤为重要。海马体具有高度保守的功能,不同部位具有独特的功能。位于海马体背侧部的CA1 区主要功能为长期记忆的建立和空间方向能力的巩固;而情绪和情感的调节是腹侧部海马CA3 区的主要功能。不同程度的应激反应,会造成海马神经元功能及突触损坏,有研究表明,冷应激通过改变神经元的形态结构和减少数量,进而影响神经元功能,导致相关神经递质的异常分泌[5]。有对幼儿的研究表明,海马CA1 区会在4~5 岁时增大体积,而海马CA2-4 区和齿状回区在5~6 岁时增大体积[8]。因此,幼儿早期到中期是海马发育的重要的时期,幼年的海马体发育对后期学习记忆的建立有极大的影响。有研究表明,帕金森病模型中,小鼠海马区发生细胞凋亡[15],促进帕金森病小鼠的运动障碍和身体协调性下降。此外,创伤后应激障碍大鼠模型中细胞凋亡诱发海马体萎缩导致大鼠表现出明显的空间记忆受损[16]。这些研究都表明了细胞凋亡会影响海马体功能,进而引发神经性疾病。吴佳颖[17]发现,-15 ℃急性冷暴露3 h 会使大鼠血脑屏障通透性升高,且记忆力有明显的下降趋势。前人研究发现,小鼠产前冷暴露会诱导下丘脑凋亡相关蛋白变化[18]。这些研究都暗示冷暴露可能会对海马体在内的神经系统有潜在影响。研究发现,TUNEL 染色结果显示CE-9 h 组断奶小鼠海马体存在一定数量的阳性染色细胞,而RT 组无明显阳性染色细胞。以上研究提示急性冷暴露9 h会导致断奶小鼠海马体发生细胞凋亡,造成神经元损伤,这种损伤可能会进一步损害动物成年后的学习记忆能力,甚至成为神经退行性疾病的诱因。然而研究只评估了急性冷暴露对断奶小鼠海马体凋亡损伤的影响,而未直接对急性冷暴露后断奶幼鼠的学习和记忆能力进行评测,这是研究的不足之处。此外,研究未对急性冷暴露后海马体激素水平进行检测,无法通过评估各种激素的水平来判断海马神经元损伤的根本原因。
细胞凋亡是一种程序化的细胞死亡形式,在根除威胁发育、体内平衡的异常细胞方面起着至关重要的作用。为确保细胞凋亡的适当发生,内在细胞凋亡途径在不同阶段受到控制。机体对抗应激时会增强Caspase-9 的自动加工,Caspase-9 是内在或线粒体凋亡途径中的关键参与者,Caspase-9 在凋亡体复合物上被激活以保持催化状态。若未能激活Caspase-9,会导致退行性和发育障碍甚至癌症等不良后果。Pro-Caspase-9 作为内在细胞凋亡途径的起始半胱天冬酶,是通过裂解与细胞凋亡有关的多个关键参与者来维持细胞稳态所必需的。Caspase-9 促进Caspase-3 激活的信号通常被认为是执行细胞凋亡[19]。 被称为细胞凋亡的执行者Caspase-3 进一步发挥功能。研究结果显示,急性冷暴露3 h 时,Pro-Caspase-9 大量活化成Cleaved-Caspase-9,此时Cleaved-Caspase-9 蛋白表达极显著升高,启动细胞凋亡。并进一步将Pro-Caspase-3 剪切成具有活性的Cleaved-Caspase-3 执行凋亡,这种Cleaved-Caspase-3 蛋白表达的极显著升高状态持续到急性冷暴露6 h 并达到峰值,提示此时细胞凋亡程度加剧。急性冷暴露9 h 时Cleaved-Caspase-9 与Cleaved-Caspase-3 蛋白表达略有下降,但与RT 组相比仍保持升高的状态。可能是由于断奶小鼠耐受力较低,急性冷暴露通过激活细胞凋亡信号通路诱导的神经元损伤抑制了Cleaved-Caspase-9 与Cleaved-Caspase-3 蛋白的进一步表达。此外,研究结果表明急性冷暴露后,Bax/Bcl-2 蛋白表达的比值显著升高,随着冷暴露时间的延长,呈现时间依赖性,可能形成Bax/Bax 同源二聚体,促进细胞凋亡,促使小鼠海马体向细胞凋亡的趋势发展。但随着Bcl-2 蛋白表达的增加,可能会形成更稳定的Bcl-2/Bax 的异二聚体,并发挥抑制凋亡的作用。因此,CE-9h 组Cleaved-Caspase-9 与Cleaved-Caspase-3 蛋白表达略有下降的原因,可能是Bcl-2/Bax 的异二聚体通过阻断上游Caspase 蛋白酶的激活,进而抑制细胞凋亡的持续发展。对大鼠的研究表明,海马神经元中Caspase-3 和Caspase-9 的活性增强会诱导海马神经元凋亡,导致大鼠海马神经元组织形态学发生显著变化,可加重大鼠认知障碍[20-21]。对小鼠的研究表明,海马区Caspase-9 和Caspase-3 的蛋白表达增加导致细胞凋亡增加[22],会诱导小鼠神经变性,促进神经退行性疾病的发生。与研究结果相同的是,急性冷暴露诱导了断奶小鼠海马体Caspase-3、Caspase-9 以及Bax/Bcl-2 比值的表达增加。因此可以推测,急性冷暴露通过激活Casepase 信号通路诱导断奶小鼠海马体发生凋亡,进而会造成海马神经元损伤,导致海马功能下降。但研究未检测断奶小鼠海马体炎症、抗氧化等相关信号通路的变化,因此,急性冷暴露诱导神经元损伤的分子机制还需要进一步研究。
综上所述,该研究发现4 ℃急性冷暴露3、6 和9 h可以增加凋亡相关蛋白Caspase-9、Caspase-3 和Bax/Bcl-2 比值的表达,增加断奶小鼠海马体凋亡阳性染色细胞。说明急性冷暴露通过激活Casepase 信号通路诱导断奶小鼠海马神经元发生细胞凋亡。试验为北方幼龄动物预防冷应激提供理论基础并期望为抗急性冷应激药物的开发寻找相关靶点,为高寒地区的幼龄动物防治冷灾害提供新的理念,为畜牧生产行业提供帮助。

