体外模拟消化中高粱淀粉及其多酚复合物的抗氧化活性和消化特性的变化
李欣,刘紫薇,高菲,李志江,2,3,张洪微
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江省杂粮加工及质量安全工程技术研究中心;3.国家杂粮工程技术研究中心)
高粱,又名蜀黎,其产量仅次于稻米、小麦、玉米和大麦,是世界第五大粮食作物,同时也是我国重要的旱粮作物,主要种植于东北及华北地区[1]。高粱籽粒中约含有60%~80%的淀粉[2],还含有丰富的多酚类物质[1]。多酚化合物是一种天然的抗氧化剂,可抑制淀粉酶和葡萄糖甘酶活性[3],同时也可以提高淀粉中抗性淀粉含量[4],对糖尿病等慢性疾病具有预防作用。但有研究发现,多酚消化后的多酚释放量显著低于未消化[5],且在胃中有较大损失,使多酚难以到达小肠内发挥功能活性[6-7]。
崔洁媚[8]将茶多酚与肉类蛋白复配后发现,茶多酚单独存在时,消化前的多酚释放量及抗氧化活性均高于消化后,且显著高于消化前的复配物,但在消化后,复配物的多酚释放量及抗氧化活性均显著高于茶多酚。因此,食物基质可以作为一种载体,使多酚在消化过程中更好的发挥生物活性。张雨阳[9]在研究板栗种皮黄酮对马铃薯淀粉消化特性影响时发现,由于黄酮的加入,使马铃薯淀粉中的抗性淀粉(RS)含量增加,快消化淀粉(RDS)含量降低,进而导致马铃薯淀粉的消化速率降低,使马铃薯淀粉成为一种低血糖指数食物。李欢欢[10]将三种不同糙米多酚(游离酚、结合酚)添加到大米淀粉时发现,三种不同糙米多酚对淀粉消化均具有抑制作用,但结合酚的消化速率高于相对应的游离酚消化速率,同时也发现糙米多酚降低了淀粉的淀粉水解指数和预测葡萄糖值,对糖尿病等疾病具有预防作用。因此,淀粉也可以作为一种载体,使更多的多酚在小肠内释放,进而降低淀粉的消化速率,减少快消化淀粉含量,提高抗性淀粉和满消化淀粉含量,起到减缓餐后血糖快速升高的作用[4,11-13]。团队在提取高粱淀粉时发现,提取的高粱淀粉中含有部分内源性多酚(含量为1.67~4.52 mg·g-1),即高粱淀粉—多酚复合物。目前,大部分学者探究的是多酚或多酚与蛋白复配物在消化前后多酚释放量及抗氧化活性的变化及外源性多酚对淀粉消化特性的影响,但对高粱多酚及其淀粉复合物在消化前后多酚释放量、抗氧化活性及消化特性的研究较少。因此实验应对高粱多酚及其淀粉多酚复合物的消化特性进行比较研究,以此进一步为高粱淀粉—多酚复合物的应用提供理论基础。
研究以高粱淀粉—多酚复合物、高粱多酚、高粱淀粉为研究对象,探究高粱淀粉—多酚复合物与高粱多酚在消化前后的抗氧化活性,以及内源性多酚对淀粉消化特性的影响,以期为高粱淀粉—多酚复合物在功能食品开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
高粱(红糯1 号):黑龙江省安达市;胃蛋白酶(酶活力:30 000 U·g-1):上海源叶生物科技有限公司;胰酶(酶活力≥4 000 U·g-1):北京索莱宝科技有限公司;3,5-二硝基水杨酸溶液:飞净科研试剂公司;2,2-联苯基-1-苦基肼基、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐:上海麦克林生化科技有限公司;硫酸亚铁、过氧化氢(30%)、无水乙醇、无水碳酸钠、水杨酸:辽宁泉瑞试剂有限公司;福林酚:上海蓝季科技有限公司。
1.2 仪器与设备
HHS 型数显恒温水浴锅,天津华北实验仪器有限公司;H1650 Uvmini-1240 型紫外可见分光光度计,北京莱贝赛威科技有限公司;DGG-9140 型电热恒温鼓风干燥箱,上海沪粤明科学仪器有限公司;LGJ-10C 型冻干机,北京四环科学仪器厂;RE-52 旋转蒸发仪,上海亚荣生化仪器厂;Agilent-高效液相色谱,安捷伦科技有限公司。
1.3 试验方法
1.3.1 高粱淀粉—多酚复合物的制备
参照段冰等[14]的方法,并做出一定的修改。将高粱(红糯1 号)粉碎、过筛(80 目),放置在40 ℃鼓风干燥箱内烘干,烘干至恒重。称取烘干后的高粱粉100 g 置于2 000 mL 烧杯中,按料液比1∶15 加入1 500 mL 0.4% NaOH 溶液,随后将其放置在35 ℃水浴震荡器中震荡2 h,2 h 后取出,将混合液于3 500 r·min-1的离心机中离心10 min,弃去上清液,沉淀置于80 目尼龙布中,加入一定量的蒸馏水,弃去滤渣,滤液继续离心(3 500 r·min-1,10 min)。重复以上操作直至沉淀为白色。将沉淀于40 ℃烘箱内烘干24 h,过80 目筛备用,使用石油醚进行脱脂,即获得高粱淀粉-多酚复合物。酸水解法[15]、福林酚法[16]对其淀粉含量和多酚含量进行测定。经测定分析,1 g高粱淀粉-多酚复合物中含有多酚4.52 mg,高粱淀粉-多酚复合物中淀粉含量96.0%。多酚一般与直链淀粉以非共价形式结合,少部分吸附在高粱淀粉颗粒表面,大部分多酚通过疏水作用占据高粱淀粉分子的双螺旋内腔。
1.3.2 高粱淀粉—多酚复合物的分离与纯化
(1)高粱淀粉—多酚复合物的分离
参照旷慧等[17]的方法,并做出一定的修改。称取100 g 高粱淀粉-多酚复合物,按料液比1∶25 加入2 500 mL 60%乙醇,在35 ℃恒温水浴锅内浸提30 min,30 min 后取出离心,收集上清液和沉淀,重复以上操作3 次,将上清液浓缩冻干,即获得高粱粗多酚,纯度为15.6%,沉淀于40 ℃烘箱内烘干,烘干至恒重,即为高粱淀粉,其淀粉含量达97.7%。
(2)高粱多酚的纯化及组成成分的测定
参照巫永华等[18]的方法,对高粱粗多酚进行纯化,采用高效液相色谱对高粱多酚的组成成分进行测定,经测定分析后确定高粱淀粉—多酚复合物中多酚组成成分包括:香豆酸、没食子酸、儿茶酚。
1.3.3 体外消化模拟试验
参照向卓亚、勒志强等[19-20]的方法,并作出一定的修改。胃消化模拟试验:分别称取一定量的高粱淀粉—多酚复合物、高粱多酚和高粱淀粉于烧杯内,加入20 mL 蒸馏水(消化前),用6 mol·L-1HCl 调节pH至2,随后加入0.211 2 g 胃蛋白酶,置于37 ℃水浴震荡器中震荡1 h,将上清液迅速冷冻以停止消化(胃消化液)。肠消化模拟试验:向残渣中加入20 mL 蒸馏水,用2mol·L-1NaHCO3调pH 至7.4,加入0.25 g胰酶粉,置于37 ℃水浴震荡器中震荡2 h(肠消化液),分别在20、40、60、80、100、120 min 时取高粱淀粉—多酚复合物(高粱淀粉)的消化液,取样后离心(4 000 r·min-1,10 min),将上清液迅速冷冻以停止消化。
1.3.4 抗氧化活性的测定
(1)DPPH 自由基清除率的测定
参考全志刚等[21]的方法,并做出一定的修改。DPPH 溶液的配制:准确称取0.019 7 g DPPH,用无水乙醇溶解后定容至100 mL,则DPPH 浓度为0.5 mmo·mL-1,避光保存(0~4 ℃)。在试管中分别加入4.0 mL 样品(未消化、胃消化液、肠消化液)、1.0 mL DPPH 溶液,摇匀,在黑暗处37 ℃放置20 min,以无水乙醇为空白,在517 nm 处测定其吸光度值Ai;取4.0 mL 无水乙醇与1.0 mL DPPH 溶液混合,摇匀,在黑暗处37 ℃放置20 min,以无水乙醇为空白,在517 nm 处测定其吸光度值Ac;取4.0 mL 样品(未消化、胃消化液和肠消化液)与1.0 mL 无水乙醇混合,摇匀,在黑暗处37 ℃放置20 min,以无水乙醇为空白,在517 nm 处测定其吸光度值Aj,以相同浓度的Vc 做阳性对照,按(1)式计算样液DPPH 自由基清除率。
式中:Ai:样液吸光度值;
Aj:不加DPPH,只加试样的溶液吸光度值;
Ac:用蒸馏水替换试样的吸光度值
(2)ABTS+自由基清除率的测定
参照黎明明等[22]的方法,分别称取192 mg ABTS固体粉末与33.2 mg 过硫酸钾固体粉末于烧杯中,用蒸馏水溶解后定容至50 mL 容量瓶内,将两种溶液等体积混合,室温下避光保存静置15 h,即为储备液。用无水乙醇稀释储备液,使其在734 nm 波长处的吸光度值为0.700±0.02,即为ABTS 工作液。使用移液枪吸取0.2 mL 样品(未消化、胃消化液和肠消化液)于试管中,并加入3.8 mL ABTS 工作液,混匀,于避光环境中反应6 min,6 min 后在734 nm 处测定其吸光度值,记作Ai;吸取0.2 mL 样品(未消化、胃消化液和肠消化液)于试管内,加入3.8 mL 无水乙醇,混匀,其他操作同上,其吸光度值记作Aj;吸取0.2 mL无水乙醇,加入3.8 mL ABTS 工作液,混匀,其他操作同上,其吸光度值记作Ac,以相同浓度的Vc 做阳性对照,按(2)式计算样液ABTS+自由基清除率。
式中:Ai:样品吸光度值;
Aj:不加ABTS,样液吸光度值;
Ac:ABTS 吸光度值
(3)羟自由基清除率的测定
参照张瑞麟等[23]实验方法,并作出一定的修改。在试管中依次加入2 mL 样品(未消化液、胃消化液和肠消化液)、2 mL 6 mmol·L-1FeSO4、2 mL 6 mmpl·L-1H2O2,混匀静置10 min,10 min 后加入2 mL 6 mmol·L-1水杨酸溶液,混匀后放置在37 ℃水浴锅内保温1 h,1 h 后取出,于510 nm 处测定其吸光度值,记作Ai;将上述操作中的水杨酸换成蒸馏水,其他操作不变,其吸光度值记作Aj;将样液改为蒸馏水,其他操作同第一步,其吸光度值记作Ac,以相同浓度的Vc 做阳性对照,按(4)计算样液羟自由基清除率。
式中:Ai:样液吸光度值;
Aj:水杨酸换成蒸馏水,样液吸光度值;
Ac:不加样液的吸光度值
1.3.5 高粱淀粉消化特性的测定
(1)标准曲线的测定
参照韩雪琴[24]的方法,并根据DNS 试剂方法做出一定的修改。
(2)消化特性的测定
取1.3.3 肠液中不同消化时间消化液各1 mL,将其稀释40 倍,取1 mL 稀释样液于试管内,加入2 mL DNS,其他步骤同1.3.5(1)中标准曲线的测定。
式中:C:葡萄糖浓度,mg·mL-1;
V:反应体系中液体的体积,mL;
n:稀释倍数;
M:干淀粉(高粱淀粉—多酚复合物)质量,mg。
RDS、SDS 和RS 的含量分别通过下列(5)、(6)和(7)公式计算:
式中:RDS:快消化淀粉含量,%;
SDS:慢消化淀粉含量,%;
RS:抗性淀粉含量,%;
M:总淀粉重量,mg;
D:淀粉中游离葡萄糖的含量,mg;
G20:水解20 min 内释放的葡萄糖的含量,mg;
G120:水解120 min 内释放的葡萄糖含量,mg。
1.3.6 数据统计分析
采用SPSS 对数据进行处理与分析,使用Excel制图,各数据重复测定3 次取平均值。
2 结果与讨论
2.1 高粱多酚及其淀粉复合物在消化前后抗氧化活性的比较分析
2.1.1 DPPH 自由基清除能力
由图1 可知,高粱淀粉—多酚复合物在小肠消化内的DPPH 自由基清除率最高,其次在胃消化阶段,最后则为消化前。有研究发现抗氧化活性与多酚释放量有关[25],可能由于有少量内源性多酚以非共价形式吸附在高粱淀粉颗粒表面,而大部分内源性多酚通过疏水作用占据了淀粉分子的双螺旋内腔[26],当高粱淀粉—多酚复合物进入小肠时,小肠内的淀粉酶和葡萄糖苷酶将高粱淀粉—多酚复合物的糖苷键断裂,淀粉分子双螺旋打开,多酚与淀粉分离,使高粱淀粉—多酚复合物在小肠消化的多酚释放量显著高于胃消化,进而导致高粱淀粉—多酚复合物在小肠消化的DPPH 自由基清除率显著高于胃消化。高粱淀粉—多酚复合物在胃消化中的DPPH 自由基清除率高于消化前,可能是因为有少部分结合酚被分解为游离酚,进而导致胃消化中的DPPH 自由基清除率高于消化前。高粱多酚在胃消化阶段的DPPH自由基清除率最高,其次为消化前,小肠消化的DPPH 自由基清除率最低,这可能是由于高粱多酚在胃消化中更稳定,易释放[25],而在小肠消化内容易发生降解[27],进而导致高粱多酚在胃消化阶段的DPPH自由基清除率最高,在小肠消化阶段的DPPH 自由基清除率最低。
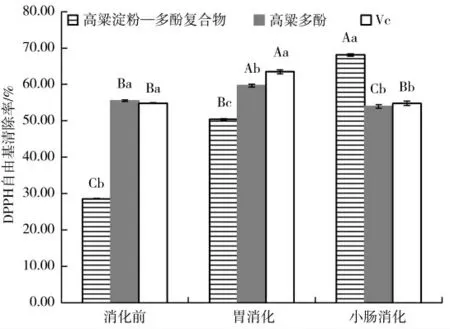
图1 高粱多酚及其淀粉复合物在消化前后DPPH 自由基清除率变化Fig.1 DPPH radical scavenging rate of sorghum polyphenols and its starch complex before and after digestion
高粱多酚在消化前和胃消化阶段的DPPH 自由基清除率显著高于高粱淀粉—多酚复合物,高粱多酚的DPPH 自由基清除率显著高于高粱淀粉—多酚复合物,这一现象的产生是由于大部分内源性多酚通过疏水作用镶嵌在淀粉双螺旋内腔,高粱淀粉对高粱多酚起保护作用;而高粱多酚单独存在时,主要在胃消化中释放,进而导致高粱多酚在消化前和胃消化中的DPPH 自由基清除率显著高于高粱淀粉—多酚复合物。但在胃消化中,高粱多酚的DPPH 自由基清除率显著低于Vc,这一现象的产生可能因为高粱多酚含有的没食子酸主要在胃消化中释放,减弱了高粱多酚对DPPH 的清除能力[28],进而导致胃消化中的DPPH 自由基清除率显著低于Vc。在小肠消化时,高粱淀粉—多酚复合物的DPPH 自由基清除率显著高于高粱多酚,且显著高于Vc,这一现象的产生是由于高粱淀粉—多酚复合物主要在小肠内发生酶解,使镶嵌在淀粉双螺旋内腔中的多酚得以释放,而高粱多酚单独存在时,易在小肠内发生降解或自氧化[29],进而导致高粱淀粉—多酚复合物在小肠消化的DPPH 自由基清除率显著高于高粱多酚。
2.1.2 ABTS+自由基清除能力
由图2 可知,高粱淀粉—多酚复合物在小肠消化阶段的ABTS+自由基清除率最高,其次为消化前,胃消化阶段的ABTS+自由基清除率最低,小肠消化的ABTS+自由基清除率显著高于胃消化是因为高粱淀粉对多酚具有保护作用,使高粱多酚主要在小肠消化时释放;高粱淀粉—多酚复合物在消化前的ABTS+自由基清除率显著高于胃消化,可能由于胃环境对高粱淀粉—多酚复合物中多酚的结构和相互作用具有影响,进而影响了抗氧化活性[30]。但高粱多酚在消化前和胃消化的ABTS+自由基清除率显著高于小肠,且消化前与胃消化的ABTS+自由基清除率无显著差异,这一结果与2.1.1 中高粱多酚DPPH 自由基清除率结果相似,均表现出胃消化显著高于小肠消化。

图2 高粱多酚及其淀粉复合物在消化前后ABTS+自由基清除率变化Fig.2 ABTS+radical scavenging rate of sorghum polyphenols and its starch complex before and after digestion
通过对比高粱淀粉—多酚复合物与高粱多酚在消化前后ABTS+自由基清除率可以发现,高粱多酚在消化前及胃消化阶段的ABTS+自由基清除率均显著高于高粱淀粉—多酚复合物,高粱多酚的ABTS+自由基清除率与Vc 无显著差异。但在小肠消化时,高粱淀粉—多酚复合物的ABTS+自由基清除率显著高于高粱多酚,且显著高于Vc 的ABTS+自由基清除率,这一现象与2.1.1 中结果相似。
2.1.3 羟自由基清除能力
如图3 所示,高粱淀粉—多酚复合物与高粱多酚在消化前的羟自由基清除率均显著高于消化后(胃消化、小肠消化),与2.1.1 和2.1.2 的结果不同,这一现象的产生,一方面可能是由于高粱淀粉—多酚复合物与高粱多酚在消化过程中释放出的多酚在消化过程中结构发生改变,三个抗氧化指标的作用机理不同,使多酚的作用位点不同,进而导致抗氧化活性受到影响[31];另一方面可能是由于高粱淀粉—多酚复合物与高粱多酚在消化过程中释放出的多酚发生拮抗作用[30],进而降低了羟自由基清除率。高粱淀粉—多酚复合物在小肠内的羟自由基清除率显著高于胃中,高粱多酚与之相反,这一结果与2.1.1、2.1.2保持一致。
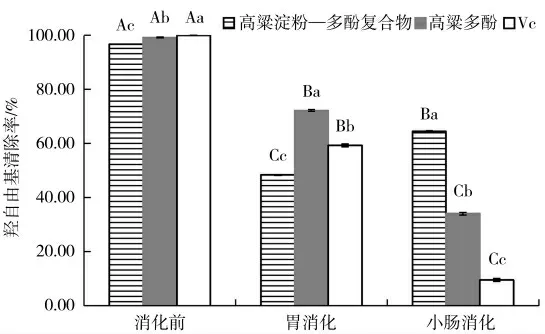
图3 高粱多酚及其淀粉复合物在消化前后羟自由基清除率变化Fig.3 Changes of hydroxyl radical scavenging rate of sorghum polyphenols and its starch complex before and after digestion
高粱多酚在消化前的羟自由基清除率显著高于高粱淀粉—多酚复合物的羟自由基清除率(P<0.05),但显著低于消化前Vc 的羟自由基清除率(P<0.05)。高粱多酚在胃消化阶段的羟自由基清除率仍显著高于高粱淀粉—多酚复合物,且显著高于胃消化阶段Vc 的羟自由基清除率;高粱淀粉—多酚复合物在小肠消化阶段的羟自由基清除率显著高于高粱多酚,且显著高于小肠消化阶段Vc 的羟自由基清除率。这些现象的产生是由于大部分的高粱多酚以疏水作用镶嵌在淀粉双螺旋内腔,高粱淀粉对高粱多酚起到了保护作用,减少了高粱多酚在胃中的损失,使更多的高粱多酚在小肠内释放,而当高粱多酚单独存在时,缺少了淀粉的保护,使其在胃中大量释放[32-33],进而导致高粱淀粉—多酚复合物在小肠消化的羟自由基清除率显著高于高粱多酚,在胃消化和消化前显著低于高粱多酚。
2.2 高粱淀粉及其多酚复合物消化特性的比较分析
人体摄入淀粉20 min 后被人体消化的淀粉称为快消化淀粉(RDS),能够使血糖迅速上升;20~120 min后被消化的淀粉被称为慢消化淀粉(SDS),SDS 被小肠缓慢吸收,不会引起血糖的急剧上升;2 h 后仍不能被人体消化的淀粉被称为抗性淀粉(RS),抗性淀粉可以被肠道微生物发酵,起到膳食纤维的作用,增加饱腹感。如表1 所示,高粱淀粉—多酚复合物的RDS 显著低于高粱淀粉,SDS 与RS 显著高于高粱淀粉,分别高出高粱淀粉6.66%和9.17%。同时由图4可知,高粱淀粉—多酚复合物的消化率显著低于高粱淀粉,与大部分研究结果保持一致[4,11-13,34]。高粱淀粉—多酚复合物的RDS 显著低于高粱淀粉,SDS、RS显著高于高粱淀粉,一方面是由于高粱淀粉对内源性多酚起到了保护作用,减少了内源性多酚在胃中的损失,使大量内源性多酚在小肠中释放,释放出的多酚通过非竞争途径抑制了小肠内的α-淀粉酶活性,通过竞争性途径抑制了葡萄糖苷酶活性[3],进而减缓了淀粉的消化,增加了SDS、RS 含量;另一方面可能是由于高粱淀粉—多酚复合物中的多酚与淀粉颗粒中的直链淀粉和支链淀粉结合形成新的结晶结构,增加了RS,减缓了消化速率[35]。

表1 高粱淀粉及其多酚复合物体外消化特性Table 1 In vitro digestion characteristics of sorghum starch and its polyphenol complex

图4 高粱淀粉及其多酚复合物的水解曲线Fig.4 Hydrolysis curves of sorghum starch and its polyphenol complex
3 结论
通过对比高粱淀粉—多酚复合物与高粱多酚在消化前后抗氧化活性可以发现,除羟自由基清除率外,高粱淀粉—多酚复合物在小肠内的抗氧化活性均显著高于消化前和胃消化,高粱多酚在胃中的抗氧化活性高于消化前和小肠;在胃和消化前,高粱多酚的抗氧化活性均显著高于高粱淀粉—多酚复合物,但在小肠内,高粱淀粉—多酚复合物的抗氧化活性均显著高于高粱多酚。同时也发现,高粱淀粉—多酚复合物的消化率显著低于高粱淀粉,内源性多酚使RDS 含量下降15.83%,同时提高了SDS 和RS 含量。综上所述,高粱淀粉对高粱多酚具有保护作用,使更多的高粱多酚在小肠内释放,同时也降低了高粱淀粉的消化速率,为高粱淀粉—多酚复合物的开发、利用提供了理论依据。由于消化环境对多酚结构及含量具有影响,因此今后应进一步确定高粱多酚及其复合物在消化过程中多酚结构、组成的变化。

