玉米SQD3 基因的克隆、生物信息学及表达模式分析
李嘉欣,邵文静,张今杰,魏玉磊,盖胜男,吴庚锦,刘仕缘,贺琳,李佐同,徐晶宇
(黑龙江八一农垦大学农学院/黑龙江省现代农业栽培技术与作物种质改良重点实验室/黑龙江省秸秆资源化利用工程技术研究中心,大庆 163319)
地球上各种生命活动的维持都离不开光合作用,光合作用是维持生命活动的根本化学反应[1]。在许多植物中,类囊体膜是一种基本光合膜反射系统,植物在类囊体膜的光合膜上面就可以同时进行各种不同光能的连续光合吸收、传递和进行光能光合转换[2]。脂质双层膜和(色素)蛋白复合体构成了类囊体膜,其中最主要的就是多种构成类囊体的双层蛋白膜,按脂质分为单半乳糖甘油二脂(monogalactosyldiacylglycerol、MGDG)、双半乳糖甘油二脂(digalactosyl diacylglycerol,DGDG)、硫代异鼠李糖甘油二脂(sulfoquinovosyl diacylglycerol,SQDG)和磷脂酰甘油(phosphatidylglycerol,PG)四种[3-4]。其中,含硫阴离子糖脂硫代异鼠李糖甘油二脂(sulfoquinovosyl diacylglycerol,SQDG) 是由硫代异鼠李糖甘油二脂合酶(SQD)催化硫代异鼠李糖部分向二酰基甘油(DAG)转移从而生成的光合膜上唯一在生理状况下带负电荷的糖脂(glycolipid),对正常生长条件下的植物是必不可少的,尤其是在低磷胁迫中,它可以替代阴离子磷脂PG 维持类囊体膜的负电荷[5-6]。
目前,在模式植物拟南芥中已有2 个SQD基因被报道[5]。在拟南芥中,SQD1位于叶绿体基质中并且可溶,而SQD2则位于叶绿体的内膜[8-9]。在玉米基因组中,课题组鉴定出5 个SQD基因,并将拟南芥和玉米SQD基因分为TypeA 和TypeB 亚组:AtSQD1和ZmSQD1为TypeA 亚组;AtSQD2和ZmSQD2-5为TypeB 亚组[7]。在一个SQD蛋白成员家族中,A 型中的SQD蛋白成员和B 型中的SQD蛋白成员在保守结构域上表现较出明显的功能差异,这表明在A 型和B 型之间存在着潜在的蛋白质功能分化差异[7]。
在拟南芥中,SQD2包含一个糖基转移酶催化结构域,并催化最终反应步骤SQDG生物合成途径,它参与了磷酸盐胁迫反应[10-11]。目前已有研究证明玉米和拟南芥TypeB 基因在低磷胁迫下叶片和根中均有较高表达[12]。同时,已有多项研究结果表明,低磷生长条件下,sqd1和sqd2突变的拟南芥植株均生长缓慢,但是只有sqd2突变的植株中的磷检测能找到明显的植物生长功能缺陷以及新发现的阴离子糖醛酸苷二酰甘油(GlcADG)[13-14]。也有学者报道,低磷条件下,相比于野生型,细菌细胞中的一些缺乏硫脂的突变体更早的出现停止细胞生长[15-17]。除此之外,亦有学者证明,水稻基因组包含三个SQD2基因(SQD2.1,SQD2.2和SQD2.3)[18-19]。Zhan 等[12-17]已通过水稻SQD2.1活性鉴定了一种特定的类黄酮糖苷,可减轻ROS 的氧化损伤并增强植物对盐分和干旱胁迫的耐受性,此外,AtSQD2也参与调节水稻的糖代谢和结实。但在玉米中SQD基因功能的深入研究还未见报道。
研究通过克隆ZmSQD3基因的全长分子序列、生物信息学分析以及表达模式分析来预测该基因的主要功能,研究ZmSQD3基因功能及其在玉米生长过程中的关键作用,为ZmSQD3基因结构功能探究及其他植物中SQD基因的研究奠定基础。
1 材料与方法
1.1 供试材料
玉米(Zea MaysL.)自交系合344,黑龙江八一农垦大学玉米育种室提供。
1.2 ZmSQD3 基因克隆试验方法
1.2.1 玉米叶片和根系总RNA 提取及cDNA 的获得
将大小均匀、籽粒饱满的种子用10%次氯酸钠消毒,30 min 后用蒸馏水冲洗干净,浸种8 h 催芽,放置于28 ℃下避光萌发。当种子初生根根长约1.5~2 cm 后,转移至蒸馏水中,培养3 d 后,转入富磷(+P:1 000 μM/L KH2PO4)的1/2 Hoagland 营养液中培养至二叶一心时期,将其中一组幼苗进行低磷处理,即转移到磷含量为5 μM/L KH2PO4(低磷)的营养液中,同时处理组的营养液加入与对照中KH2PO4等摩尔浓度的KCl,用以补齐K+浓度;调整营养液pH为6.0,每3 d 更换一次营养液。将处理中的玉米放置于相对湿度为65%,每天光照时间16 h,光照条件为昼/夜温度27 ℃/18 ℃的生长条件中生长。处理时间为1,3,7 d 时,在处理组和对照组中分别取玉米叶片及根系组织,取样后迅速放入液氮中,通过磨样机快速研磨成粉末状,以Trizol 法提取玉米(合344)RNA,提取RNA 的步骤按照康宁生命科技有限公司的提取试剂盒(AxyPrep 试剂盒)说明书进行操作,提取后用事先准备好的DEPC 水进行预处理,进行溶解(14 μL DEPC 水),通过1%琼脂糖电泳对提取的RNA 进行质量性能优化性检测。参照反转录takara试剂盒中的操作说明对提取出来的RNA 进行反转录,将反转录得到的cDNA 在凝胶中验证,将cDNA在28 S 和18 S 条带的亮度和宽度比例为2∶1 的结果cDNA 保存于-20 ℃,备用。
1.2.2ZmSQD3基因引物设计
根据ZmSQD3基因在Phytozome 数据库登录号(GRMZM2G477503)找到该基因CDS 序列,退火温度60 ℃。去掉ZmSQD3下游的终止子,再在保守区内进行设计使其上下游基因引物在前端加入了经过SmaI酶切的同源序列(表1)。以玉米cDNA 为模板进行ZmSQD3基因片段的扩增。

表1 引物序列Table1 Primer sequence
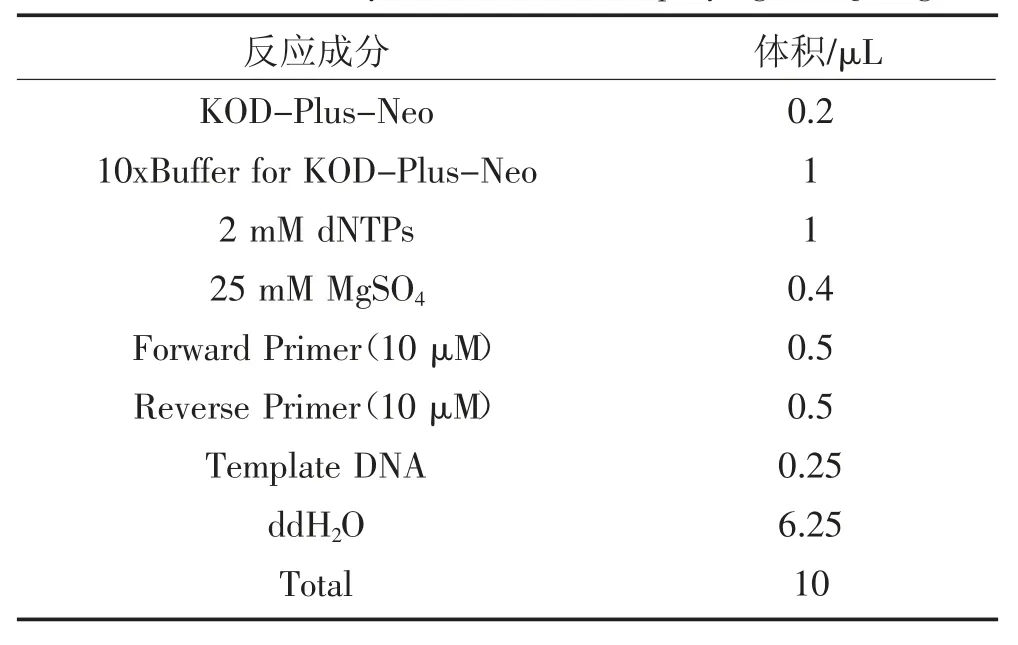
表2 扩增ZmSQD3 基因的PCR 反应体系Table 2 The reaction system of PCR for amplifying ZmSQD3 gene

表3 ZmSQD3 基因克隆反应体系Table 3 The reaction system of ZmSQD3 gene cloning

表4 重组连接体系Table 4 Restructuring the connection system
1.2.3 目的基因PCR 扩增
以玉米叶片总RNA 反转录成的cDNA 为模板,扩增ZmSQD3基因,结合cDNA 全长设置反应程序,以下为PCR 的反应序列体系:
在Eppendorf PCR 仪上设置PCR 程序如下:
4 ℃,保存PCR 产物。
1.2.4 TA 克隆
(1)向平末端DNA 片段3′末端加碱基A:
混匀后轻离心,72 ℃下在PCR 仪中保温25 min;
(2)按照插入片段与载体摩尔比为6∶1 来计算DNA 的加入体积X μL,在冰上加入以下组分:
轻轻吸打,短暂离心;于16 ℃条件下过夜连接。
1.2.5 菌种保存、测序及分析
(1)保存菌种
将15 mL 离心管灭菌,在LB 液体培养基中加入5 mL 100 μg·mL-1Kana 抗生素,用无菌牙签挑取少许阳性单菌落,置于抗性培养液中,37 ℃、170 rpm 振荡培养12 h;取2 只灭过菌的1.5 mL 离心管,依次加入灭好菌的200 μL 80%甘油及800 μL 菌液,充分混合,一只用于测序,另一只液氮速冻,于-80 ℃保存备用。
(2)测序及分析
选择若干阳性克隆的甘油菌送到上海生工有限公司进行测序。进行双向测通的基因测序;得到测序结果后,通过DNAMAN 等软件比较阳性克隆序列与目标序列的一致性,并确认酶切位点与引物是否存在错位,挑选序列信息完全正确的阳性克隆进行下一步试验。
1.3 生物信息学分析
供试基因在不同环境胁迫中的表达数据来自于山东农业大学转录组数据库。测序在BMK 测序平台完成。主要分析方法见表5:

表5 生物信息学分析方法Table 5 Bioinformatics analysis method
1.4 表达模式分析
1.4.1 样品处理及取样
样品处理见1.2.1,分别取盐和低磷处理1,3,7 d的玉米幼苗叶片和根系相同部位,将样品送至北京市百迈克公司进行转录组测序。
1.4.2 转录组测序后数据分析
为了确定转录组数据是否可以进行后续的分析,对数据进行质控(QC),去掉原始数据中质控不合格的低质量序列。然后将过滤后的clean reads 与玉米参考基因组(B73_RefGen_v3)进行比较,对数据进行第二次质控(QC of alignment),通过比对率的统计分析和reads 在参考序列上的分布的方法来判断是否通过第二次检验。
2 结果与分析
2.1 目的基因的克隆鉴定
依据ZmSQD3基因ORF 的序列扩展设计特异引物,用PCR 产物序列检测引物特异性,结果表明,ZmSQD3基因扩增后可产出序列大小为1 314 bp 的单一清晰特异性基因条带(图1),与预期克隆结果相符,且通过CDS 及其所编码的氨基酸序列可知,Zm-SQD3基因共编码437 个氨基酸(图2)。

图1 ZmSQD3 基因的PCR 扩增Fig.1 PCR product of ZmSQD3 gene

图2 ZmSQD3 基因的CDS 及其所编码的氨基酸序列Fig.2 Complete CDS of maize SQD3 gene and its encoding amino acid sequence
2.2 生物信息学分析
2.2.1 物种间氨基酸序列比对
将玉米(Z.mays)的SQD3基因与通过NCBI 网站上下载得到的拟南芥(A.thaliana),水稻(O.sativa),高粱(S.bicolor),大豆(G.max)和短柄草(B.sylvaticum Beauv)SQD基因共15 个基因作系统进化树分析(图3),结果发现:ZmSQD3基因序列与高粱SQD3基因序列高度相似,相似度为92.62%,亲缘关系最近。
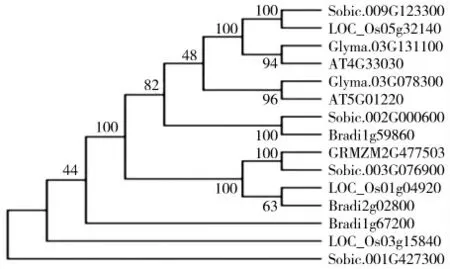
图3 ZmSQD3 基因同源进化树比对Fig.3 Comparison of homologous evolutionary trees of ZmSQD3 gene
2.2.2ZmSQD3基因编码蛋白质一级结构分析
通过NCBI 网站中的BLAST 对全长为1 314 bp的ZmSQD3基因进行CDS 序列结构及编码蛋白质的功能分析,结果表明,ZmSQD3基因属于PLN02871家族成员(图4),对该基因编码蛋白质产物一级结构分析预测显示ZmSQD3基因编码蛋白质氨基酸数量为437 个aa,相对分子量为49.23 kDa,等电点在6.85,分析ZmSQD3的氨基酸组成、正负电荷残基、平均疏水性、脂肪系数、不稳定系数和半衰期,发现该蛋白质不稳定系数40.33,超过阈值40。ZmSQD3蛋白为不稳定碱性亲水蛋白(表6、7)。

表6 ZmSQD3 氨基酸组成分析Table 6 Amino acid composition of ZmSQD3

表7 ZmSQD3 基因编码蛋白质产物一级结构预测分析Table 7 Predictive analysis of the primary structure of the protein product encoded by the ZmSQD3 gene
2.2.3ZmSQD3基因编码的蛋白质磷酸化位点及亲/疏水性分析
蛋白质磷酸化转移位点的基因预测主要以一种神经网络分析算法作为预测基础,预测ZmSQD3基因编码蛋白质的磷酸化位点。如图5A,ZmSQD3蛋白存在36、84、97、101、106、120、157、166、174、208、217、225、245、294、307、319、322、347、381、392 共19 个丝氨酸磷酸化位点;5 个苏氨酸磷酸化位点(分别是66、284、351、367、378);4 个潜在酪氨酸磷酸化位点(分别是40、91、150、400)。相应的磷酸化势位点如图5B,分析表明3 种主要氨基酸结合激酶磷酸化且激活一个ZmSQD3蛋白最终调控整个基因组的表达。ZmSQD3基因预测编码蛋白质中的亲、疏水性结果显示亲水性最大峰值是位于多肽链第343 位的甲基谷氨酸(对应峰值:-2.444),疏水性最大峰值是位于第127 位的甲基脯氨酸(对应峰值:2.767)。根据氨基酸分值的高低对应亲疏水性强弱的变化规律,亲水性最强的氨基酸是该基因序列第127 位的脯氨酸,疏水性最强的氨基酸是该基因序列第343 位的谷氨酸,在氨基酸数量比对上,亲水性氨基酸比疏水性氨基酸多,并且在肽链中是均匀分布的;研究证明Zm-SQD3基因编码蛋白质为亲水性结合蛋白(图6)。

图5 ZmSQD3 蛋白潜在磷酸化位点预测结果Fig.5 Prediction results of potential phosphorylation sites of ZmSQD3 protein
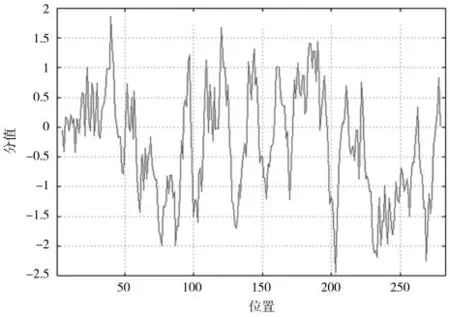
图6 ZmSQD3 蛋白质亲水和疏水性分析Fig.6 Hydrophilic and hydrophobic analysis of ZmSQD3 protein
2.2.4ZmSQD3基因编码蛋白质二级结构分析
由图7,通过对蛋白质产物二级结构的分析得知,ZmSQD3蛋白二级结构由α 螺旋、不规则卷曲结构、β 折叠以及β 转角组成。其中α 螺旋占46.00%,不规则卷曲占14.19%,β 折叠占6.18%,β 转角占33.64%。

图7 ZmSQD3 基因编码的蛋白产物二级结构Fig.7 The secondary structure of the protein product encoded by the ZmSQD3 gene
2.2.5ZmSQD3基因编码蛋白质产物三级结构分析
运用Phyre2 数据库在线分析ZmSQD3基因编码的蛋白质产物并预测分析蛋白质三级结构,运用Rasmol 软件分析玉米ZmSQD3基因编码的蛋白质产物三级结构。由图8 可见,建模可信度范围(GMQE)为0.52,大于0.4,区间(QMEAN)为-3.66 ,证明建模结果可信。

图8 ZmSQD3 基因编码蛋白质产物的三级结构Fig.8 Tertiary structure of ZmSQD3 encoded protein
2.2.6ZmSQD3基因启动子序列分析
通过NCBI 数据库下载ZmSQD3基因ATG 上游5 000 bp 启动子序列,将启动子序列提交至Plant-CARE 应用程序中,预测ZmSQD3基因启动子区域所含主要启动子序列元件。由表8 可知,植物基因启动子响应区域不仅分别存在ABA 逆境响应调控元件,例如ABRE(abscisic acid responsive element)和元件W-box,而且分别存在干旱、盐和碱等低温逆境响应调控元件,例如DRE1(dehydration-responsiveelement)等植物环境胁迫应激响应调控元件,同时也包括能够参与脱落酸响应的顺式作用元件,茉莉酸甲酯响应的顺式作用调控元件;厌氧感应顺势元件、应激响应元件。此外,还有与分生组织表达相关的顺式作用调控元件等细胞特异性表达元件。此外,玉米、棉花和拟南芥的SQD基因均存在顺式逆境响应调控元件,例如STRE、ABRE、TGACGmotif,说明Zm-SQD3基因响应应激响应、脱落酸等生物逆境信号。通常认为植物激素(水杨酸、脱落酸、茉莉酸甲酯等)在植物生长发育过程和逆境响应中具有重要功能[20-21]。
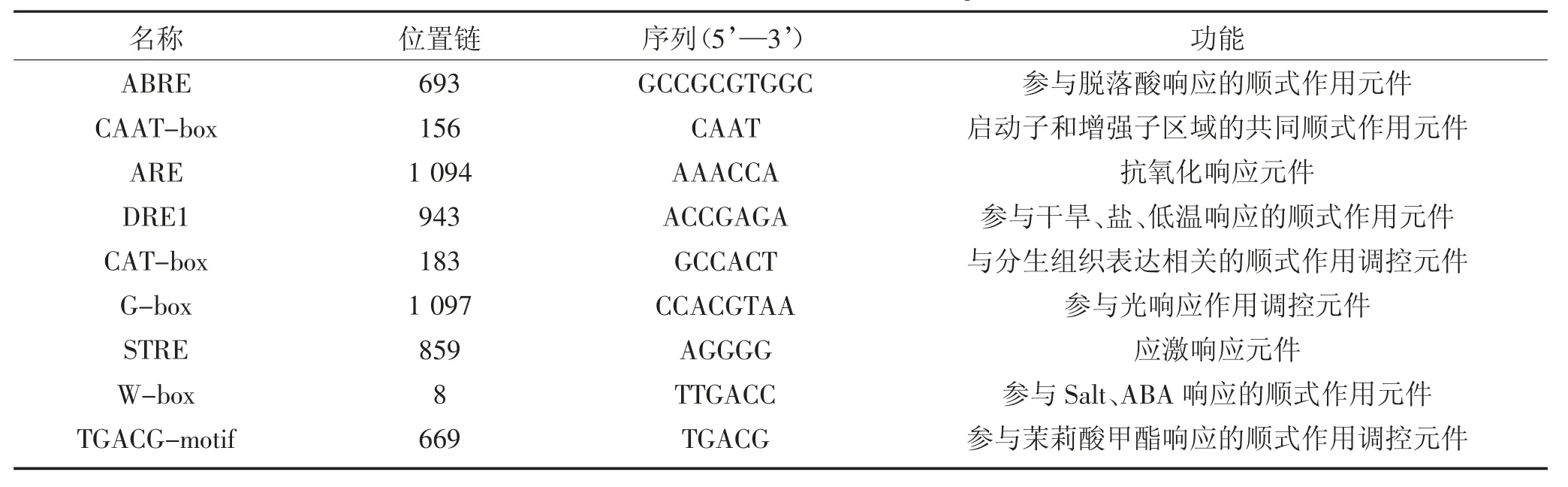
表8 ZmSQD3 基因启动子元件Table 8 Promoter elements of ZmSQD3
2.3 ZmSQD3 基因的表达模式分析
2.3.1 玉米组织中SQD3基因的表达谱
为了研究不同发育阶段的玉米的SQD3基因表达谱,通过玉米eFP 和TAIR 两种权威数据库中收集相关的数据信息并进行基因表达分析。如图9,SQD3基因在玉米营养生长和生殖生长各阶段的各组织中均有表达,且观察到在营养生长阶段的早期叶片和在生殖生长阶段的初期种子中表达量较高。

图9 ZmSQD3 基因在不同组织或不同生长阶段的表达谱的热图Fig.9 Heat map of expression profiles of ZmSQD3 gene in different tissues or different growth stages
2.3.2 环境胁迫下ZmSQD3基因的表达分析
为了研究ZmSQD3基因在环境胁迫中的作用,分析在盐和低磷胁迫下的表达模式。通过对盐和低磷胁迫下玉米叶片和根系在不同时间点的转录组数据分析发现,与0 d 对照相比,在两种环境胁迫下的1、3 和7 d 中,叶片与根系中的ZmSQD3基因均有响应。盐胁迫下,无论是1、3 d 还是7 d 时间点根中的ZmSQD3基因都下调表达,而叶中的都上调表达,3 d时根中表达量最高,7 d 时叶中表达量最高(图10A)。低磷胁迫下,无论是在根中还是叶片中均呈现出上调表达趋势,但在根中1 d 的表达量低,在7 d的根中下调表达(图10B)。
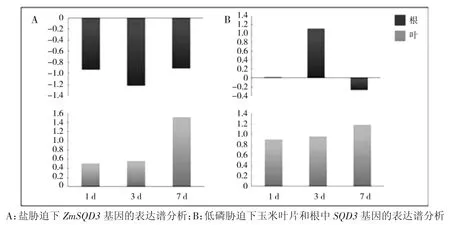
图10 ZmSQD3 基因在不同环境胁迫下的表达分析Fig.10 Expression analysis of ZmSQD3 gene under different environment stress
3 讨论
研究以玉米自交系合344 为供试材料,克隆ZmSQD3基因,测序结果表明克隆的SQD3基因序列与玉米基因组中的相应序列一致。生物信息学技术可以通过对基因序列所含的遗传信息分析,研究被基因控制而形成的蛋白产物,并以此揭示其基因表达的重要生物学特征意义[22]。近年来测序技术已经得到了很大的发展,越来越多的物种全基因组已经成功完成了测序工作。研究主要利用生物信息学分析方法,对ZmSQD3基因编码蛋白的磷酸化位点结构分析、亲疏水性、理化性质、蛋白质的一级、二级、三级结构等分析,SQD3蛋白由437 个氨基酸组成,不稳定系数为40.33(>40),半衰期为30 h,半衰期与稳定性之间也存在着一定的联系,通常来讲半衰期长的蛋白质比较稳定,所以该基因编码的蛋白是一种不稳定型蛋白[23]。平均疏水系数为-0.117,表明Zm-SQD3蛋白具有一定的水溶性。
蛋白质的二级空间结构模型是其多肽链本身的折叠,是在一维结构上可以利用氢键排列组合起来的结构。但是到目前为止,由于很难对一个蛋白质的二级空间结构模型进行精确生物化学预测分析,为了逐步加深对蛋白质二级空间结构的科学理解,使用理论计算法和生物信息学法来进行结构预测。一般只有认为当一个蛋白质二级空间结构的化学预测结果精确率能够达到80%,才可以准确地进行预测蛋白质组成分子的三级空间结构[24]。经过分析,Zm-SQD3基因编码产物由46.00%的α 螺旋、14.19%的不规则卷曲、6.18%的β 折叠和33.64%的β 转角组成,预测可信度超过80%,所以推断通过此分析方法可以准确分析该基因编码序列,继而进行了ZmSQD3蛋白质的三级结构预测。
通过对物种间SQD3蛋白的氨基酸序列同源性分析,玉米与高粱的SQD3基因同源性最高为92.62%,与其他几个物种的同源性也比较高,表明不同物种间SQD3蛋白质非常相似,这与王枫的报道结果相同[7]。
通过对ZmSQD基因启动子上游5 000 bp 进行启动子上游基因研究分析,发现ZmSQD基因启动子含有多个与玉米植物逆境响应相关的顺式作用元件,包括响应环境胁迫表达作用抑制元件、与分生组织表达相关的细胞特异性表达元件等,此外,Zm-SQD3基因的表达可能受到水杨酸、脱落酸、茉莉酸甲酯等激素的调节。这些基因研究分析结果表明,SQD3基因可能正是通过这些响应环境胁迫的顺式作用元件参与玉米对胁迫信号传导途径的应答,在植物响应胁迫过程中发挥作用[25]。
基因表达模式通常是其具有生物学功能的一种具体表现形式之一[26]。研究通过qrt-pcr 表达谱热图分析,SQD3基因在玉米各组织中均有所表达,并且在早期叶片发育阶段观察到B 型的SQD3基因的表达,这表明它在叶绿体和光合作用中发挥功能,与前人证明一致[7]。在低磷胁迫下根和叶片的转录组数据分析显示,ZmSQD3基因在低磷处理下均有显著表达,且在不同时期的根和叶片中表达不同,推测这可能是因为低磷酸盐存在的情况下B 型SQD基因发挥功能[27]。已有前人研究证明,植物光合作用、渗透调节、盐分胁迫和干旱胁迫等都有SQD基因的参与,尤其在磷酸盐胁迫条件下,AtSQD2被认为与植物对磷酸盐胁迫的反应直接相关[23,28]。在磷酸盐高度胁迫的生长条件下,拟南芥植物的一个sqd1或多个sqd2基因突变体表现出生长扩张性,尽管仅在一个sqd2突变体中基因检测可看到明显的生长缺陷和功能缺乏新型阴离子糖酯葡糖苷酸二酰基甘油(GlcADG)[29-31]。
4 结论
(1)ZmSQD3与低磷胁迫和非生物胁迫响应有关,ZmSQD3在低磷胁迫下的玉米幼苗叶片和根系中均显著表达。在磷酸盐饥饿下的玉米叶片和根部组织中,B 型的ZmSQD表达显著,在植物抵御磷胁迫中起重要作用。
(2)在植物中,SQDG脂类不仅响应干旱胁迫、ABA 诱导、激素等,也响应磷胁迫。通过SQD基因的克隆和信息分析得出SQDG脂类在低磷胁迫下起到抗逆的作用,为植物抗逆基因工程育种研究提供帮助。

