枳漆酶基因家族鉴定及其响应盐胁迫的表达分析
徐小勇 顾铭洲 梁梦鸽 姜丽娟
摘要:漆酶(LAC)是植物木质素生物合成中催化木质素单体聚合的关键酶,在调控植物生长发育和胁迫响应中发挥着重要作用。对枳漆酶基因家族进行鉴定和分析,并探究其在盐胁迫下的表达模式,可为进一步研究枳漆酶基因功能提供重要的参考信息。采用生物信息学手段鉴定枳漆酶基因家族成员,对其家族成员的理化性质、基因结构、系统进化关系、启动子顺式作用元件等进行分析,并通过qRT-PCR方法分析其盐胁迫表达模式。结果表明,枳基因组中共有20个LAC基因家族成员,其中18个分布在5条已知染色体上,2个分布在未知染色体上,被预测定位到细胞膜和细胞核中;共有6~14个外显子,5~13个内含子,9~11个motif;系统进化树分析结果显示,20个枳LAC基因家族成员与17个拟南芥LAC基因家族成员共分成7个亚组,20个枳LAC基因家族成员分布在其中的6组;20个枳LAC基因家族成员与拟南芥LAC基因间存在19对共线性关系;启动子区域含有24种顺式作用元件,其中厌氧诱导元件、干旱响应元件和茉莉酸甲酯响应元件数量最多;16个枳LAC基因在盐胁迫下显著上调表达,推测枳漆酶基因参与了盐胁迫响应。
关键词:枳;漆酶基因;进化树;顺式作用元件;盐胁迫
中图分类号:S188+.3 文献标志码:A 文章编号:1002-1302(2023)09-0052-08
基金项目:国家重点研发计划(编号:2018YFD1000107);江苏省农业科技自主创新资金[编号:CX(21)3024]。
作者简介:徐小勇(1979—),男,江西奉新人,博士,副教授,主要从事果树生物技术研究。E-mail:xyxu@yzu.edu.cn。
漆酶(Laccase,LAC,EC 1.10.3.2)是一种含铜的多酚氧化酶,属于铜蓝氧化酶家族,可催化酚类等多种底物的氧化,并将氧气还原成水[1]。漆酶最早在1883年由日本学者Yoshida从漆树的漆液中发现[2],之后在细菌、真菌、昆虫和其他植物中陆续发现[3]。已有研究发现,漆酶参与植物细胞壁木质素生物合成途径的最后阶段,即木质素单体的聚合[4]。因此,漆酶在植物生长发育、生物和非生物胁迫响应中具有重要的调控作用[4]。
漆酶由多基因编码,随着众多植物基因组数据的公布,不少物种已经完成了漆酶基因家族的鉴定。例如,在模式植物拟南芥中,17个漆酶基因被鉴定出来,其中AtLAC4、AtLAC11和AtLAC17与木质素合成有关[5-6];在水稻(Oryza sativa)基因组中,共有30个LAC[7];在柳枝稷草(Panicum virgatum)中共鉴定出49个LAC[8];在梨(Pyrus bretschneideri)中共鉴定出40个LAC[9];在茶树(Camellia sinensis)中共鉴定出43个LAC[10];在荔枝(Litchi chinensi)中共鉴定出61个LAC[11];在桃(Prunus persica)、茄(Solanum melongena)中皆鉴定出48个LAC[12-13]。值得注意的是,漆酶基因在逆境胁迫中的作用正获得越来越多的关注。一般而言,漆酶基因在胁迫下会富集表达,特别是在盐胁迫条件下。例如,玉米ZmLAC1、拟南芥AtLAC2、水稻OsChI1和胡萝卜DcLAC1在盐胁迫下都显著上调表达,而过表达漆酶基因能提高植物的耐盐性[14-17]。
柑橘是世界第一大果树,也是我国栽培面积最大、经济价值较高的果树。然而柑橘以露地栽培为主且对环境条件要求较高,易受多种生物、非生物逆境胁迫的影响,极大程度地限制了我国柑橘产业的良性健康发展。因此,亟待开展柑橘抗逆基因挖掘与鉴定研究[18-21]。枳是芸香科枳属小乔木,具有抗寒、抗旱、适应性强等优点,是我国目前应用最多、最广的柑橘砧木。本研究根据已公布的枳基因組数据[22],采用生物信息学手段鉴定枳漆酶基因家族成员,分析其理化特征、基因结构、系统进化关系、启动子顺式作用元件和盐胁迫表达模式,以期挖掘与盐胁迫响应相关的漆酶基因,为枳LAC基因功能研究提供理论基础。
1 材料与方法
1.1 试验时间与地点
本试验于2022年3月在扬州大学园艺园林学院实验室内完成。
1.2 枳漆酶基因家族的鉴定
枳(Poncirus trifoliata L.)基因组序列、蛋白质序列及其注释信息均下载自CPBD数据库(http://citrus.hzau.edu.cn/)。从植物参考基因组数据库Ensembl(http://plants.ensembl.org)中下载拟南芥的基因组相关数据(基因组序列和注释信息)。
以拟南芥的17个LAC蛋白序列作为查询序列,设置检索阈值(E-value)为10-5,通过TBtools软件的BLAST功能搜索枳蛋白数据库,获得候选枳LAC蛋白序列,通过NCBI、SMART数据库(http://smart.embl-heidelberg.de/)进行蛋白保守结构域的鉴定。通过在线工具Expasy-ProtParam(https://web.expasy.org/protparam/)对枳LAC基因家族成员进行蛋白质理化性质预测。使用在线软件Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对枳LAC蛋白家族进行亚细胞定位预测。
1.3 枳LAC基因家族基因结构和motif 分析
通过在线工具MEME(https://meme-suite.org/meme/tools/meme)进行motif分析,motif数目设置为10个,其他均为默认值,利用TBtools软件对基因结构和motif数据进行可视化作图。
1.4 枳和拟南芥LAC基因家族的系统进化树分析
使用枳、拟南芥的LAC蛋白序列,用Mega X进行多序列比对,并用最大似然法(Maximum likelihood,ML)构建系统进化树,Bootstrap参数设置为1 000,其他参数选择默认值。用Evolview在线软件对系统发生树进行编辑和美化。
1.5 枳和拟南芥LAC基因家族的共线性分析
用MCScanX 程序对枳、拟南芥的基因组信息进行比对,并通过TBtools软件的Multiple SystenyPlot工具分析其共线性关系。
1.6 枳LAC基因启动子顺式作用元件分析
选取枳LAC基因转录起点上游2 000 bp的序列作为启动子区域,利用在线工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)获得每个枳LAC基因启动子区域中所有的顺式作用元件,并筛选出重要的响应元件,进行统计分析。
1.7 植物材料和盐胁迫处理
选择发育一致的45日龄枳幼苗,将幼苗在含有300 mmol/L氯化钠的溶液中进行盐胁迫处理,处理后0~5 d采收根系。所有样本直接收集到液氮中,于-80 ℃保存,直至提取RNA。每个试验设3个生物学重复,每个重复采5株幼苗样品。
1.8 RNA提取和qRT-PCR检测
采用乙二胺四乙酸(EDTA)法提取总RNA,用凝胶电泳和生物分析仪检测RNA质量,用TransScript逆转录酶(TaKaRa公司产品),具体操作参照制造商的说明书。qRT-PCR的基因特异性引物序列见表1。以2 μL cDNA為模板,用SYBR Premix Ex TaqTMⅡ Plus (2×)(TaKaRa公司产品)进行25 μL PCR反应,每个引物浓度为10 μmol/L。采用CFX96实时荧光定量PCR仪(BIO-RAD)进行qRT-PCR检测,以柑橘β肌动蛋白基因(ACTB)为内控基因。反应过程如下:95 ℃预变性 3 min;95 ℃延伸时间30 s,根据特定引物设置的退火温度(T)下退火30 s,共40个循环。聚合酶链式反应结束后,于65~95 ℃进行熔化曲线分析。所有qRT-PCR分析重复3次。采用2ΔΔCT法评估基因的表达水平。
2 结果与分析
2.1 LAC基因家族成员鉴定及其对应蛋白的理化性质预测
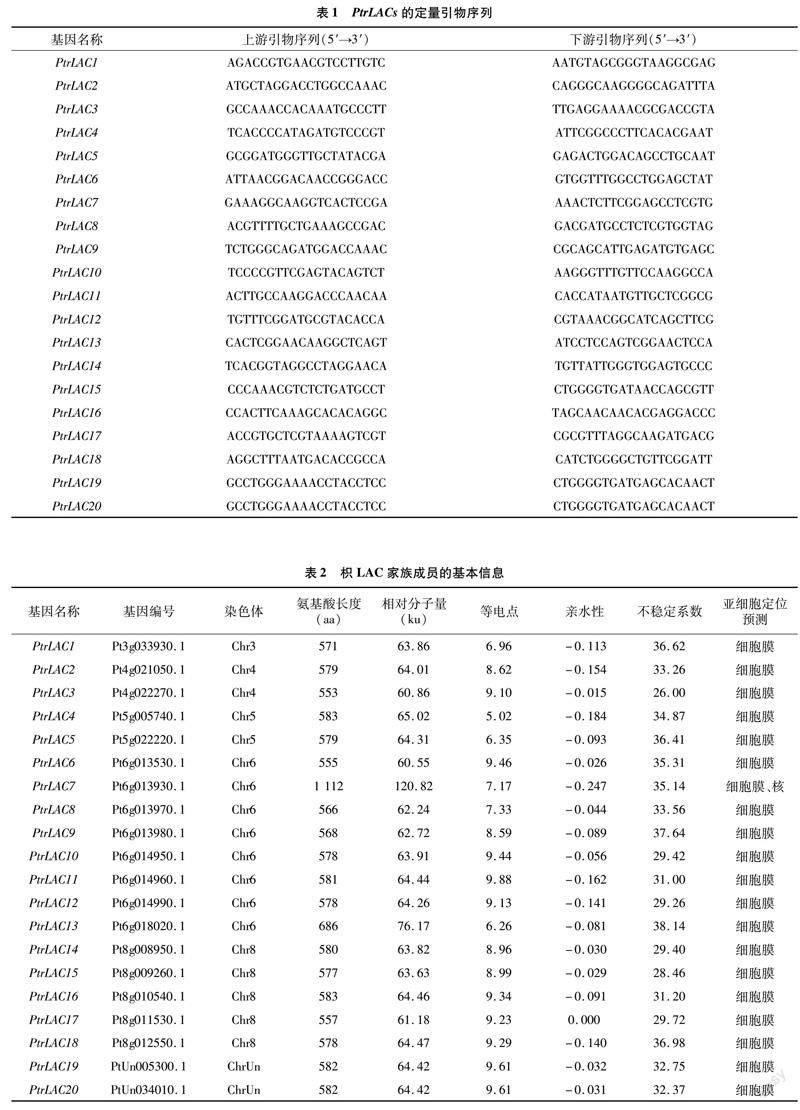
通过BLAST和保守结构域鉴定方法,共在枳基因组中发现20个LAC基因成员(表2),根据其在染色体的分布将其命名为PtrLAC1~PtrLAC20(图1)。其中,PtrLAC1位于3号染色体上,PtrLAC2、PtrLAC3位于4号染色体上,PtrLAC4、PtrLAC5位于5号染色体上,PtrLAC6~PtrLAC13位于6号染色体上,PtrLAC14~PtrLAC18位于8号染色体上,PtrLAC19、PtrLAC20位于未知染色体上。枳LAC基因编码的氨基酸长度介于553~1 112之间,相对分子量介于60.55~120.82之间,等电点介于5.02~9.88之间,亲水性介于-0.247~0.000之间。此外,枳LAC蛋白的不稳定系数位于26.00~38.14范围,都低于40.00,表明这20个LAC基因成员都是稳定的。用在线软件Plant-mPLoc进行亚细胞定位预测,结果显示,所有枳LAC蛋白都位于细胞膜上,此外,发现PtrLAC7位于细胞核上。这揭示枳LAC蛋白可能参与细胞壁的木质素合成。
2.2 枳PtrLAC基因结构和motif分析
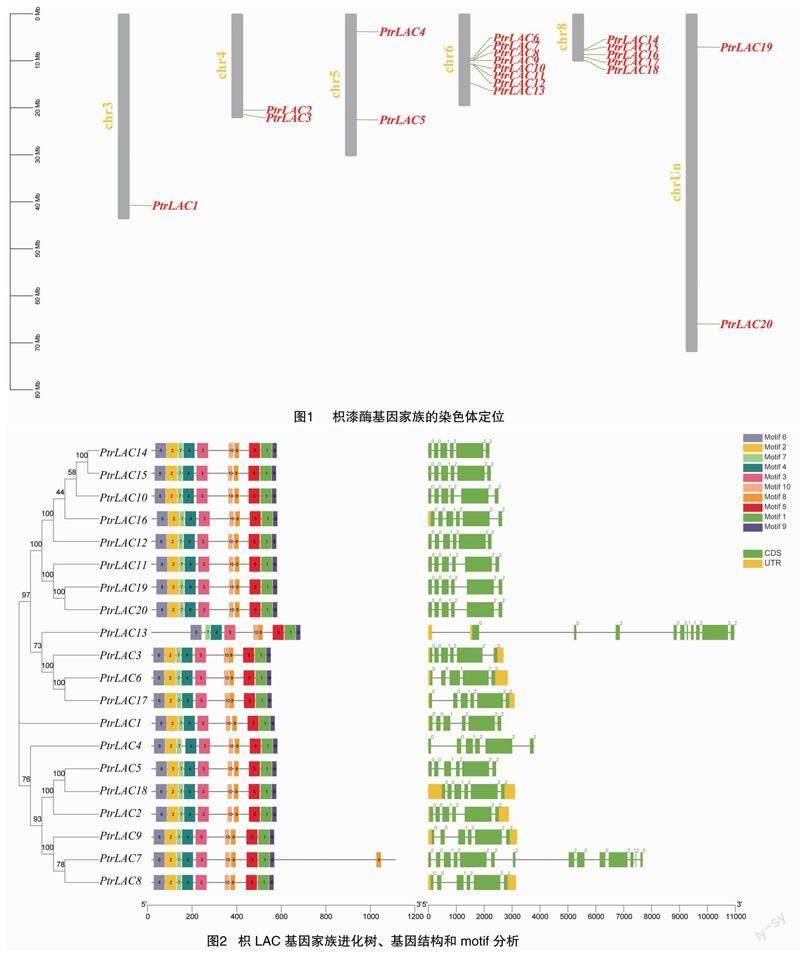
如图2所示,枳LAC基因共有6~14个外显子、5~13个内含子。总体而言,基因之间的基因结构差异较小,多数为6个外显子、5个内含子。基因结构比较特殊的基因为PtrLAC7、PtrLAC13,有较多外显子、内含子。Motif分析发现,枳LAC蛋白含有 9~11个motif。除PtrLAC7、PtrLAC13外,所有枳LAC蛋白具有相同Motif。有趣的是,PtrLAC13缺失motif 2,而PtrLAC7相较于其他枳LAC基因家族成员多1个motif 8。
2.3 系统进化树及共线性分析
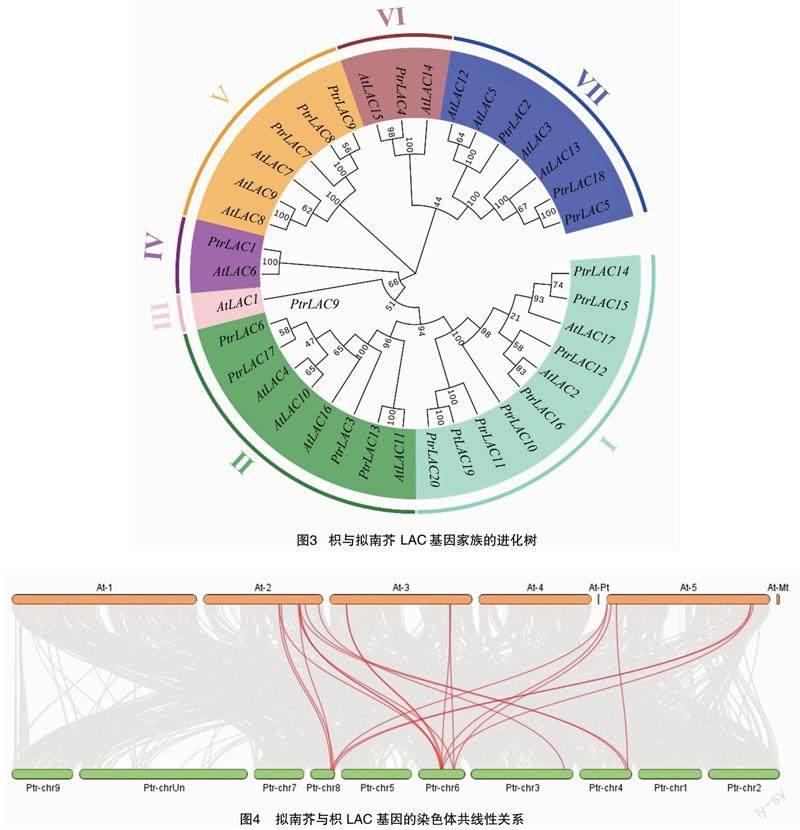
为了探究枳PtrLAC基因与模式植物拟南芥的进化关系,构建它们的系统进化树(图3)。根据进化树的结果,将其分为7个亚组。PtrLAC10、PtrLAC11、PtrLAC12、PtrLAC14、PtrLAC15、PtrLAC16、PtrLAC19和PtrLAC20在第1组;PtrLAC3、PtrLAC6、PtrLAC13和PtrLAC17在第2组;PtrLAC1在第4组;PtrLAC7、PtrLAC8和PtrLAC9在第5组;PtrLAC4在第6组;PtrLAC2、PtrLAC5和PtrLAC18在第7组。上述结果表明,枳LAC基因家族可能存在功能多样性。共线性分析结果显示,枳和拟南芥LAC基因间存在19对共线性关系(图4),暗示这些LAC基因对可能来自共同的祖先,具有相似的功能。
2.4 启动子区域顺式作用元件分析
顺式作用元件分析结果表明,枳LAC基因启动子区域共有24种顺式作用元件,包括生长发育元件、激素响应元件和逆境响应元件三大类型(图5)。其中逆境响应元件类型最多,共有11个。生长发育元件主要有分生组织特异性元件(CAT-box,70% LAC成员)和玉米醇溶蛋白代谢调控元件(O2-site,35% LAC成员)。激素响应元件主要有茉莉酸甲酯响应元件(CGTCA-motif或TGACG-motif,90% LAC成员)、脱落酸响应元件(ABRE,80% LAC成员)和生长素响应元件(AuxRR-core,50% LAC成员),表明枳LAC基因可能受到多种激素的调控表达。逆境响应元件主要有厌氧诱导元件(ARE,所有LAC成员)、干旱响应元件(MBS,90% LAC成员)和低温响应元件(LTR,50% LAC成员),暗示枳LAC基因可能响应多种逆境胁迫。
2.5 鹽胁迫处理对枳LAC基因表达的影响
已有研究发现,多种植物的LAC基因在盐胁迫下诱导表达[14-17]。因此,本研究采用qRT-PCR方法分析所有枳LAC基因在盐胁迫处理下的表达模式。如图6所示,盐胁迫处理使得80%的枳LAC基因在不同时间点显著上调表达,其中多数集中在处理后第1天(PtrLAC3、PtrLAC5、PtrLAC6、PtrLAC10、PtrLAC11、PtrLAC13、PtrLAC15和PtrLAC18)和第5天(PtrLAC1、PtrLAC4、PtrLAC9、PtrLAC14和PtrLAC19),仅PtrLAC2、PtrLAC7、PtrLAC12、PtrLAC17的相对表达量出现下调。值得注意的是,PtrLAC9的相对表达量在处理5 d时急剧升高(约为初始值的47倍)。由此推测,PtrLAC9基因是盐胁迫响应的关键LAC基因之一。
3 讨论与结论
植物漆酶参与木质素单体的聚合,从而影响木质素合成和组分,在植物的生长和发育、应答生物或非生物胁迫反应中具有重要调控作用。迄今,尚未见关于枳漆酶基因家族的研究报道。本研究通过生物信息学方法在枳中共鉴定出20个LAC基因(PtrLAC1~PtrLAC20)。但对多数植物而言,枳LAC基因成员的数目较少[7-13]。枳LAC基因在染色体上的分布不均匀,较集中在第6号、8号染色体上,与甜橙LAC基因的染色体定位一致[23];共有6~14个外显子、9~11个motif,主要定位在细胞膜上,这些特征在不同物种之间的差异较大[7-13,23]。值得注意的是,PtrLAC7定位到细胞膜和细胞核上,且多1个motif 8,暗示该基因可能具有特殊功能。
在本研究中,枳LAC基因启动子区域的顺式作用元件分析结果显示,其启动子区域含有24种顺式作用元件,包括生长发育元件、激素响应元件和逆境响应元件,暗示着枳LAC基因可能受到多种植物激素和环境逆境诱导 并参与植物生长发育过程调
控。对于不同植物而言,LAC基因启动子区域的顺式作用元件在数量、种类上具有一定差异,尤其是富集的顺式作用元件种类[8,10,24]。例如,茶树LAC基因主要富集厌氧诱导响应元件、茉莉酸甲酯和乙烯响应元件[10];多数柳枝稷草LAC基因存在脱落酸响应元件、茉莉酸甲酯响应元件和干旱响应元件[8];枳LAC基因富含干旱响应元件、厌氧诱导响应元件和茉莉酸甲酯响应元件。但上述预测的顺式作用元件有待通过试验验证。
系统进化树分析将20个枳LAC基因家族成员与17个拟南芥LAC基因家族成员分成7个亚组,与前人的研究结果[9,23]一致。同一亚组的枳LAC基因与拟南芥LAC基因可能具有相同或相似的功能。考虑到AtLAC4、AtLAC11和AtLAC17与木质素合成有关,笔者推测PtrLAC6和PtrLAC17(与AtLAC4聚类)、PtrLAC13(与AtLAC11聚类)及PtrLAC14和PtrLAC15(与AtLAC17聚类)参与枳木质素生物合成。此外,AtLAC7、AtLAC8和AtLAC9这3个基因在缺铁、创伤或盐胁迫下上调表达[25]。因此,我们预测同一亚组下的PtrLAC7、PtrLAC8和PtrLAC9可能与胁迫响应相关。本研究的qRT-PCR分析结果显示,PtrLAC8、PtrLAC9在盐胁迫下显著上调表达,而PtrLAC7显著下调表达,可见这3个基因确实与盐胁迫响应相关,但它们是否参与枳盐胁迫响应调控尚不清楚。目前笔者所在本课题组正在进行PtrLAC9的功能鉴定研究,有望进一步揭示其功能。
参考文献:
[1]Giardina P,Faraco V,Pezzella C,et al. Laccases:a never-ending story[J]. Cellular and Molecular Life Sciences,2020,67(3):369-385.
[2]Yoshida H. LXIII.-Chemistry of lacquer (Urushi). Part Ⅰ. communication from the chemical society of Tokio[J]. Journal of the Chemical Society,Transactions,1883,43:472-486.
[3]Janusz G,Pawlik A,Swiderska-burek U,et al. Laccase properties,physiological functions,and evolution[J]. International Journal of Molecular Sciences,2020,21(3):25.
[4]Wang J H,Feng J J,Jia W T,et al. Lignin engineering through laccase modification:a promising field for energy plant improvement[J]. Biotechnology for Biofuels,2015,8:145.
[5]Berthet S,Demont-Caulet N,Pollet B,et al. Disruption of LACCASE4 and 17 results in tissue-specific alterations to lignification of Arabidopsis thaliana stems[J]. The Plant Cell,2011,23(3):1124-1137.
[6]Zhao Q,Nakashima J,Chen F,et al. LACCASE is necessary and nonredundant with PEROXIDASE for lignin polymerization during vascular development in Arabidopsis[J]. The Plant Cell,2013,25(10):3976-3987.
[7]Liu Q Q,Luo L,Wang X X,et al. Comprehensive analysis of rice laccase gene (OsLAC) family and ectopic expression of OsLAC10 enhances tolerance to copper stress in Arabidopsis[J]. International Journal of Molecular Sciences,2017,18(2):e209.
[8]Li R,Zhao Y,Sun Z,et al. Genome-wide identification of switchgrass laccases involved in lignin biosynthesis and heavy-metal responses[J]. International Journal of Molecular Sciences,2022,23:6530.
[9]Lu C Y,Yang T Y,Zhang Y W,et al. Genome-wide analyses and expression patterns under abiotic stress of LAC gene family in pear (Pyrus bretschneideri)[J]. Plant Biotechnology Reports,2021,15(3):403-416.
[10]Yu Y C,Xing Y X,Liu F J,et al. The laccase gene family mediate multi-perspective trade-offs during tea plant (Camellia sinensis) development and defense processes[J]. International Journal of Molecular Sciences,2022,22(22):12554.
[11]李鄭华,姜成东,王 鹏,等. 荔枝漆酶(LAC)基因家族鉴定及表达分析[J/OL]. 分子植物育种,2022:1-22. [2022-11-03].https://kns.cnki.net/kcms/detail/46.1068.s.20220507.1344.008.html.
[12]Qui K,Zhou H,Pan H,et al. Genome-wide identification and functional analysis of the peach (P. persica) laccase gene family reveal members potentially involved in endocarp lignification[J]. Trees,2022,36:1477-1496.
[13]Wan F X,Zhang L Q,Tan M Y,et al. Genome-wide identification and characterization of laccase family members in eggplant (Solanum melongena L.)[J]. Peer J,2022,10:e12922.
[14]Liang M X,Haroldsen V,Cai X N,et al. Expression of a putative laccase gene,ZmLAC1,in maize primary roots under stress[J]. Plant Cell and Environment,2006,29(5):746-753.
[15]Cai X N,Davis E J,Ballif J,et al. Mutant identification and characterization of the laccase gene family in Arabidopsis[J]. Journal of Experimental Botany,2006,57(11):2563-2569.
[16]Cho H Y,Lee C,Hwang S G,et al. Overexpression of the OsChI1 gene,encoding a putative laccase precursor,increases tolerance to drought and salinity stress in transgenic Arabidopsis[J]. Gene,2014,552(1):98-105.
[17]Ma J,Xu Z S,Wang F,et al. Isolation,purification and characterization of two laccases from carrot (Daucus carota L.) and their response to abiotic and metal ions stresses[J]. Protein Journal,2015,34(6):444-452.
[18]Huang X S,Wang W,Zhang Q,et al. A basic helix-loop-helix transcription factor,PtrbHLH,of Poncirus trifoliata confers cold tolerance and modulates peroxidase-mediated scavenging of hydrogen peroxide[J]. Plant Physiology,2013,162(2):1178-1194.
[19]Dai W S,Wang M,Gong X Q,et al. The transcription factor FcWRKY40 of Fortunella crassifolia functions positively in salt tolerance through modulation of ion homeostasis and proline biosynthesis by directly regulating SOS2 and P5CS1 homologs[J]. New Phytologist,2018,219(3):972-989.
[20]Khan M,Hu J B,Dahro B,et al. ERF108 from Poncirus trifoliata (L.) Raf. functions in cold tolerance by modulating raffinose synthesis through transcriptional regulation of PtrRafS[J]. Plant Journal,2021,108(3):705-724.
[21]Zhang Y,Ming R H,Khan M,et al. ERF9 of Poncirus trifoliata (L.) Raf. undergoes feedback regulation by ethylene and modulates cold tolerance via regulating a glutathione S-transferase U17 gene[J]. Plant Biotechnol Journal,2022,20(1):183-200.
[22]Huang Y,Xu Y T,Jiang X L,et al. Genome of a citrus rootstock and global DNA demethylation caused by heterografting[J]. Horticulture Research,2021,8 (1):69.
[23]Xu X Y,Zhou Y P,Wang B,et al. Genome-wide identification and characterization of laccase gene family in Citrus sinensis[J]. Gene,2019,689:114-123.
[24]Sun Z,Zhou Y,Hu Y,et al. Identification of wheat LACCASEs in response to Fusarium graminearum as potential deoxynivalenol trappers[J]. Frontiers in Plant Science,2022,13:832800.
[25]Turlapati P V,Kim K W,Davin L B,et al. The laccase multigene family in Arabidopsis thaliana:towards addressing the mystery of their gene function(s)[J]. Planta,2011,233(3):439-470.

