聚苯乙烯微塑料对土壤吸附泰乐菌素的影响过程和机制
单晓玲,胡桂林,赵 冉,吕凤莲,郭学涛①
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.农业农村部西北植物营养与农业环境重点实验室,陕西 杨凌 712100;3.安徽理工大学地球与环境学院,安徽 淮南 232001)
微塑料(microplastics,MPs)是直径小于5 mm的聚合物颗粒,已被认为是环境中的一类新兴污染物[1],MPs及其相关的化学物质能够通过食物网转移,在多个营养水平上积累,进而对人类和其他生物体造成潜在有害风险[1]。虽然最早受关注的是海洋塑料污染,但由于人类的陆地活动,有数据表明释放到土壤中的MPs是海洋中的4~23倍[2],工业场地土壤中可能含有质量分数w高达6.7%的MPs[3]。最近的研究报告预测未来进入土壤的塑料流量会是水生系统的40倍,土壤可能是一个比海洋更重要的微塑料储存库[4]。MPs在海洋环境中的潜在负面影响已得到较多证实,其在陆地环境中的影响仍是当前研究热点。在土壤环境中,MPs除了直接影响土壤微生物群落和作物生长[3,5]外,还可能作为其他污染物的吸附剂和载体,影响土壤中共存污染物的生物积累和生态毒性。
土壤污染物种类繁多、污染过程复杂且隐蔽持续,抗生素是土壤中典型的持久性有机污染物,因抗生素的大量生产和广泛应用及在生物体内的低代谢率,致使30%~90%的抗生素最终进入环境[6],其中超过50%的抗生素通过有机肥施用或污泥回用进入土壤环境[7],在土壤中可能引起的耐药菌和抗性基因的扩散会进一步威胁生态环境。泰乐菌素(tylosin,TYL)是一种广泛用作畜禽养殖抗菌和促生长的大环内酯类抗生素,其生物利用率低,经动物体代谢后,约67%的TYL随粪便排出[8]。DOLLIVER等[9]在养殖场粪便渗滤液中检测到的ρ(TYL)高达1.2 μg·L-1。水体有机质、土壤和沉积物对TYL的吸附是影响其在环境中迁移和转化的重要行为,并以此预测TYL对环境的影响程度[10]。章明奎等[11]研究发现土壤对TYL的吸附能力与土壤黏粒占比、有机碳含量等密切相关,土壤对TYL的吸附量最高可达325.7 mg·kg-1。
微塑料对有毒化学物质具有很高的亲和力,对极性有机污染物的吸附受环境条件的影响,现有的微塑料吸附研究大多与水生环境有关[2]。在土壤环境中有机污染物对微塑料的吸附行为在很大程度上是未知的。有关MPs对土壤中抗生素的迁移转化影响机制的研究相对较少,而微塑料对抗生素的复合效应是其对土壤微生物群落产生影响的重要途径。聚乙烯(polyethylene,PE)和聚苯乙烯(polystyrene,PS)是应用最广泛的两种塑料,也是环境中塑料污染的主要来源[12]。PE在农田覆膜中的广泛应用,使其成为以往土壤微塑料研究中的热点,而对PS在土壤中的环境效应的关注在持续增加。PS是一种不可生物降解的合成塑料,常用作一次性包装、建筑保温材料等,也可用作稳定土壤表面结构和防潮性的土壤调节剂。PS产量占全球塑料年生产总量的7.1%[5],是环境中微塑料的关键来源。我国污水处理厂污泥中的微塑料PS占主要比例[12],温室土壤中PS含量也相对较高[13],PS再生利用率低,废弃率大且长时间内难降解,在土壤环境中的长期积累量不容忽视,微塑料对土壤吸附抗生素的影响值得探索。李嘉等[14]研究发现土壤中MPs减弱了土壤对土霉素的吸附能力。SUN等[15]发现土壤中加入w=0.5%的PS对四环素的迁移转化起抑制作用。
该研究选取PS微粒和TYL为研究对象,从吸附的角度探索土壤中微塑料对抗生素的影响机制,通过吸附动力学和热力学批试验及溶液pH、离子强度的影响试验进行分析讨论,为微塑料与土壤中持久性有机污染物的相互作用提供一定的科学依据。
1 材料与方法
1.1 供试材料
1.1.1试剂耗材
供试药品TYL(分子式为C50H83NO23,纯度w>95%)购自Sigma(美国)公司。TYL具有正电荷极性(酸度系数pKa=7.1),当溶液pH<7.1时TYL为带正电荷的离子态,当溶液pH>7.1时TYL为不带电荷的分子态。试验用其他试剂和药品购自国药集团。试验用纯水由纯水仪(ULUP-1,西安优普)制备得到。
1.1.2样品制备及表征
按照HJ/T 166—2004《土壤环境监测技术规范》的要求从我国不同省份农田采取不同性质的表层土(采样深度为0~20 cm),自然风干后研磨过75 μm孔径筛(200目),依次标记为S1(陕西土样)、S2(安徽土样)、S3(江西土样)和S4(海南土样)。土壤样品的理化性质见表1。
PS微粒购自中国国药有限公司。将PS研磨并过75 μm孔径筛,用w=10%的HCl浸泡48 h并用去离子水冲洗干净后,自然条件下晾干备用,采用扫描电镜(S4800,日本Hitachi公司)观察PS表面形貌,采用红外光谱(Tensor 27,德国Bruker公司)表征PS表面官能团,采用Zeta电位仪(Omni,美国Brookhaven公司)测定PS所带电荷。
以往的试验研究中,MPs添加质量分数为0.1%~10%[2,16],结合当前检测得到的土壤微塑料质量分数(0.03%~6.7%)[3],向土壤中加入w=1%的PS,充分混合均匀得到PS-土壤复合样品,依次记为PS-S1、PS-S2、PS-S3和PS-S4。
1.2 吸附试验
1.2.1吸附动力学试验
为维持反应过程中离子浓度的恒定和抑制微生物活性,配制含0.01 mol·L-1KNO3和0.001 mol·L-1NaN3的溶液作为背景溶液[17],用该反应介质配制质量浓度为100 mg·L-1的TYL初始溶液。用背景溶液稀释TYL初始溶液至10 mg·L-1,加入HNO3和KOH溶液调节pH为6.8,得到工作溶液。为消除土壤中潜在的微塑料污染影响,对比PS添加后土壤吸附特性的变化,分别称取0.03 g原土壤或含PS土壤,依次置于30 mL棕色玻璃离心管中,加入20 mL工作溶液。拧紧瓶盖混合均匀后,放入摇床振荡反应〔(25±2) ℃,150 r·min-1〕,依次在振荡0、15、30 min,1、2、3、5、7、12、24、36、48 h时采样。将取得的样品离心(转速4 000 r·min-1,离心半径为10 cm)30 min后取上清液经0.45 μm水系滤头过滤后置于棕色色谱瓶中冷藏待测。在每个时间点设置1组样品(3个平行)并设空白对照组。TYL浓度用高效液相色谱仪(LC-30A,日本Shimadzu公司)测定。
1.2.2吸附等温线试验
用背景溶液稀释TYL初始溶液得到质量浓度分别为1、3、5、7和10 mg·L-1的TYL溶液,加入一定量HNO3和KOH溶液调节pH值为6.8,分别量取20 mL移入玻璃离心管中并按照TYL浓度梯度依次加入0.01、0.02、0.03、0.04和0.05 g原土壤或含PS土壤,设置25 ℃恒温,转速为150 r·min-1,振荡至吸附平衡后,取出样品离心。取1 mL上清液经0.45 μm滤头过滤后冷藏保存在棕色色谱瓶中。每组设置3个平行样并设空白对照组。
1.2.3溶液pH对吸附的影响
使用HNO3或KOH溶液调节纯水至不同的pH值,用以稀释100 mg·L-1的TYL初始溶液得到pH值分别为3、5、7、9、11,质量浓度为10 mg·L-1的TYL反应溶液。分别移取20 mL反应溶液至30 mL离心管中,并加入0.03 g PS-土壤复合样品,在同一条件下振荡48 h后取样离心过滤至棕色色谱瓶中得到TYL待测液。每组设置3个平行样。
1.2.4溶液离子强度对吸附的影响
称取适量硝酸钾配制质量浓度分别为0、0.001、0.005、0.01、0.05和0.1 mol·L-1的KNO3溶液,用该溶液稀释100 mg·L-1的TYL溶液至10 mg·L-1,分别称取0.03 g 含PS土壤,放入玻璃离心管中,并加入不同离子强度的TYL溶液,设置25 ℃ 恒温,转速为150 r·min-1,振荡至吸附平衡后,取出样品离心。取1 mL上清液经0.45 μm滤头过滤后冷藏保存在棕色色谱瓶中。
1.3 检测与计算
1.3.1TYL检测方法
采用液相色谱法测定溶液中TYL浓度,采用C18(2)型色谱柱(250 mm×4.6 mm,5 μm),流动相为CH3CN和0.01 mol·L-1的KH2PO4溶液,按照两者35∶65的体积比组成混合液,流速为0.2 mL·min-1,检测波长为290 nm。采用外标法,用相应的反应介质配制浓度梯度为0~10 mg·L-1的TYL溶液,绘制标准曲线(R2>0.99)。
1.3.2计算与分析
根据吸附前后溶液中浓度差计算TYL吸附量,计算公式为
(1)
式(1)中,qt为t时刻TYL吸附量,mg·kg-1;C0和Ct分别为除去空白损失量的TYL初始浓度和t时刻TYL浓度,mg·L-1;V为反应溶液总体积,mL;m为吸附剂质量,g。
为比较TYL在原土壤和含PS土壤中的吸附动力学行为,采用准一级和准二级动力学模型以及颗粒内扩散模型对吸附数据进行拟合[18],计算公式为
qt=qe(1-e-k1t),
(2)
(3)
qt=kit0.5+C。
(4)
式(2)~(4)中,qt为t时刻TYL吸附量,mg·kg-1;qe为平衡吸附量,mg·kg-1;k1为准一级动力学吸附速率常数,h-1;k2为准二级动力学吸附速率常数,kg·mg-1·h-1;ki为颗粒间扩散速率常数,mg·kg-1·h-0.5;C为与液膜厚度相关的常数。
采用经典吸附Linear、Freundlich和Langmuir等温线模型分别对吸附等温线进行拟合[19]。
qe=kdCe,
(5)
qe=kfCen,
(6)
(7)
式(5)~(7)中,qe为吸附平衡时固相TYL含量,mg·kg-1;Ce为吸附平衡时液相TYL浓度,mg·L-1;kd为吸附剂线性分配系数,L·kg-1;kf为表示吸附作用强弱的Freundlich分配系数,Ln·mg1-n·kg-1;n=1时吸附等温线为线性,n≠1表示吸附等温线为非线性;qm为饱和吸附量,mg·kg-1;b为Langmuir吸附常数,L·mg-1。
2 结果与讨论
2.1 PS的表征分析

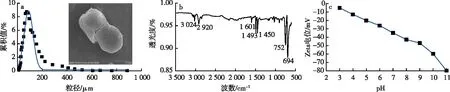
图1 PS粒径分布和SEM图(a)、FTIR图(b)和Zeta电位图(c)
2.2 吸附动力学分析
如图2所示,无论是原土壤还是添加PS土壤,TYL吸附过程可分为3个阶段[21]:(1)快速吸附阶段:TYL吸附量在3 h内快速达到平衡吸附总量的70%以上,该阶段主要为液膜在吸附剂颗粒表面的扩散,即外部扩散;(2)缓慢吸附阶段:吸附速率持续降低,总量缓慢增加,该阶段以TYL在颗粒表面和空隙的内部扩散为主;(3)吸附平衡阶段:TYL在吸附剂上的吸附速率逐渐降至0,吸附趋于平衡。分别采用准一级和准二级动力学模型拟合试验数据,拟合参数见表2,准二级动力学拟合曲线见图2,通过对比qe和R2可知,采用准二级动力学方程都能够较好地拟合未添加PS土壤和添加PS土壤对TYL的吸附,TYL吸附以多相吸附为主[22],这与SUN等[18]的研究结果一致。
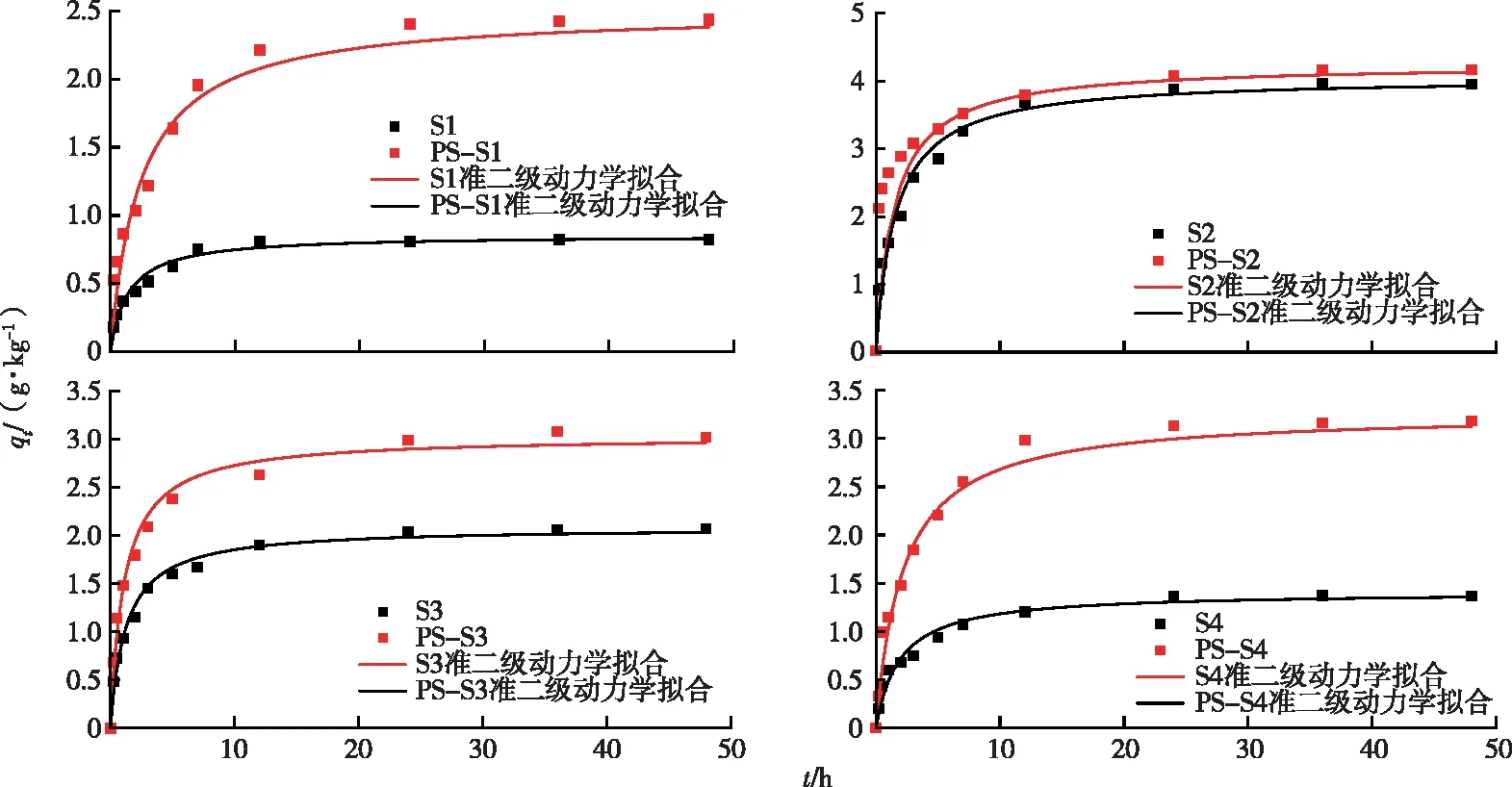
qt为t时刻TYL吸附量。S1~S4分别为陕西、安徽、江西和海南土样。
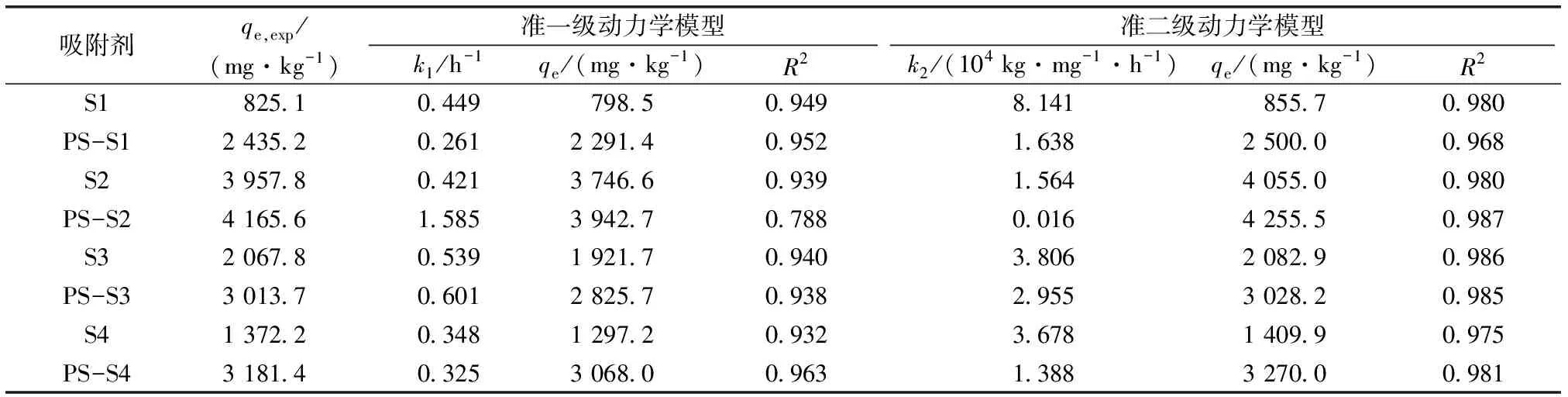
表2 原土壤和含PS土壤对TYL的吸附动力学参数
4种土壤对TYL的吸附能力由大到小依次为S2、S3、S4和S1,这与土壤中有机碳含量和铁氧化物含量呈正相关,与黏粒含量呈负相关[23],吸附还受到土壤中阳离子交换量的影响。由图2可知,PS的加入对土壤中TYL的吸附起到了显著促进作用,促进程度由大到小依次为PS-S1、PS-S4、PS-S3和PS-S2,均达到显著性差异。这与原土壤对TYL的吸附能力大小顺序相反,PS的加入在一定程度上改变了土壤对TYL的吸附性质,其中,其对土样S1和S4的影响最大,这两种土样分别为黏土和壤质黏土,黏粒含量高,有机碳含量低,PS的添加有效地提高了土壤总有机碳含量。DIAO等[24]在土壤中加入1%的聚氨酯(PU)微粒,发现土壤有机质含量提高26%,溶解性有机碳含量增加50%以上。ZHANG等[25]发现随着吸附时间的增加,添加0.5%的MPs提高了土壤有机质含量(15.1~22.9 g·kg-1),降低了土壤阳离子交换能力。PS的添加减弱了黏粒对TYL吸附的负作用,PS与土壤的复合增加了吸附剂的空隙和吸附位点,且加入的PS本身可以通过静电相互作用、分子间的氢键和分配作用等吸附TYL[1]。
为进一步明确TYL在含PS土壤中的吸附过程,应用颗粒内扩散模型对TYL的吸附过程分3段进行扩散拟合。如图3所示,第1线段为液膜扩散,TYL附着在吸附剂表面的吸附位点上。随后TYL进入吸附剂颗粒内部扩散,在第3线段主要体现为TYL在吸附位点的吸附反应。通过对比发现,土壤中加入PS后拟合的3条线段中,ki和C整体上呈增长趋势,这表明PS改变了液膜厚度、吸附位点数和颗粒内部结构,进而影响TYL在土壤上的吸附进程和吸附总量。
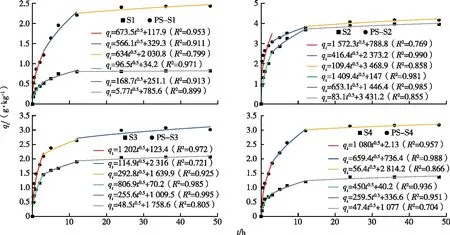
qt为t时刻TYL吸附量。S1~S4分别为陕西、安徽、江西和海南土样。
2.3 吸附等温线分析
对吸附等温线数据进行拟合分析(表3),可以看出,Freundlich和Langmuir方程对吸附等温线的拟合效果相对较好(R2>0.97),表明原土壤和含PS土壤对TYL的吸附是物理和化学共同作用的过程。原土壤或含PS土壤对TYL的吸附是一种单层不均匀的表面吸附[26]。随着平衡浓度的增加,等温线的切线斜率逐渐变小,表明土壤对TYL的吸附逐渐趋于饱和。ZHAO等[27]研究得到了相似结论,多环芳烃在PS上的吸附等温线与Freundlich模型相似,疏水作用是吸附过程的主要控制因素。
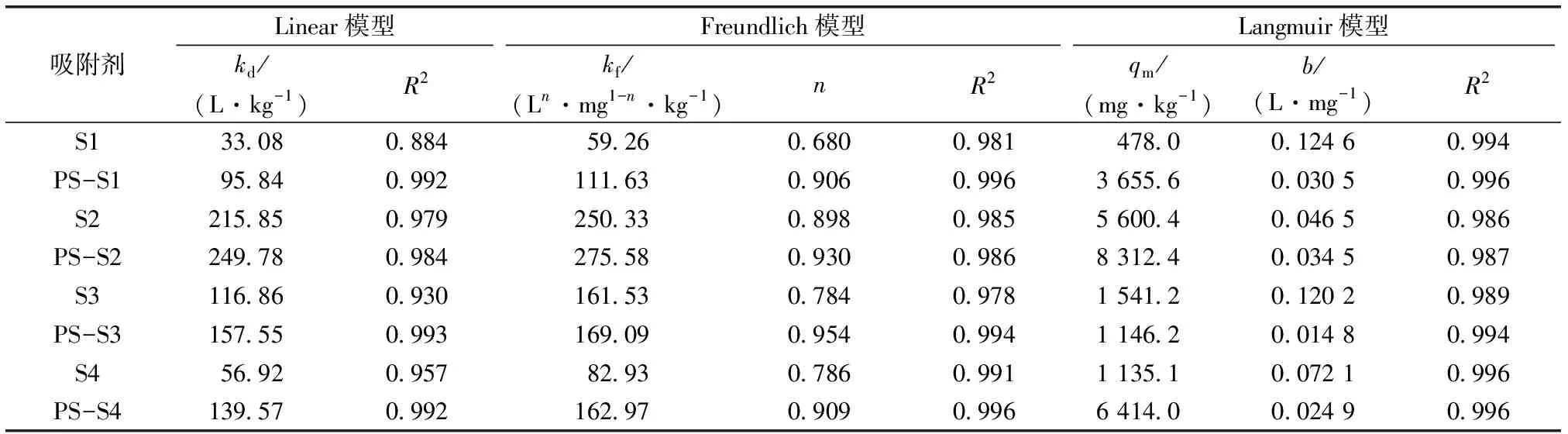
表3 原土壤和含PS土壤对TYL的吸附等温线拟合参数

Ce为吸附平衡时液相TYL浓度,qe为平衡吸附量。S1~S4分别为陕西、安徽、江西和海南土样。
由表3中Freundlich拟合参数可知,PS的加入均显著提高了4种土样的吸附分配系数kf,相应地,平衡吸附量qe也有较显著增加(图4)。由Langmuir模型计算的饱和吸附量qm可知,添加PS后,qm均有较显著的增加,其中对土样S1拟合的饱和吸附量由478.0增加到3 655.6 mg·kg-1,增幅最大,相应地,PS-S1的分配系数kf较S1增加0.88倍。含PS土壤对TYL的吸附能力显著强于原土壤,推断PS的不规则分层和间隙结构增加了土壤中的活性吸附位点,进而促进TYL在土壤上的附着,这与吸附动力学试验得出的结论一致。
2.4 溶液pH和离子强度对吸附的影响分析
溶液pH对含PS土壤吸附TYL的影响见图5,含PS土壤对TYL的吸附能力随pH增加有轻微减弱;这是由于酸性条件下土壤矿物表面带正电荷,TYL+与土壤产生静电排斥[22]。当pH值为3时,带负电荷的PS表面具有较强的静电力,可以促进TYL吸附。当pH值>7.1时,TYL主要以分子形式存在,静电力有所减弱,吸附受疏水性作用影响[23]。GUO等[22]研究了PE等微塑料对TYL的吸附,发现吸附过程由静电作用和疏水性作用主导。
如图5所示,随着离子强度从0增加到0.1 mol·L-1,含PS土壤对TYL的吸附量轻微减少,这是由于抗生素在低离子强度条件下更易被吸附。含PS土壤对TYL的吸附主要由吸附剂表面电荷主导。在高浓度K+溶液中,K+与TYL+在含PS土壤表面的离子交换位点减弱了吸附作用。同时,高浓度K+可能占据带负电荷的微塑料表面,减弱了微塑料对TYL+的静电作用。此外,不断累积的K+压缩了吸附剂的双电层,减弱其对TYL的吸附。这表明离子强度对吸附的影响主要表现为K+和TYL+之间的静电作用对吸附的影响[28]。
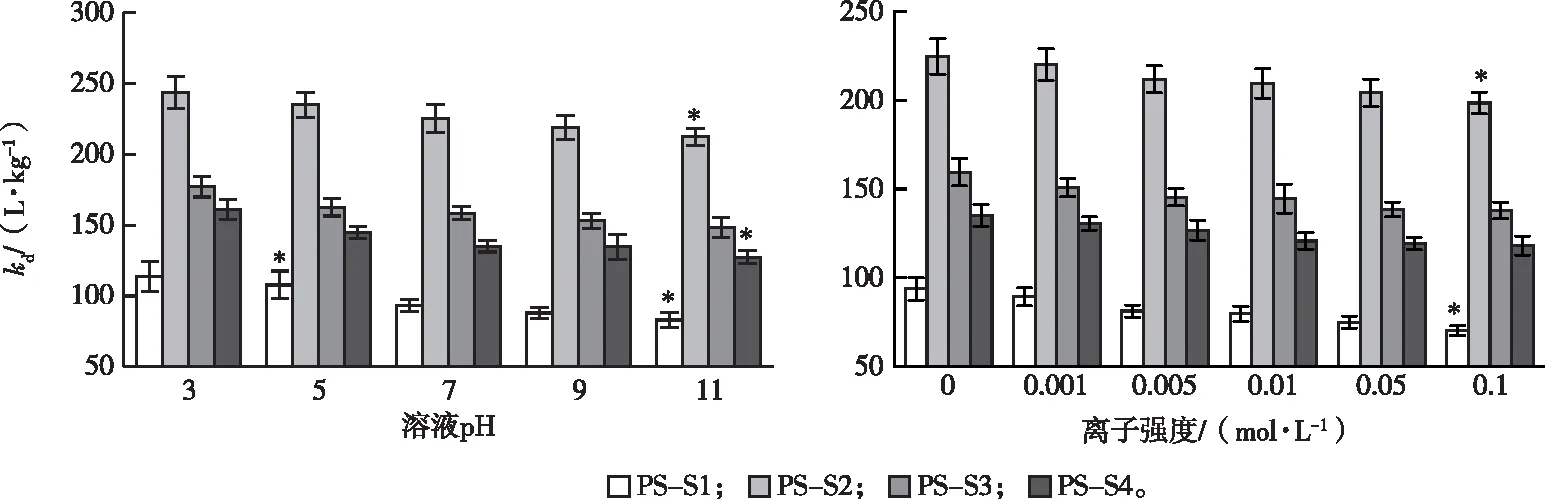
kd为吸附剂线性分配系数。*表示一般线性模型下单变量分析的偏差对比显著性(P<0.05)。
3 结论
(1)原土壤和含PS土壤对TYL的吸附动力学均符合准二级动力学模型,吸附以多相吸附为主;通过颗粒内扩散模型进行拟合发现,土壤对TYL的吸附分为3个过程,其中,颗粒内部扩散是土壤吸附TYL的主导过程。
(2)PS的加入整体上显著增加了土壤对TYL的吸附能力,吸附等温线符合Freundlich和Langmuir模型,吸附过程为物理和化学共同作用的过程。含PS土壤对TYL的吸附能力受溶液pH和离子强度的影响,随着溶液pH或离子浓度的增大而有轻微减弱。

