血清miRNA-210、miRNA-223预测新生儿缺血缺氧性脑病预后的临床价值
赵 颖,马彤辉,郝淑娟
(1.河北省保定市第二中心医院新生儿科,河北 保定 072750;2.河北省保定市第二中心医院儿科,河北 保定 072750)
新生儿缺血缺氧性脑病围产期缺氧窒息导致的脑缺氧缺血损害,导致新生儿智力障碍、脑瘫等,可引起一系列脑病,随着疾病进展可导致新生儿死亡[1-2]。因此,及时发现并评估新生儿缺血缺氧性脑病严重程度对改善患儿预后具有重要意义。但目前可有效评估新生儿缺血缺氧性脑病严重程度的生物学指标较少,寻找可及时、准确评估新生儿缺血缺氧性脑病严重程度及预后的生物学指标是临床研究重点[3-4]。微小核糖核酸(mircoRNA,miRNA)是一类非编码小RNA分析,在中枢神经系统发育、信号通路调节等过程中起到重要作用,在心脑血管疾病诊治中具有重要意义。血清微小RNA-210(mircoRNA-210,miRNA-210)在大脑缺氧缺血性脑水肿中的作用已有报道,微小RNA-223(mircoRNA-223,miRNA-210)水平在心肌损伤相关疾病的作用已被证实,但目前关于miRNA-210、miRNA-223与新生儿缺血缺氧性脑病病情严重程度及预后的关系的尚无报道[5-6]。基于此,本研究通过检测不同疾病严重程度及不同预后患儿血清miRNA-210、miRNA-223表达情况,了解其表达变化与患儿病情严重程度及预后的关系,旨在为新生儿缺血缺氧性脑病预后评估及临床治疗提供依据。
1 资 料 与 方 法
1.1一般资料 选择2019年8月—2021年8月本院新生儿缺血缺氧性脑病患儿124例作为观察组进行回顾性分析,依据患儿病情严重程度将患儿分为轻度组51例、中度组40例、重度组33例,并选取同期60例健康新生儿作为对照组。随访儿出生后28 d内预后情况将患儿分为生存组81例与死亡组43例。
纳入标准:①符合《新生儿缺氧缺血性脑病的诊断和治疗》[7]中的相关诊断标准,出生24 h内经MRI确认存在脑损伤;②入院时间超过1周;③入院时采用新生儿阿氏评分[8](Apgar scores,Apgar)进行评估,出生5 min时Apgar评分不超过7分;④患儿家属知晓并同意研究内容,并签署相关协议。排除标准:①合并其他先天性疾病;②合并呼吸系统或感染性疾病;③脑膜炎或神经系统发育畸形患儿;④非生产或窒息导致的头颅血肿。
本研究符合赫尔辛基宣言中关于医学伦理的相关建议,并获医院伦理委员会批准(2019-KYLN-023)。
1.2方法
1.2.1病情严重程度 依据《新生儿缺氧缺血性脑病的MRI诊断》[9]中患儿病情严重程度判定标准:病灶范围仅限于大脑半球1~5个脑叶为轻度;病灶累及3~5个脑叶,或虽未累及3个以上脑叶,但伴有脑出血或重要功能区受累为中度;病灶累及6~7个脑叶,或虽未累6个以上脑叶,但伴2个以上脑出血或重要功能区灰质受累为重度。
1.2.2血清指标检测 采集入组新生儿出生24 h内空腹静脉血,以3 000 r/min,离心10 min,取上层血清,置于-80 ℃冰箱保存待测。使用QuantoBioRNA提取总RNA,使用RTaseM-LAV逆转为cDNA,采用实时荧光定量PCR进行检测血清miRNA-210、miRNA-223水平。miRNA-210上游引物5′-ATGGTTCGTGGGAGCCCCTGCCC-ACCGCA-3′,下游引物:5′-GTGCAGGGTCCC-GAGGT-3′。miRNA-223正向引物5′-ACACTCCAGCTGGGTGTCAGTTTGTCAAAT-3′,反向引物:5′-TGGTGTCGTGGATTCG-3′。反应条件:95 ℃ 1 min,95 ℃ 10 s,59 ℃ 20 s,共40个循环。以U6为内参,上游引物:5′-CATCCGATAAAATTGGAACGA-3′,下游引物:5′-TTTGTGCGTGTCATCCTTGCG-3′,采用2-△△Ct计算miRNA-210、miRNA-223相对表达量。使用美国BEP2000型全自动酶标仪,使用中国深圳依诺金生物科技有限公司试剂盒,采用酶联免疫吸附法检测血清C反应蛋白、白细胞介素6水平。
1.3观察指标 ①搜集所有入组新生儿分娩孕周、性别、出生时体重、平均日龄等临床资料及血清miRNA-210、miRNA-223表达量并进行分析比较;②检测不同病情严重程度患儿血清miRNA-210、miRNA-223表达,分析其表达与与患儿病情严重程度的关系;③根据患儿出生后28 d内预后情况将患儿分为存活组和死亡组,搜集患儿孕周、分娩方式、性别、出生时体重、日龄、体温、心率、Apgar评分、孕母亲贫血、孕母亲合并糖尿病、孕母亲合并高血压、脐带异常、孕母亲分娩时使用催产素、开始治疗日龄、病情严重程度、白细胞介素6、C反应蛋白、miRNA-210表达量、miRNA-223表达量等资料并进行分析比较,找出影响患儿预后的相关因素,然后进一步进行多因素Logistic回归分析,筛选出影响患儿预后的独立危险因素。④根据血清miRNA-210、miRNA-223表达绘制ROC曲线,以曲线下面积评估其对新生儿缺血缺氧性脑病患儿预后的预测价值,曲线下面积越大,预测价值越高。
1.4统计学方法 应用SPSS 19.0统计软件分析数据。计量资料组内比较采用配对样本t检验,组间比较采用独立样本t检验,多组比较采用单因素方差分析和SNK-q检验;计数资料采用χ2检验;多因素分析采用Logistic回归分析,以ROC曲线下面积评估其对患儿预后的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.12组临床资料及血清miRNA-210、miRNA-223水平比较 观察组患儿与健康对照组新生儿分娩孕周、性别、出生时体重、平均日龄等临床资料比较差异无统计学意义(P>0.05);而观察组患儿血清miRNA-210、miRNA-223表达量均高于健康对照组(P<0.05),见表1。
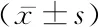
表1 2组研究对象临床资料及血清miRNA-210、miRNA-223水平比较Table 1 Comparison of clinical data and serum miRNA-210 and miRNA-223 levels between two groups
2.2不同病情程度患儿血清miRNA-210、miRNA-223水平比较 重度组患儿血清miRNA-210、miRNA-223水平高于轻度组和中度组患儿,且组间比较差异有统计学意义(P<0.05),见表2。
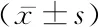
表2 不同病情程度患儿血清miRNA-210、miRNA-223水平比较Table 2 Comparison of serum miRNA-210 and miRNA-223 levels in children with different disease severity
2.3不同预后患儿临床资料比较 单因素分析结果显示,开始治疗日龄、Apgar评分、缺血缺氧性脑病病情严重程度、白细胞介素6、C反应蛋白、血清miRNA-210表达量、血清miRNA-223表达量与新生儿缺血缺氧性脑病患儿预后有关(P<0.05),见表3。
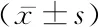
表3 不同预后患儿临床资料比较Table 3 Comparison of clinical data of children with different prognosis
2.4影响新生儿缺血缺氧性脑病患儿预后的多因素Logistic回归分析 多因素分析结果显示,开始治疗日龄高于2.25 d(OR=3.554,95%CI:1.300~9.713)、病情严重程度未重度(OR=4.450,95%CI:2.189~9.048)、血清miRNA-210升高(OR=3.117,95%CI:1.598~6.082)、血清miRNA-223升高(OR=3.384,95%CI:1.790~6.398)是影响新生儿缺血缺氧性脑病患儿预后的独立危险因素(P<0.05),见表4。

表4 影响新生儿缺血缺氧性脑病患儿预后的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of factors affecting the prognosis of newborns with neonatal hypoxic-ischemic encephalopathy
2.5血清miRNA-210、miRNA-223对新生儿缺血缺氧性脑病患儿预后的预测价值 血清miRNA-210最佳分界值为1.71时,预测新生儿缺血缺氧性脑病患儿预后的曲线下面积为0.76,此时敏感度为78.62%,特异度为76.35%;miRNA-223最佳分界值为1.48时,预测新生儿缺血缺氧性脑病患儿预后的曲线下面积为0.79,此时敏感度为81.54%,特异度为76.18%;二者联合检测预测新生儿缺血缺氧性脑病患儿预后的曲线下面积为0.85,此时敏感度为86.73%,特异度为75.49%,见图1。
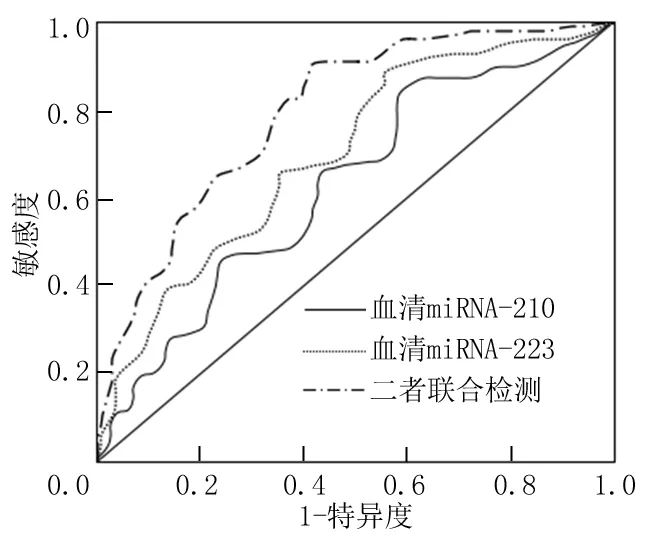
图1 血清miRNA-210、miRNA-223预测新生儿缺血缺氧性脑病患儿预后的ROC曲线
3 讨 论
新生儿缺血缺氧性脑病是缺血、缺氧引起脑水肿、脑坏死,进而导致的脑组织病理改变,脑微血管缺氧及血流减少,引起脑缺血,血管通透性增高,进而导致脑水肿和神经元坏死,加剧脑缺血,形成恶性循环[10-11]。血清miRNA-210表达上调可通过调节血管生成,参与脑组织缺氧、缺血及神经元损伤过程,血清miRNA-223表达上调可通过调控机体炎症反应,加剧脑水肿,进而参与新生儿缺血缺氧性脑病疾病进展过程,对患儿病情及预后评估具有重要价值。
本研究结果显示,观察组患儿血清miRNA-210、miRNA-223表达水平较高,且其水平随患儿病情严重程度的增加而升高,其水平异常升高对评估,新生儿缺血缺氧性脑病病情严重程度具有重要指导意义。这主要是因为miRNA-210在调控血管生成、细胞迁移、细胞分化等方面发挥重要作用,已被广泛应用于多种神经疾病、脑卒中、心力衰竭等疾病诊断中[12-13]。miRNA-210表达上调可促进脑神经营养因子、原肌球蛋白相关激酶异构体B表达降低,进而导致脑组织缺血、缺氧[14-15]。并通过调节内皮细胞迁移、分化及毛细血管网形成,诱导血管再生,导致脑组织缺血缺氧、神经元损伤,进而参与新生儿缺血缺氧性脑病发生、发展过程,提示miRNA-210可作为评估病情严重程度的重要生物标志物之一[16-17]。miRNA-223表达上调,可通过调节炎症细胞发育、活化,影响机体炎症反应,进而参与缺血、缺氧引起的脑组织水肿过程,并通过刺激血管平滑肌细胞增殖,引起脑组织微血管损伤,加剧脑组织缺血、缺氧,导致脑损伤[18-19]。因此,miRNA-223可通过了解脑组织水肿程度,评估患儿脑损伤程度。因此,可通过靶向调控miRNA-210、miRNA-223表达,改善脑组织缺血缺氧情况,进而缓解病情,推测miRNA-210、miRNA-223可作为治疗新生儿缺血缺氧性脑病的潜在靶点。
并且,比较不同预后患儿血清miRNA-210、miRNA-223表达水平发现,死亡组患儿血清miRNA-210、miRNA-223表达高于存活组,且Logistic回归分析结果显示,血清miRNA-210、miRNA-223是影响新生儿缺血缺氧性脑病患儿预后的独立危险因素。说明血清miRNA-210、miRNA-223表达与新生儿缺血缺氧性脑病患儿预后密切相关,其表达上调对于预测患儿不良预后具有重要提示作用。这主要是因为血清miRNA-210表达水平变化可评估患儿脑组织损伤程度,进而帮助评估新生儿缺血缺氧性脑病患儿病情严重程度,其表达上调,患儿脑损伤越严重,预后越差[20-21]。血清miRNA-223表达水平变化可评估脑水肿程度,进而有助于新生儿缺血缺氧性脑病患儿病情评估,其表达上调,脑组织水肿程度越严重,脑损伤越严重,进而导致预后不良。血清miRNA-210、miRNA-223表达与患儿病情变化程度及损伤程度保持一致,提示其对评估新生儿缺血缺氧性脑病患儿预后具有重要指导意义[22-23]。ROC曲线证实,血清miRNA-210最佳分界值为1.71时、miRNA-223最佳分界值为1.48时对预测新生儿缺血缺氧性脑病患儿预后具有较好预测价值,且联合检测预测价值更高。这可能是因为联合检测通过优势补互补可更全面评估患儿脑损伤程度,进而帮助病情及预后评估[24]。但由于本研究样本有限,且miRNAs是一个复杂的过程,还需扩大样本,证实其可行性,进而为临床治疗及干预提供可靠依据。
综上所述,新生儿缺血缺氧性脑病患儿血清miRNA-210、miRNA-223上调,其表达上调是影响患儿预后不良的独立危险因素,对新生儿缺血缺氧性脑病患儿病情严重程度及预后评估具有重要参考意义。

