脂肪间充质干细胞对脑出血大鼠自噬的影响及机制探究
范语彤,白兆荣,张耀国,李鹏飞,高俊玲,周洪霞*
(1.华北理工大学基础医学院人体解剖学系,河北 唐山 063000;2.河北省慢性疾病基础医学重点实验室暨唐山市慢性病临床基础研究重点实验室,河北 唐山 063000)
脑出血(intracerebral hemorrhage,ICH)是由于多种原因(如高血压、动静脉血管畸形、脑淀粉样变性、烟雾病等)诱发的脑实质内血管破裂出血的病理现象,占全部脑卒中患者总数的15%,患者1个月的病死率高达30%~50%,是导致我国居民残疾和死亡的主要原因之一。虽然ICH在临床上通过药物或手术治疗取得显著进展,但预后较差,易导致其他器官功能障碍,需要进一步寻找治疗脑出血的有效方法。近年来研究[1]发现间充质干细胞(mesenchymal stem cells,MSCs)自我繁殖力强、旁分泌、无免疫排异等生物特性备受关注,可用于治疗中枢神经系统疾病的潜在疗法。脂肪间充质干细胞(adipose derived mesenchymal stem cells,ADSCs)是MSCs中的一种,Han等[2]通过体内外培养ADSCs发现其可分化为神经样细胞及其他中胚层细胞,并拥有神经形态,其取材方便、分化能力均优于骨髓间充质干细胞。这提示ADSCs可用于治疗神经系统疾病的理想干细胞,有广泛的应用前景。但目前关于ADSCs移植在ICH治疗中的应用和研究鲜少报道,其机制仍不清楚。ICH损伤的病理机制包括氧化应激、自噬、凋亡、炎症反应等,其中自噬是目前关注度较高的机制之一[3]。在ICH大鼠模型中,通过透射电镜通可观察到血肿周边组织细胞中存在大量自噬小体结构,细胞自噬参与调控脑组织的损伤与凋亡[4]。He等[5]研究发现骨髓间充质干细胞移植治疗缺血再灌注损伤大鼠,可通过抑制自噬相关蛋白LC3和Beclin1的表达而达到脑保护作用。ADSCs作为与骨髓来源的干细胞有着相似生物特性的中胚层细胞,自噬是否可成为ADSCs发挥作用的潜在治疗靶点?因此,本实验将大鼠脂肪组织来源的干细胞作为治疗细胞,通过右侧纹状体注射给脑出血模型,研究ADSCs移植对ICH大鼠治疗作用并探讨其对自噬的影响及可能作用机制,为临床上治疗脑出血提供新的治疗靶点和方向。
1 材 料 与 方 法
1.1主要试剂与仪器 完全培养基12(dulbecco′s modified eagle media:nutrient mixture F-12,DMEM/F12)、Ⅳ型胶原酶均购自美国Hyclon公司;胰蛋白酶、青-链霉素购自美国GIBCO BRL公司;异硫氰酸荧光素-黏附分子29(fluorescein isothiocyanate-adhesion molecular-29,FITC-CD29)抗体、异硫氰酸荧光素-黏附分子45(fluorescein isothiocyanate-adhesion molecular-45,FITC-CD45)抗体、异硫氰酸荧光素-黏附分子90(fluorescein isothiocyanate-adhesion molecular-90,FITC-CD90)抗体均购自美国Biolegend公司,LC3抗体、Beclin1抗体购自日本MBL公司;PV-6000通用型二步法免疫组织化学检测试剂盒、3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色剂购自北京中杉金桥生物公司;蛋白质定量试剂盒自联科生物;p-AKT抗体、p-mTOR抗体购自Cell Signaling Technology公司;山羊抗兔IgG HRP购自Biosharp公司;鼠脑立体定位仪购自美国Stoelting公司,微量进样器购自上海医学仪器厂,牙科钻购自深圳瑞沃德公司,OLYMPUS光学显微镜、数码医学图像分析系统、全自动显微镜扫描系统均购自日本Olympus公司,凝胶成像分析系统、生物分子成像仪购自美国Bio-rad有限公司,透射电子显微镜购自日本Hitachi公司,双转盘共聚焦显微镜购自德国Leica公司。
1.2实验动物及分组 清洁级(specific pathogen free,SPF)雄Sprague-Dawley大鼠220只,8~11周龄,体重(220+80) g,购于北京阜康生物科技股份有限公司,饲养于在华北理工大学实验动物中心动物房饲养,温度22~25 ℃,湿度控制在(40±5)%,自由摄水摄食。适应饲养7~10 d后,将其随机分为3组:Sham组、ICH组和ADSCs组。
1.3方法
1.3.1大鼠ADSCs的分离与培养 随机选取10只健康6~8周龄SD大鼠,通过腹腔注射3%戊巴比妥钠(0.2 mL/100 g)麻醉大鼠,断颈处死后用75%酒精浸泡约5 min,无菌条件下,在超净工作台取大鼠腹股沟部周围脂肪,将其表面附着的毛细血管剔除干净后用含有2%双抗的PBS冲洗三遍,加入1.5 mL完全培养基剪碎脂肪,直到组织变为液体状,加入氨基酸和葡萄糖(dulbecco′s modified eagle media,DMEM)完全培养基,离心机1 500 r/min离心5 min,废弃中间分离出的含各组DMEM的培养基,加入含有200 mg/L浓度的Ⅳ型胶原酶溶液,于37 ℃水浴箱中消化60 min,消化完成后,离心机1 000 r/min离心5 min,废弃上清液,于细胞沉淀中加入DMEM完全培养基吹打重悬细胞并接种于培养瓶中。放入37 ℃、5% CO2细胞培养箱中培养,细胞稳定3 d后换液,细胞浓度铺满培养瓶底95%后进行传代。
1.3.2鉴定ADSCs免疫表型 收集第4代生长良好的脂肪间充质干细胞制备细胞悬液,4 ℃保存备用,离心机1 000 r/min离心10 min,弃上清液,4支流式细胞管收集细胞,滴加磷酸盐缓冲液(细胞密度为1×103个/μL),每支100 μL,其中3支分别滴加FITC标记的兔抗大鼠CD29、CD45和CD90(稀释倍数为1∶30)各10 μL(细胞密度1×103个/μL),另1支作为空白对照,4 ℃避光孵育40 min,再次离心机1 000 r/min离心5 min,废弃上清液,磷酸盐缓冲液洗涤并重悬细胞,流式细胞仪上检测细胞的CD29、CD45和CD90阳性表达率。
1.3.3脑出血模型制备 制备ICH模型的大鼠需进行术前8 h禁食、禁水6 h,ICH组和ADSCs组采用大鼠自体尾动脉血注血法[6]。ICH组:大鼠称重后,用3%戊巴比妥钠(0.2 mL/100 g)经腹腔注射,麻醉后固定于大鼠脑立体定位仪上,从大鼠尾动脉抽取55 μL自体血缓慢注入大鼠右侧基底节(前囱后0.2 mm,旁开3.5 mm,深6 mm),以10 μL/min的速度注血,注射完成后留针5min后退针2 mm,再留针3 min,以1 mm/min的速度缓慢退针防止血液反流,随后骨蜡密封,缝合头皮,将大鼠放置恒温室观察至动物苏醒。Sham组按同样的方法但不注入自体血。ADSCs组:ICH模型造模成功2 h后,于大鼠右侧纹状体区域注射5 μL含有1×105个ADSCs,Sham组和ICH组相同位置给予同等剂量生理盐水。
1.3.4大鼠神经功能评分 待术毕各组大鼠清醒后按照改良的Zea-Longa[7]由轻到重8级(0~7分)评分标准法对大鼠进行神经功能缺损评分:大鼠无任何不对称神经缺损行为0分;提起尾倒挂时左前肢不能完全伸展为1分;于1分的基础上左前肢活动出现明显障碍为2分;大鼠左前肢紧贴胸壁为3分;大鼠自由活动行走时向左侧转圈为4分;行走时伴有明显左前后爪后推动作为5分;围绕原地旋转为6分;左侧完全不能行走,躺向左侧为7分。
1.3.5脑组织取材及病理观察 在各组大鼠术后对应的各时间点,将大鼠用3%戊巴比妥(0.2 mL/100 g)深度麻醉后,打开大鼠胸腔,于心脏主动脉处先用至少40 mL的磷酸缓冲盐溶液(phosphate buffer saline,PBS)灌注后再用至少200 mL的4%多聚甲醛灌注20 min后剖取完整脑组织。于4%多聚甲醛溶液中浸泡固定24 h以上,用于以下实验:苏木精-伊红染色(hematoxylin-eosin staining,HE)、尼氏染色及免疫组织化学检测。
1.3.6脑组织HE染色 制备好的石蜡切片脱蜡至水后,苏木素染核1 min,90%盐酸酒精分化8 s,自来水中返蓝8 min后,伊红染色30 s,经乙醇低浓度到高浓度梯度迅速分化,再经二甲苯透明、中性树胶封片,常温晾干后用显微镜观察脑组织病理变化并采图。
1.3.7脑组织尼氏染色 将石蜡切片常规脱蜡至水后于37 ℃焦油紫染色液浸染1 h。由低浓度到高浓度梯度的乙醇迅速分化,后经二甲苯脱水、中性树胶封片,常温晾干后用显微镜观察未受损神经元数量并采图。
1.3.8脑组织含水量(brain water content,BWC)测定 将取得的前半部分立体定位注射周围厚度为2 mm脑组织,用滤纸吸干脑组织表面的血液和水分,用电子分析天平称出湿重记录后放入恒温箱内100 ℃烘至恒重后测干重。按Elliott公式计算脑组织含水量(BWC%)=[(脑湿重-脑干重)/脑湿重]×100%。
1.3.9免疫组织化学检测 脑组织石蜡切片脱蜡至水,高压锅高压抗原修复3 min充分暴露抗原决定簇后,加入3%内源性过氧化物酶阻断剂温室封闭15 min,分别滴加稀释好的一抗4 ℃孵育过夜,二抗37 ℃孵育箱中孵育30 min,再滴加DAB显色剂湿盒中避光显色3~5 min,于显微镜下观察到棕黄色颗粒,纯水终止反应,苏木素复染核,经梯度酒精脱水,二甲苯脱水、透明、干燥后中性树胶封片,显微镜下观察、记录并分析。分别测定LC3、Beclin1、p-AKT、p-mTOR的表达水平。
1.3.10Western Blot检测 每只称取脑组织60~80 mg,少量液氮冷却后使用组织研磨仪研磨至粉末状,加入蛋白裂解液,离心后取上清,提取蛋白后用蛋白定量试剂盒进行蛋白定量。凝胶电泳分离蛋白,转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)上,上样完电泳1 h,恒流220 mA,5%的封闭液摇床上封闭2 h,Ⅰ抗4 ℃孵育过夜,加入Ⅱ抗孵育2 h后,用电化学发光(enhanced chemiluminescent,ECL)显影后分析蛋白条带灰度值。分别测定LC3、Beclin1、p-AKT、p-mTOR的蛋白表达水平。
1.4统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用单因素方差分析,组间两两比较采用SNK-q检验;大鼠术后不同时间点神经学检查评分、脑组织未受损神经元计数和脑组织水含量采用重复测量方差分析。应用Graphad prism8.0和Image J绘制数据结果和图片。P<0.05为差异有统计学意义。
2 结 果
2.1大鼠ADSCs的鉴定 运用流式细胞术检测ADSCs表面标记物,所培养的大鼠细胞中黏附分子CD29和CD90的阳性率分别为96.6%、96.7%,CD29、CD90呈阳性表达,CD45的阳性率为0.37%,CD45呈阴性表达。结果提示培养的细胞符合脂肪间充质干细胞纯度的评价标准(图1)。

图1 ADSCs 表面标记物的流式细胞术检测结果A.CD29;B.CD90;C.CD45Figure 1 Results of flow cytometry de-tection of surface markers of ADSCs
2.2ADSCs移植后可改善ICH大鼠神经功能障碍 实验取各组术后12 h、1 d、3 d、5 d、7 d对大鼠进行Zea Longa神经功能评分。Sham组大鼠在完全清醒后未出现行为学改变,反应灵敏,与假手术组大鼠相比较,ICH组大鼠神经功能评分显著升高,于术后12 h逐渐升高,3 d达至高峰,之后逐渐下降(P<0.05);与ICH组相比较,ADSCs组对应的各时间点神经功能评分明显降低,差异均有统计学意义(P<0.05),见表1。结果提示脂肪间充质干细胞移植可改善脑出血大鼠神经功能障碍。
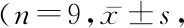
表1 不同时间点大鼠神经学检查评分比较Table 1 Comparison of neurological examination scores of rats at different time points 分)
2.3ADSCs移植可改善ICH大鼠脑损伤程度 光学显微镜下观察脑组织HE染色结果显示,假手术组脑组织完整,细胞排列整齐、间质无水肿、无炎性细胞浸润。与Sham组比较,ICH组脑出血后第3天大鼠脑组织基底节周围明显占位效应,大鼠脑组织可见大量红细胞,细胞间隙变大、水肿,炎细胞浸润及大量神经细胞变性坏死,此现象至5 d后有所缓解。与模型组相比,ADSCs组对应的各时间点大鼠脑组织病理症状均明显减轻,较少的红细胞,水肿减少以及较少的神经细胞坏死(图2)。结果提示脂肪间充质干细胞移植可改善脑出血大鼠脑损伤程度。
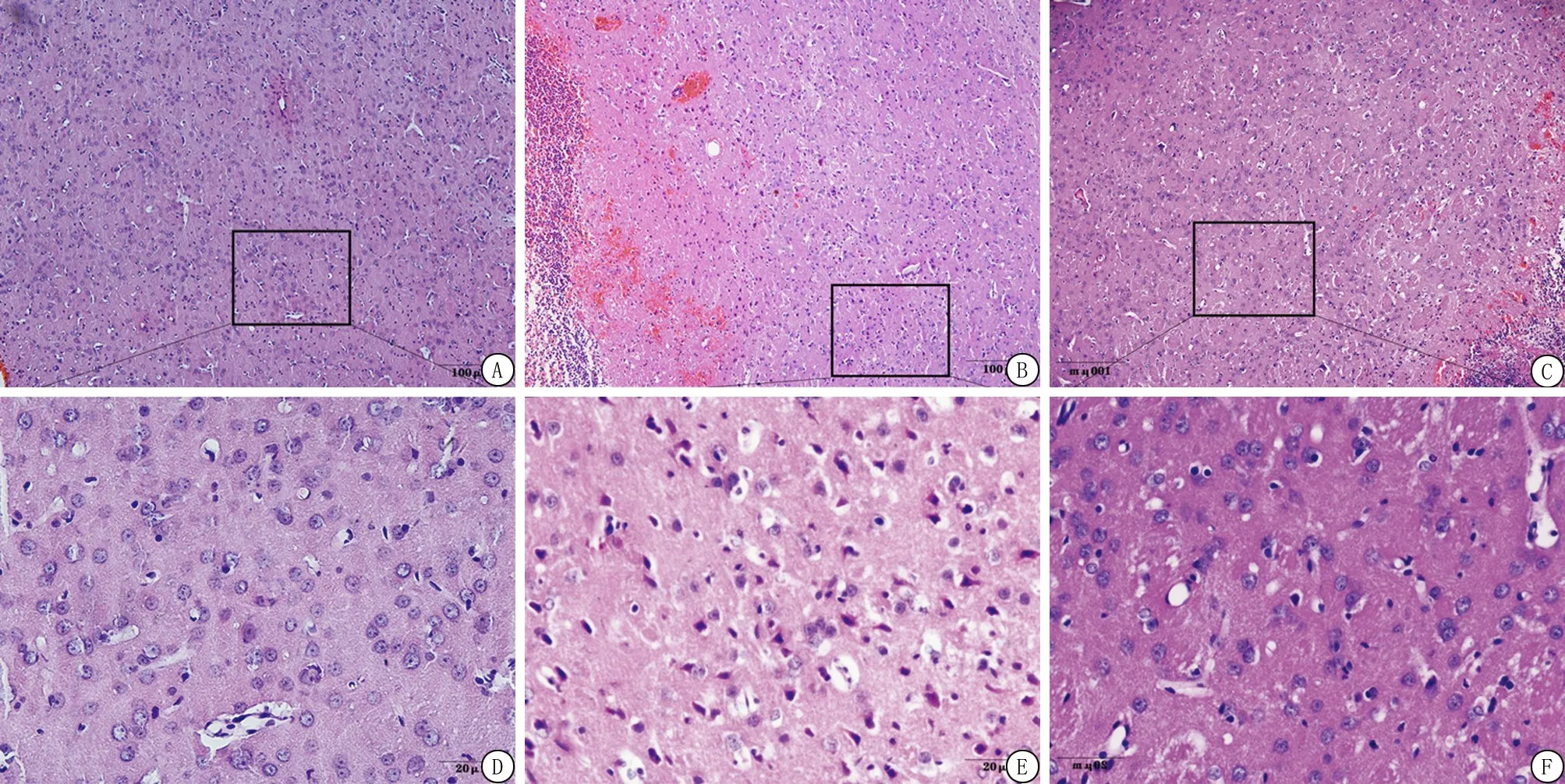
图2 各组大鼠脑组织染色结果(HE染色)
2.4ADSCs移植治疗ICH大鼠减少未受损神经元数量 假手术组神经元细胞尼氏小体形态完整,数量较多。与Sham组相比,ICH组神经细胞尼氏小体结构破坏严重,细胞皱缩,核碎裂,体积减小,12 h未受损的神经元数量开始减少,至3 d时受损的神经元数量达至高峰,5 d后逐渐增多,随机选取5个高倍视野,对细胞核完整的神经元进行计数,差异有统计学意义(P<0.05)。与ICH组相比,ADSCs组相应的各时间点神经元细胞尼氏小体数量明显增加,差异均有统计学意(P<0.05)。结果提示脂肪间充质干细胞移植治疗脑出血大鼠可发挥神经保护作用见图3,表2。
图3 各组大鼠神经细胞尼氏染色结果
表2 各组大鼠脑组织未受损神经元计数Table 2 Counts of undamaged neurons in brain tissue of rats in each group 个)
2.5ADSCs移植改善ICH大鼠脑组织水肿 Sham组大鼠术后脑组织7 d前各时间点几乎无明显的变化。ICH组12 h后脑组织水含量开始升高,至3 d达高峰,随后降低,ADSCs组的脑组织含水量变化趋势与ICH组基本一致,与Sham组相比,ICH组各时间点差异有统计学意义(P<0.05)。与ICH组相比,ADSCs组各时间点脑组织水含量降低,差异有统计学意义(P<0.05),结果提示脂肪间充质干细胞移植可改善脑出血大鼠脑组织水肿情况,见表3。

表3 脑组织水含量变化Table 3 Changes of water content in brain tissue
2.6ADSCs移植抑制LC3、Beclin1阳性细胞表达 与Sham组相比,ICH组7 d内LC3、Beclin1阳性细胞的表达显著增多;与模型组相比,ADSCs组各时间点LC3、Beclin1阳性细胞的表达颜色较浅,数量明显降低;免疫组化法下,LC3、Beclin1阳性表达为棕褐色,LC3、Beclin1阳性表达情况与各蛋白表达水平相符。ADSCs移植后自噬相关蛋白LC3、Beclin1的阳性表达明显降低(图4,5),提示脂肪间充质干细胞移植后可能抑制自噬的过度激活。

图4 Beclin1在大鼠脑组织的表达结果(免疫组织化学染色 ×400)

图5 LC3在大鼠脑组织的表达结果(免疫组织化学染色 ×400)
2.7ADSCs移植增加p-AKT、p-mTOR的阳性细胞表达 与Sham组相比,ICH组7 d内p-AKT、p-mTOR阳性细胞的表达明显增加;与模型组相比,ADSCs组各时间点p-AKT、p-mTOR阳性细胞的表达颜色较深,数量明显增多;免疫组织化学法下,p-AKT、p-mTOR阳性表达为棕褐色,p-AKT、p-mTOR阳性表达情况与各蛋白表达水平相符。ADSCs移植后脑出血大鼠脑组织内p-AKT、p-mTOR阳性表达明显增强(图6,7)。结果提示脂肪间充质移植治疗脑出血大鼠可能激活AKT/mTOR信号通路。
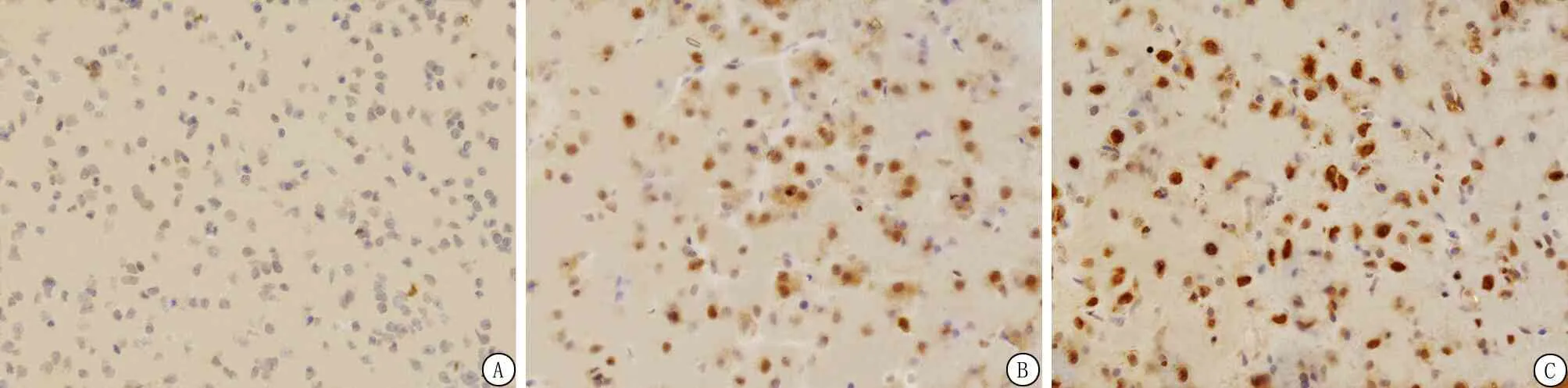
图6 p-AKT在大鼠脑组织的表达结果(免疫组织化学染色 ×400)
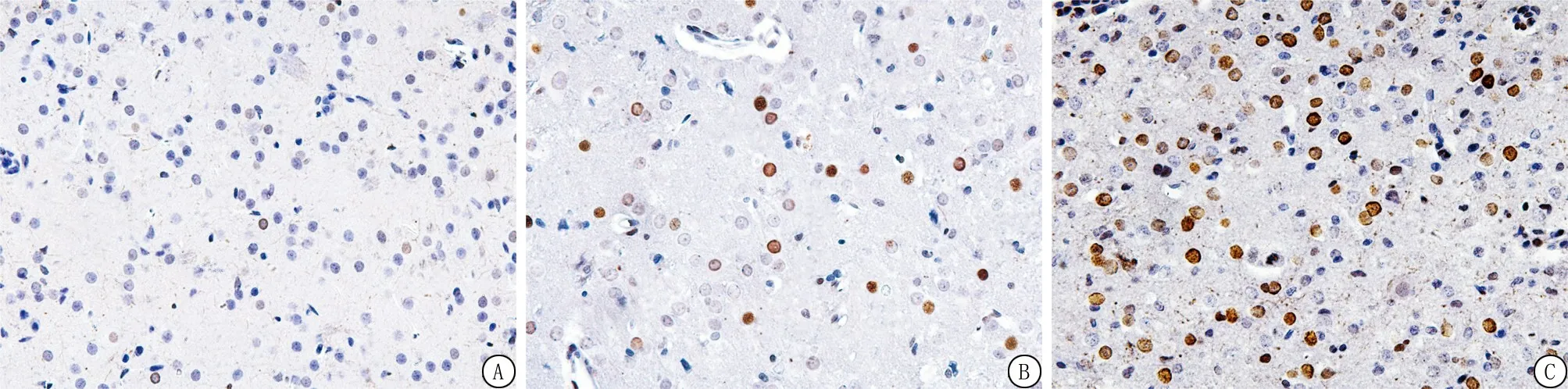
图7 p-mTOR在大鼠脑组织的表达结果(免疫组织化学染色 ×400)
2.8ADSCs移植通过激活AKT/mTOR通路抑制ICH大鼠自噬活性 为了进一步探讨脂肪间充质干细胞移植治疗脑出血的作用机制,本次实验用Western Blot检测3组大鼠1 d、3 d脑组织中自噬相关蛋白LC3、Beclin1及自噬相关通路蛋白p-AKT/AKT、p-mTOR/mTOR的表达情况。与Sham组相比,ICH组LC3、Beclin1的蛋白表达水平明显升高(P<0.05);与ICH组相比,ADSCs组LC3、Beclin1的蛋白表达水平明显降低(P<0.05);ADSCs移植后脑出血大鼠脑组织内LC3、Beclin1蛋白表达水平明显降低(图8,表4,5);与Sham组相比,ICH组AKT/mTOR信号通路磷酸化蛋白的表达水平明显下降(P<0.05);与ICH组相比,ADSCs组AKT/mTOR信号通路磷酸化蛋白的表达水平明显升高;ADSCs移植后脑出血大鼠脑组织内AKT/mTOR信号通路磷酸化蛋白的表达水平明显增强(P<0.05);结果提示脂肪间充质干细胞可能通过激活AKT/mTOR信号通路抑制自噬而达到神经保护作用(图9,表6,7)。
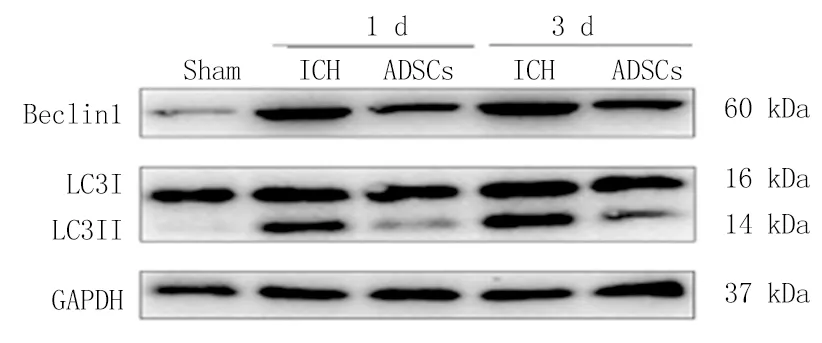
图8 免疫印迹法检测LC3、Beclin1蛋白的表达结果

表4 免疫印迹法检测各组LC3、Beclin1蛋白1 d的表达结果Table 4 Expression results of LC3 and Beclin1 proteins detected by Western blot in each group at 1 d

表5 免疫印迹法检测各组LC3、Beclin1蛋白3 d的表达结果Table 5 Expression results of LC3 and Beclin1 proteins detected by Western Blot in each group at 3 d

图9 免疫印迹法检测AKT/mTOR信号通路磷酸化蛋白的表达结果

表6 免疫印迹法检测各组AKT/mTOR信号通路磷酸化蛋白1 d的表达结果Table 6 The expression of phosphorylated protein of AKT/mTOR signaling pathway detected by Western Blot in each group at 1 d

表7 免疫印迹法检测各组AKT/mTOR信号通路磷酸化蛋白3 d的表达结果Table 7 The expression of phosphorylated protein of AKT/ mTOR signaling pathway detected by Western blot in each group at 3 d
3 讨 论
ICH的致残率和致死率均较高,目前临床上主要运用手术和药物治疗方案,但脑出血患者预后极差,仍不可避免的长期遭受由于血肿周围继发性损伤带来的严重残疾障碍,给其家庭和社会带来沉重的精神和经济负担[8]。因此进一步研究ICH的发病机制和发现安全有效的治疗方案对于ICH患者至关重要。ICH后神经损伤不可再生是导致患者预后较差的主要原因之一[9],MSCs移植是目前再生医学研究的热门,MSCs多向分化潜能在一定条件下,可分化为多种组织细胞,一定程度上可修复受损的组织[10]。随着对不同来源的MSCs研究的深入,因ADSCs来源丰富、取材方便且免疫排斥小等特点,受到越来越多研究者们的青睐。人体脂肪中含有充足的ADSCs,每毫升脂剂中干细胞比骨髓中干细胞数高约8倍。即使老龄患者来源的ADSCs也具有取材方便且抗衰老能力强等优点[11]。ADSCs可分化为神经样细胞及其他中胚层细胞,并拥有神经形态[12]。Gómez-Pinedo等[13]研究发现ADSCs移植脑卒中小鼠,修复受损脑组织内的胶质细胞源性神经营养因子和脑源性神经营养因子分泌,促进血管生成,从而恢复大鼠神经功能。可见,ADSCs有望成为治疗ICH的良好种子,但目前关于ADSCs移植治疗ICH的研究鲜少报道。为探究ADSCs移植对ICH后引起的继发性损伤的影响,本实验采用右侧纹状体的注射方式将ADSCs移植到大鼠脑内,结果显示与ICH组相比,ADSCs移植后的7 d内明显改善了ICH大鼠神经功能障碍、减少神经细胞的坏死以及减轻脑组织水肿情况。提示ADSCs移植有效改善脑出血大鼠的神经功能,但具体机制尚未完全明确。
脑出血的病理机制主要包括原发性脑损伤和继发性脑损伤,原发性脑损伤是脑出血后血肿对邻近脑组织的占位效应。继发性脑损伤是在原发性脑损伤的基础上引起周围脑组织发生连锁的病理生理反应如炎症、细胞凋亡、自噬、脂质过氧化等[14]。其中自噬过度激活会导致多种疾病继发性损伤,甚至导致细胞死亡[15]。研究发现抑制自噬活性可减轻ICH后引起的继发性脑损伤[16]。因此,寻找有效的治疗药物抑制细胞自噬,对治疗脑出血疾病有重要意义。Mazen等[17]研究发现ADSCs移植对大鼠小脑损伤有一定修复作用。自噬的调节作为MSCs治疗应用中的潜在治疗靶点[18]。为探究ADSCs移植是否通过抑制自噬活性减轻ICH后引起的继发性损伤。本实验采用免疫组织化学和Western Blot法对自噬重要的蛋白标记物LC3和自噬启动的标志Beclin1进行了检测,结果显示,与ICH组相比,ADSCs移植后,损伤的脑组织中自噬相关蛋白LC3、Beclin1的表达及表达量明显降低,LC3-Ⅰ向LC3-Ⅱ转化能力被降低,抑制了自噬水平,提示ADSCs移植治疗ICH改善大鼠神经功能的障碍、减少神经细胞的坏死以及减轻脑组织水肿情况与抑制自噬活性有关。如何实现自噬抑制需要进一步探讨。
近年来,AKT/mTOR信号通路在脑出血中的作用成为研究热点,在细胞的增殖、凋亡、自噬以及生长等过程中发挥着重要的作用[19]。该通路已被证实在诱导细胞自噬的发生发展方面发挥了最直接的调控作用[20],该通路中mTOR即是大分子底物复合物,又是哺乳动物中雷帕霉素的分子靶标如ULJ1、atg13等因子。mTOR的活化可对自噬产生负调节作用,磷酸化的AKT可激活mTOR,mTOR将ULK1激酶充分激活后会抑制下游分子ULK1复合物从而有效抑制自噬。在神经疾病动物模型中通过PI3K/AKT/mTOR信号通路能减少神经元损伤、促进新生血管生成等[21-22]。Yan等[23]研究发现加巴喷丁通过激活PI3K/AKT/mTOR信号通路,抑制神经细胞自噬和活性氧的水平,进而对脑缺血再灌注损伤发挥神经保护作用。Xu等[24]研究发现ADSCs通过调节PI3K/AKT/mTOR信号通路减少细胞凋亡,改善二氯化二丁基锡诱导的慢性胰腺炎。在本研究中,ADSCs移植后,Western Blot检测结果显示,与ICH模型组相比,脑组织中AKT/mTOR信号通路相关蛋白的表达增加,LC3、Beclin1的蛋白表达随之降低,与免疫组织化学结果一致。提示ADSCs移植治疗ICH可能激活AKT/mTOR信号通路抑制细胞自噬,发挥神经功能保护性作用。
综上所述,ICH后及时进行ADSCs的移植对修复出血周围继发性脑组织损伤,恢复神经功能有积极的促进作用,也为临床治疗脑出血提供新的方向和治疗靶点。本实验中ADSCs移植后未进行透射电镜观察自噬小体的变化,且ADSCs移植治疗ICH的具体作用机制尚不能完全明确以及缺少移植后进行长期疗效的研究。ADSCs在体内分化机制、旁分泌、免疫调节等良好的生物特性,其最佳的移植时间窗、治疗剂量及植入途径等都需作进一步的研究和探索。

