桂皮醛通过mTOR和STAT3调控记忆性T细胞促进心脏移植物长期存活的作用及机制研究
李师亮 方明 周彦

〔摘要〕 目的 探索桂皮醛誘导记忆性心脏移植耐受的作用及潜在分子机制。方法 将60只小鼠随机分为正常对照组(假手术,n=10)、手术组(心脏移植,n=10)、模型组(注射T细胞+心脏移植,n=10)、桂皮醛低浓度组(注射T细胞+心脏移植+10 mg/kg桂皮醛,n=10)、桂皮醛中浓度组(注射T细胞+心脏移植+20 mg/kg桂皮醛,n=10)和桂皮醛高浓度组(注射T细胞+心脏移植+40 mg/kg桂皮醛,n=10)。观察各组移植物平均存活时间、移植物排斥程度,检测脾细胞增殖情况、移植物中相关基因白细胞介素-2(interleukin-2, IL-2)、白细胞介素-10(interleukin-10, IL-10)、γ-干扰素(interferon-γ, IFN-γ)和转化生长因子-β(transforming growth factor-β, TGF-β)的相对表达量,以及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)与信号转导及转录激活因子3(signal transduction and activator of transcription3, STAT3)蛋白磷酸化的表达情况。结果 (1)与正常对照组相比,手术组存活时间明显缩短(P<0.05);与手术组相比,模型组存活时间明显缩短(P<0.05);与模型组相比,桂皮醛高浓度组的平均存活时间显著延长(P<0.05)。(2)对各组移植物排斥程度进行评估,模型组为Ⅳ级,桂皮醛治疗组的移植物排斥程度显著降低,且具有剂量依赖性。(3)与正常对照组相比,手术组及模型组脾细胞OD值升高(P<0.05);与模型组及桂皮醛低浓度组相比,桂皮醛中、高浓度组脾细胞OD值降低(P<0.05)。(4)与正常对照组相比,手术组IL-2、IFN-γ mRNA表达显著上调(P<0.05),IL-10、TGF-β mRNA表达显著下调(P<0.05);与手术组相比,模型组IL-2、IFN-γ mRNA表达显著上调(P<0.05),IL-10、TGF-β mRNA表达显著下调(P<0.05);与模型组比较,桂皮醛中、高浓度组移植物中IL-2、IFN-γ mRNA表达明显下调(P<0.05),桂皮醛中、高浓度组IL-10、TGF-β mRNA表达明显上调(P<0.05)。(5)与正常对照组相比,手术组p-mTOR、p-STAT3蛋白表达显著上调(P<0.05);与手术组相比,模型组p-mTOR、p-STAT3蛋白表达显著上调(P<0.05);与模型组比较,桂皮醛中、高浓度组移植物中p-mTOR、p-STAT3蛋白表达明显下调(P<0.05)。结论 对于记忆性心脏移植模型,高浓度桂皮醛可以获得移植物长期耐受,其机制可能是通过抑制mTOR和STAT3的表达,降低移植物记忆性T细胞的免疫应答水平。
〔关键词〕 桂皮醛;记忆性T细胞;哺乳动物雷帕霉素靶蛋白;信号转导及转录激活因子3;心脏移植
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.008
Mechanism of cinnamaldehyde in regulating long-term survival of cardiac grafts
induced by memory T cells through mTOR and STAT3
LI Shiliang1, FANG Ming2, ZHOU Yan2*
1. Department of Cardiology and Vascular Surgery, Tongji Hospital of Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei 430030, China; 2. Department of Otolaryngology, Head and Neck Surgery, Union Hospital of Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei 430022, China
〔Abstract〕 Objective To explore the role of cinnamaldehyde in tolerance of memory heart transplantation as well as its potential molecular mechanism. Methods A total of 60 mice were randomly divided into normal control group (sham operation), operation group (heart transplantation), model group (T cells injection+heart transplantation), low-dose cinnamaldehyde group (T cells injection+heart transplantation+10 mg/kg cinnamaldehyde), medium-dose cinnamaldehyde group (T cells injection+heart transplantation+20 mg/kg cinnamaldehyde) and high-dose cinnamaldehyde group (T cells injection+heart transplantation+40 mg/kg cinnamaldehyde), with 10 mice in each group. The average graft survival time and graft rejection degree of each group were observed to detect the proliferation of spleen cells, the relative expression amount of interleukin-2 (IL-2), interleukin-10 (IL-10), interferon-γ (IFN-γ) and transforming growth factor-β (TGF-β), and the expression of protein phosphorylation of mammalian target of rapamycin (mTOR) and signal transduction and activator of transcription3 (STAT3) in the related genes. Results (1) Compared with normal control group, the survival time of operation group was significantly shorter (P<0.05); compared with the operation group, the survival time of the model group was also significantly shorter (P<0.05); compared with the model group, the average survival time of high-dose cinnamaldehyde group was significantly prolonged (P<0.05). (2) The degree of graft rejection in each group was scored according to the HE staining results. The score showed that the model group was grade Ⅳ, and the degree of graft rejection in cinnamaldehyde treatment group was significantly reduced in a dose-dependent manner. (3) Compared with the normal control group, the proliferation of splenocytes in operation group and model group was significantly higher (P<0.05); compared with the model and low-dose cinnamaldehyde groups, the proliferation of splenocytes in the medium- and high-dose groups was reduced (P<0.05). (4) Compared with the normal control group, the mRNA expression of IL-2 and IFN-γ in operation group was significantly up-regulated (P<0.05), while that of IL-10 and TGF-β was significantly down-regulated (P<0.05); compared with the operation group, the mRNA expression of IL-2 and IFN-γ in model group was significantly up-regulated (P<0.05), while that of IL-10 and TGF-β were significantly down-regulated (P<0.05); compared with the model group, the mRNA expression of IL-2 and IFN-γ in the medium- and high-dose groups was significantly down-regulated (P<0.05), but that of IL-10 and TGF-β genes were significantly up-regulated (P<0.05). (5) Compared with normal control group, the expression of p-mTOR and p-STAT3 proteins in operation group was significantly up-regulated (P<0.05); compared with operation group, the expression of p-mTOR and p-STAT3 protein in model group was significantly up-regulated (P<0.05); compared with model group, the expression of p-mTOR and p-STAT3 proteins in the medium- and high-dose groups was significantly down-regulated (P<0.05). Conclusion In the memory heart transplantation model, high concentration of cinnamaldehyde can achieve long-term graft tolerance, which may decrease the immune response level of graft memory T cells by inhibiting the expression of mTOR and STAT3.
〔Keywords〕 cinnamaldehyde; memory T cells; mammalian target of rapamycin; signal transduction and activator of transcription3; heart transplantation
器官移植是终末期器官衰竭患者的一项挽救生命的手术,但长期移植生存受到免疫排斥和免疫抑制药物不良反应的限制[1]。记忆性T细胞对移植排斥和耐受有重要影响[2]。异体记忆性T细胞不仅在异体抗原致敏后产生,如输血和先前的移植,而且也可以通过内稳态细胞增殖和异体免疫产生[3-4]。诱导移植耐受的方法在富含异体记忆性T细胞的动物中常常失败,例如,虽然共刺激阻断能有效诱导小鼠移植耐受,但不能防止供体同种异体抗原预致敏小鼠的排斥反应[5-6]。因此,为了更有效地预防移植排斥反应,有必要确定驱动记忆性T细胞反应的关键调节因子。
桂皮醛是中药肉桂的主要活性成分,具有广泛的药理活性,包括抗氧化、抗炎、抗纤维化、抗血栓、降压、抗动脉粥样硬化、抑制前体脂肪细胞的分化与脂质堆积、抗肿瘤以及心脏保护等,显现出广泛的临床应用和开发前景[7]。但桂皮醛对心脏移植物长期存活的作用和分子机制尚待探明。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)控制T细胞反应的多个方面[8]。例如,mTOR促进多个Th细胞亚群的分化和功能,如Th1、Th2、Th17和Tfh细胞[9]。相反,在病毒感染和接种后,mTOR抑制记忆性CD8+T细胞的分化[10]。目前,尚不清楚mTOR是否也对移植环境中的Th和记忆性细胞反应产生这些相反的作用。mTOR在异体T细胞应答中的生物学作用仍需进一步的探索。研究表明,信号转导及转录激活因子3(signal transduction and activator of transcription3, STAT3)具有多种转录调节功能,在生理和发育中发挥作用[11]。在免疫调节方面,STAT3对于特定CD4+T细胞亚群的分化至关重要[12]。而STAT3在T细胞存活中的关键作用最初是通过条件敲除T细胞谱系中的STAT3基因来证明的[13],在这一系统中,已证实IL-6/STAT3信号转导对T细胞具有抗凋亡作用[14]。但STAT3在移植环境中如何调控记忆性T细胞,还有待进一步研究。
因此,本研究探讨桂皮醛能否在移植环境中通过mTOR和STAT3调控记忆T细胞,使得心脏移植物存活期延长。
1 材料
1.1 实验动物
SPF级健康C57BL/6(H-2b)和BALB/c(H-2d)小鼠各60只,雌性,8~12周龄,体质量(20±2) g,由长沙天勤生物技术有限公司提供,实验动物生产许可证号:SCXK(湘)2019-0004。经检疫后饲养在华中科技大学同济医学院附属同济医院动物实验中心SPF级环境内,实验动物使用许可证号:SYXK(鄂)2020-0018,单笼喂养,适应性喂养1周后开始实验。
1.2 药品和主要试剂
桂皮醛(北京西林布克网络科技有限公司,批号:104-55-2);p-mTOR、mTOR、p-STAT3、STAT3、GAPDH(武汉爱博泰克生物科技有限公司,批号:AP0115、A11354、AP0705、A1192、A19056);HE染色试剂盒(上海碧云天生物技术有限公司,批号:KGA224);尼龙毛柱[安诺伦(北京)生物科技有限公司,批号:PS-18369-50];苏木素染液、中性树胶(广州市洁利生物医学有限公司,批号:JLM-111、JLM-4901);丝裂霉素[西格玛奥德里奇(上海)贸易有限公司,批号:M4287-2MG];Trizol试剂(美国英杰生命技术有限公司,批号:15596026);诺唯赞HiScipt Ⅲ逆转录试剂盒(南京诺唯赞生物科技股份有限公司,批号:R323-01)。
1.3 主要仪器
Cyflow Space型流式细胞仪(德国Partec公司);Tanon3500型全自动凝胶成像仪化学发光成像仪(上海天能公司);K3PLUS型酶标仪[宝予德(中国)有限公司];Axiovert200型显微镜(德国卡尔蔡司公司)。
2 方法
2.1 动物模型及分组
SPF级健康C57BL/6小鼠60只,随机均分为6组:正常对照组(假手术,n=10)、手术组(心脏移植,n=10)、模型组(注射T细胞+心脏移植,n=10)、桂皮醛低浓度组(注射T细胞+心脏移植+10 mg/kg桂皮醛,n=10)、桂皮醛中浓度组(注射T细胞+心脏移植+20 mg/kg桂皮醛,n=10)和桂皮醛高浓度组(注射T细胞+心脏移植+40 mg/kg桂皮醛,n=10)。模型组、桂皮醛低浓度组、桂皮醛中浓度组和桂皮醛高浓度组小鼠称重后,尾静脉注射BALB/c小鼠脾脏T细胞,第2天以BALB/c小鼠为供体,移植心脏取下后,用10 mL保存液以1 mL/min的速度冲洗心内血液。心脏移植物采用4 ℃常规威斯康星大学保存液(University of Wisconsin solution, UW)保存。移植前,用10 mL生理盐水冲洗高钾UW溶液,用10 mL过冷灌注液冲洗高渗过冷保存液,兩种冲洗速率均为1 mL/min。植入时,缺血时间标准化为20 min。造模术后将小鼠单笼饲养,37 ℃保温,小鼠能恢复至造模前状态表示造模成功;复搏时间为主动脉停跳至正常周期心室跳动自动恢复的时间,定义为复苏[15]。然后灌胃给予桂皮醛,连续给药21 d,且每天通过视诊和触诊小鼠颈部皮下检查移植心脏侧波动情况。取各组小鼠的心脏组织和血标本。术后通过每天腹部扪诊心脏脉冲来判断心脏移植物存活情况,随着存活时间增加,波动逐渐减弱,直至停止,直接采用剖腹探查证实心跳完全停止[16]。
2.2 皮肤预致敏模型及脾脏T细胞提取[17]
以BALB/c小鼠为供体,C57BL/6小鼠为受体进行背部全层皮肤移植(皮片为圆形,直径>1.2 cm),用手术线固定移植物并包扎。排斥反应被定义为完全丧失活性的表皮移植物组织[6]。皮肤移植4周后,取受体鼠脾脏,用红细胞裂解液裂解红细胞后,过尼龙毛柱,分离出T细胞。
2.3 心脏组织HE染色
石蜡切片65 ℃烘干2 h,二甲苯脱蜡3次,每次10 min,然后置于100%、95%、70%的乙醇溶液各5 min,自来水流水冲洗10 min,滴加1滴(50~100 μL)苏木素染液染色5~10 min,蒸馏水冲掉染液,滴加1滴(50~100 μL)伊红染液染色2 min,自来水冲洗,放入烘箱(50~60 ℃)烘干。中性树胶封片,镜下观察。
2.4 移植心脏病理学诊断标准
根据国际心肺移植协会(International Society for Heart and Lung Transplantation, ISHLT)标准,通过检查白细胞浸润程度和心肌细胞的解剖破坏程度对心脏排斥评分(0~6分)进行分级,具体分为0级、ⅠA级、ⅠB级、Ⅱ级、ⅢA级、ⅢB级、Ⅳ级。
2.5 细胞增殖能力测定
取受体鼠T细胞与供体鼠脾细胞(丝裂霉素处理)进行混合淋巴反应(mixed lymphocyte reaction,MLR),采用细胞增殖实验5-溴脱氧尿嘧啶(5-bromodeoxyuridinc, BrdU)法测定各组OD值。
2.6 实时荧光定量PCR法
运用Trizol法提取细胞或组织的总RNA,测量RNA浓度后,用无RNase的DEPC水将RNA稀释成500 ng/μL。按照如下方案配制逆转录体系:总RNA(1 μL)、5×PrimeScript RT Master Mix(2 μL)、DEPC水(7 μL),混合均匀后,放入PCR仪中进行逆转录反应,反应程序为42 °C,30 min;85 °C,5 min,逆转录后每个样品中加入90 μL DEPC水,将DNA模板稀释10倍。
然后用SYBR GREEN法行实时荧光定量PCR反应,反应体系如下:SYBR Green(5 μL)、PCR正向引物(0.5 μL)、PCR反向引物(0.5 μL)、DNA模板(4 μL)。反应程序为:95 °C,3 min;95 °C,15 s;60 °C,30 s;72 °C,30 s;扩增40个循环。实验结果采用2-ΔΔCt方法进行计算,以18S为内参,目的基因引物序列见表1。
2.7 Western blot法
用蛋白裂解液提取心脏组织中的总蛋白,使用蛋白定量仪定量总蛋白,通过电泳分离等量(100 μg)蛋白质,然后在300 mA下电转移至聚偏二氟乙烯膜上,在室温(25 ℃)下用5%脱脂牛奶封闭1 h后,孵育p-mTOR(1∶1000)、mTOR(1∶500)、p-STAT3(1∶500)、STAT3(1∶1000)和GAPDH(1∶1000)一抗,在4 ℃过夜,然后加入二抗,在室温下孵育2 h后,使用化学发光显影液试剂盒对蛋白条带进行可视化,凝胶成像系统对蛋白条带进行灰度值分析,以定量蛋白水平。
2.8 流式细胞术
取受体鼠脾脏,用红细胞裂解液裂解红细胞后,孵育一抗,未处理组和预致敏组分别加入5~20 μL同型抗体和靶标抗体(PE-anti-CD44和FITC-anti-CD62L),充分混匀,至4 ℃孵育30 min,孵育期间每隔10 min晃动一下反应管,使细胞和抗体充分反应;加入适量细胞洗液,1000 r/min离心5 min,离心半径为5 cm,弃上清,洗涤2次;使用100 μL细胞洗液重悬细胞;过尼龙毛柱,流式细胞术分析重悬细胞液中记忆性T细胞(memory T cell, Tm)(CD62L-CD44)的变化。
2.9 统计学分析
采用SPSS 20.0软件进行各组间的统计学差异分析,数据使用“x±s”表示。两组间比较采用独立样本t检验,3组及以上比较采用单因素方差分析。生存分析使用Kaplan Meier法。以P<0.05为差异有统计学意义。
3 结果
3.1 皮肤预致敏模型中Tm含量检测
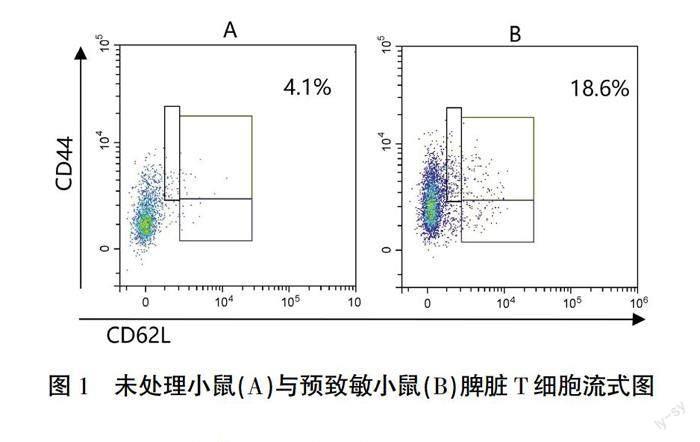
本研究为检测同种异体皮肤预致敏诱导产生Tm的能力,分离皮肤移植4周的C57BL/6小鼠脾脏T细胞,用PE-anti-CD44和FITC-anti-CD62L单抗标记后进行流式细胞仪检测,发现未处理的小鼠脾脏中Tm占4.1%(图1A),而预致敏小鼠为18.6%(图1B),表明皮肤预致敏可以诱导受体鼠体内分化出大量具有记忆性表型的T细胞。
3.2 各组移植物存活率比较
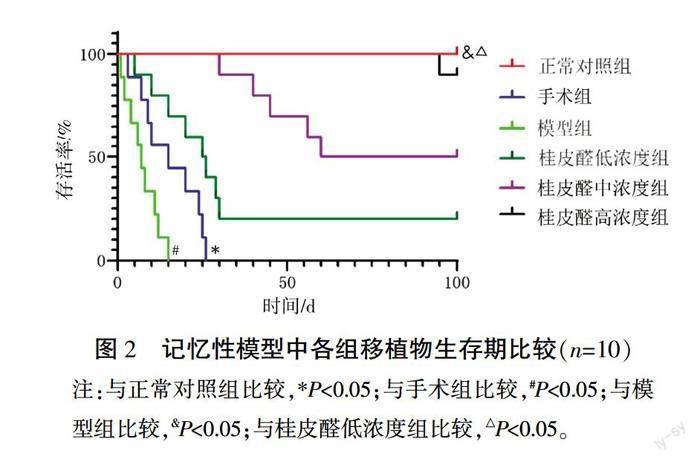
与正常对照组相比,手术组平均存活时间缩短(P<0.05);与手术组相比,模型组平均存活时间缩短(P<0.05);与模型组相比,桂皮醛高浓度组平均存活率显著延长(P<0.05),与桂皮醛低浓度组相比,桂皮醛高浓度组平均存活时间显著延长(P<0.05)。详见图2。
3.3 各组移植物排斥反应情况比较
正常对照组心肌纤维呈梭形排列,纤维间排列紧密,各纤维以分支相连,纤维中部有椭圆形或杆状的细胞核,规则排列,细胞质呈粉红色,均质分布;手术组见梭形排列的心肌纤维结构消失,纤维内出现空泡,心肌纤維之间排列疏松,空隙中淋巴细胞浸润;模型组见梭形排列的心肌纤维结构广泛消失,纤维内出现空泡,心肌纤维间出现较大的空隙,空隙中淋巴细胞广泛浸润;桂皮醛低、中浓度组见弥漫性心肌细胞坏死,心肌纤维断裂,中性粒细胞浸润,大量淋巴细胞灶融合呈片状;桂皮醛高浓度组心肌细胞排列整齐、紧密,血管结构完整,部分淋巴细胞浸润。模型组为Ⅳ级,桂皮醛低浓度组为ⅢB级,桂皮醛中浓度组为Ⅱ级,桂皮醛高浓度组为Ⅱ级;与正常对照组比较,手术组及模型组等级升高(P<0.05);与手术组及模型组比较,桂皮醛各浓度组等级降低(P<0.05)。详见图3。
3.4 各组OD值比较
与正常对照组比较,手术组及模型组脾细胞OD值显著升高(P<0.05)。与模型组相比,桂皮醛中、高浓度组的脾细胞OD值降低(P<0.05)。与桂皮醛低浓度组相比,桂皮醛中、高浓度组的脾细胞OD值降低(P<0.05)。详见图4。
3.5 各组移植物中排斥相关细胞因子表达水平比较
与正常对照组比较,手术组IL-2、IFN-γ mRNA的相对表达量显著升高(P<0.05),IL-10、TGF-β mRNA的相对表达量显著下调(P<0.05);与手术组相比,模型组IL-2、IFN-γ mRNA的相对表达量显著升高(P<0.05),IL-10、TGF-β mRNA的相对表达量显著下调(P<0.05)。与模型组相比,桂皮醛中、高浓度组的IL-2、IFN-γ mRNA的相对表达量降低(P<0.05),IL-10、TGF-β mRNA相对表达量增加(P<0.05)。与桂皮醛低浓度组比较,桂皮醛高浓度组IL-2、IFN-γ mRNA的相对表达量降低(P<0.05)。详见图5。
3.6 各组移植物中mTOR和STAT3蛋白磷酸化表达水平比较
与正常对照组比较,手术组及模型组p-mTOR和p-STAT3蛋白表达显著上调(P<0.05);与手术组相比,模型组p-mTOR和p-STAT3的相对表达量显著升高(P<0.05);与模型组及桂皮醛低浓度组比较,桂皮醛中、高浓度组的p-mTOR和p-STAT3的相对表达量降低(P<0.05)。详见图6。
4 讨论
桂皮醛是中药肉桂的主要有效成分,具有良好的抗氧化、抗炎和心脏保护等作用[18]。本研究发现在高浓度桂皮醛治疗下,所有移植心脏在小鼠体内存活超过100 d。近期有研究发现,T细胞中的mTOR促进CD4+和CD8+效应细胞的扩增,是心脏移植反应中Tfh和GCB细胞生成所必需的[19]。因此,T细胞中缺失mTOR和STAT3可诱导移植心脏长期生存。mTOR和STAT3是决定移植中初级和记忆性T细胞反应的关键调节因子[19]。在移植环境中,除非使用TCR转基因系统,否则很难追踪同种异体抗原特异性效应T细胞[20]。然而,本研究在同种异体皮肤预致敏中检测到CD62L-CD44效应T细胞显著增加。尽管这些细胞的抗原特异性尚不清楚,但它们在心脏移植后的反应有所增加。
本研究以BALB/c小鼠为供体,C57BL/6小鼠为受体进行背部全层皮肤移植,将所得到的小鼠脾脏T细胞转移至同系小鼠体内后进行心脏移植,以此构建记忆性同种异体排斥模型。在这个模型中,发现与正常对照组相比,模型组的脾脏中记忆性T细胞的数目明显增加,这说明移植后,记忆性T细胞会首先归巢到脾脏,并有一定程度的自体增殖[21]。而与模型组相比,加入桂皮醛的小鼠脾脏中Tm数目明显下降,考虑是由于受到桂皮醛的作用后,过继转移的记忆性T细胞无法被激活或激活后效应受到抑制所致。
本研究表明,与模型组相比,加入桂皮醛的小鼠的生存时间明显延长,且桂皮醛浓度越高,造模小鼠生存时间也逐渐延长。另外,在镜下发现,模型组和桂皮醛低、中浓度组小鼠心脏组织出现了严重的移植排斥反应,而桂皮醛高浓度组小鼠心脏组织仍保持较好的状态,这提示高浓度的桂皮醛可阻止移植物的淋巴细胞浸润,说明高浓度桂皮醛可明显对抗记忆性移植排斥。近年来的研究表明,高浓度桂皮醛可诱导初次移植心脏和胰岛等耐受,且对记忆性移植排斥模型有治疗效果[22]。另外,桂皮醛能阻断免疫细胞中NF-κB活化的能力,在原代和永生化免疫细胞中以剂量依赖性的方式抑制细胞活力、增殖和诱导细胞凋亡[23]。桂皮醛可以抑制同种反应性CD8+T细胞激活并增殖,还可以通过阻断树突状细胞与Tm间的OX40L/OX40途径,抑制CD4+Tm的激活[24]。
实验结果发现,与模型组相比,桂皮醛中、高浓度组的IL-2、IFN-γ mRNA的相对表达量降低,而IL-10、TGF-β mRNA的相对表达量增加,且这些炎症因子在桂皮醛高浓度组变化更明显,说明高浓度桂皮醛可以获得移植物的长期耐受。由此,得知高浓度的桂皮醛可通过抑制记忆性T细胞的反应来减少促炎因子的表達。加入桂皮醛后脾脏的记忆性T细胞明显减少,考虑是因为记忆性T细胞只需要TCR信号即可被激活,且IL-2和IFN-γ表达水平增高也得以验证,这充分说明桂皮醛能抑制同种反应性记忆性T细胞,使Tm在体内处于克隆无能或活化诱导性细胞死亡状态[25]。
此外,本研究发现相较于模型组和桂皮醛低、中浓度组,桂皮醛高浓度组可显著降低mTOR和STAT3的磷酸化表达,从而降低对移植物的记忆反应,延长心脏移植物的存活时间。而在以往的报道中,mTOR促进效应T细胞的分化[26],T细胞中mTOR的缺失显著抑制了这种效应T细胞的扩张[27]。雷帕霉素通过抑制mTORC1促进记忆性CD8+T细胞的生成[28]。STAT3是一种转录因子,在生长因子和细胞因子的作用下调节各种基因的表达[29]。研究表明,在记忆性T细胞生成的背景下,STAT3可反向促进急性淋巴细胞性脉络丛脑膜炎病毒感染后记忆性CD8+T细胞的发育[30]。STAT3缺失的CD8+T细胞发育为中枢记忆性T细胞的能力受损[31]。本实验结果也证实桂皮醛可通过抑制mTOR和STAT3抑制记忆性T细胞的免疫反应,降低对心脏移植物的记忆反应,从而促进移植物的长期存活,因此皮桂醛有望成为临床上延长心脏移植存活时间的潜在治疗药物。
参考文献
[1] VASCO M, BENINCASA G, FIORITO C, et al. Clinical epigenetics and acute/chronic rejection in solid organ transplantation: an update[J]. Transplantation Reviews, 2021, 35(2): 100609.
[2] HARTIGAN C R, SUN H, FORD M L. Memory T-cell exhaustion and tolerance in transplantation[J]. Immunological Reviews, 2019, 292(1): 225-242.
[3] VALDEZ-ORTIZ R, BESTARD O, LLAUD?譫 I, et al. Induction of suppressive allogeneic regulatory T cells via rabbit antithymocyte polyclonal globulin during homeostatic proliferation in rat kidney transplantation[J]. Transplant International, 2015, 28(1): 108-119.
[4] 鄭 剑,孙妲男,李 勇,等.温阳补肾汤对慢性肾小球肾炎脾肾阳虚证患者尿液Cys C、α1-MG表达及T淋巴细胞亚群的影响[J]. 湖南中医药大学学报,2021,41(7):1115-1119.
[5] GILL R G, BURRACK A L. Diverse routes of allograft tolerance disruption by memory T cells[J]. Frontiers in Immunology, 2020, 11: 580483.
[6] DUNETON C, WINTERBERG P D, FORD M L. Activation and regulation of alloreactive T cell immunity in solid organ transplantation[J]. Nature Reviews Nephrology, 2022, 18(10): 663-676.
[7] DUGGAN E M, GRIESEMER A. Progress towards xenogenic tolerance[J]. Current Opinion in Organ Transplantation, 2020, 25(5): 457-463.
[8] HUANG H, LONG L, ZHOU P, et al. mTOR signaling at the crossroads of environmental signals and T-cell fate decisions[J]. Immunological Reviews, 2020, 295(1): 15-38.
[9] WERLEN G, JAIN R, JACINTO E. mTOR signaling and metabolism in early T cell development[J]. Genes, 2021, 12(5): 728.
[10] EL HAGE A, DORMOND O. Combining mTOR inhibitors and T cell-based immunotherapies in cancer treatment[J]. Cancers, 2021, 13(6): 1359.
[11] ZHOU S, DAI Q, HUANG X, et al. STAT3 is critical for skeletal development and bone homeostasis by regulating osteogenesis[J]. Nature Communications, 2021, 12(1): 6891.
[12] 雷 俊,罗玲艳,孙 艺,等.基于IL-27/STAT1通路探讨针刺肺俞穴纠正哮喘模型大鼠Th1/Th2免疫平衡的机制[J].湖南中医药大学学报,2022,42(6):986-993.
[13] ZHANG C, YUE C, HERRMANN A, et al. STAT3 activation-induced fatty acid oxidation in CD8+ T effector cells is critical for obesity-promoted breast tumor growth[J]. Cell Metabolism, 2020, 31(1): 148-161.
[14] LAMPRIANIDOU E, KORDELLA C, KAZACHENKA A, et al. Modulation of IL-6/STAT3 signaling axis in CD4+FOXP3- T cells represent a potential antitumor mechanism of azacytidine[J]. Blood Advances, 2021, 5(1): 129-142.
[15] DEMIRCI G, AMANULLAH F, KEWALARAMANI R, et al. Critical role of OX40 in CD28 and CD154-independent rejection[J]. The Journal of Immunology, 2004, 172(3): 1691-1698.
[16] 李 纯.三氧化二砷抑制同种反应性记忆性CD8+T细胞介导的移植排斥反应[D].厦门:厦门大学,2014.
[17] SUNG C C, HORNG J H, SIAO S H, et al. Asialo GM1-positive liver-resident CD8 T cells that express CD44 and LFA-1 are essential for immune clearance of hepatitis B virus[J]. Cellular and Molecular Immunology, 2021, 18(7): 1772-1782.
[18] HAJINEJAD M, GHADDARIPOURI M, DABZADEH M, et al. Natural cinnamaldehyde and its derivatives ameliorate neuroinflammatory pathways in neurodegenerative diseases[J]. BioMed Research International, 2020, 2020: 1034325.
[19] SONG Y, YANG J M. Role of interleukin (IL)-17 and T-helper (Th)17 cells in cancer[J]. Biochemical and Biophysical Research Communications, 2017, 493(1): 1-8.
[20] WANG F, HUANG G, SHEN L, et al. Genetics and functional mechanisms of STAT3 polymorphisms in human tuberculosis[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 669394.
[21] DING M, HE Y, ZHANG S, et al. Recent advances in costimulatory blockade to induce immune tolerance in liver transplantation[J]. Frontiers in Immunology, 2021, 12: 537079.
[22] UEHARA M, MCGRATH M M. The role of costimulatory pathways in transplant tolerance[J]. Clinics in Laboratory Medicine, 2019, 39(1): 87-106.
[23] DING Z, LIU J, QIAN H, et al. Cinnamaldehyde inhibits psoriasis-like inflammation by suppressing proliferation and inflammatory response of keratinocytes via inhibition of NF-κB and JNK signaling pathways[J]. Molecular Medicine Reports, 2021, 24(3): 638.
[24] FU Y, LIN Q, ZHANG Z, et al. Therapeutic strategies for the costimulatory molecule OX40 in T-cell-mediated immunity[J]. Acta Pharmaceutica Sinica B, 2020, 10(3): 414-433.
[25] FU N, XIE F, SUN Z, et al. The OX40/OX40L axis regulates T follicular helper cell differentiation: Implications for autoimmune diseases[J]. Frontiers in Immunology, 2021, 12: 670637.
[26] WANG F, ZHANG J, ZHOU G. The mTOR-glycolytic pathway promotes T-cell immunobiology in oral lichen planus[J]. Immunobiology, 2020, 225(3): 151933.
[27] JIANG Q, HUANG X, YU W, et al. mTOR signaling in the regulation of CD4+ T cell subsets in periodontal diseases[J]. Frontiers in Immunology, 2022, 13: 827461.
[28] BATTAGLIONI S, BENJAMIN D, W?魧LCHLI M, et al. mTOR substrate phosphorylation in growth control[J]. Cell, 2022, 185(11): 1814-1836.
[29] 张 浩,胡佩佩,王智兰.清肝凉血解毒汤通过调控JAK2/STAT3信号通路减轻肝细胞损伤研究[J].陜西中医,2023,44(2):165-169.
[30] MCILWAIN D R, GRUSDAT M, POZDEEV V I, et al. T-cell STAT3 is required for the maintenance of humoral immunity to LCMV[J]. European Journal of Immunology, 2015, 45(2): 418-427.
[31] KAMINSKIY Y, MELENHORST J J. STAT3 role in T-cell memory formation[J]. International Journal of Molecular Sciences, 2022, 23(5): 2878.
〔收稿日期〕2022-06-27
〔基金项目〕湖北省自然科学基金项目(2022030241)。
〔第一作者〕李师亮,男,主治医师,博士,研究方向:心脏移植后心肌存活的机制研究。
〔通信作者〕*周 彦,女,博士,副主任医师,E-mail:bluekeigo@163.com。

