基于miR-378探讨丹红注射液干预压力超负荷心力衰竭大鼠心肌纤维化机制
熊霞军 胡思远 钟森杰 张倩 范星宇 胡志希


〔摘要〕 目的 探討丹红注射液对压力超负荷心力衰竭大鼠心肌纤维化的作用与机制。方法 取50只大鼠并对其行主动脉弓缩窄术(transverse aortic constriction, TAC),造模9周后将其随机分为模型(TAC)组、丹红注射液(DH)组(6.0 mL·kg-1)、卡托普利(Captopril)组(8.8 mg·kg-1),另设立10只为假手术(Sham)组。药物干预15 d后对各组大鼠进行超声心动图检测;酶联免疫法测定血清氨基末端脑钠肽前体(N-terminal pro brain natriuretic peptide, NT-pro BNP)含量;HE、Masson染色观察心肌病理学及纤维化改变,Western blot检测心肌组织中转化生长因子β1(transforming growth factor-β1, TGF-β1)、Ⅰ型胶原蛋白(collagen-1, COL-1)、Ⅲ型胶原蛋白(collagen-3, COL-3)及α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达;qRT-PCR 检测心肌组织中miR-378、TGF-β1 mRNA、Col-1 mRNA、Col-3 mRNA、ɑ-SMA mRNA表达。结果 与Sham组比较,TAC组左室射血分数(left ventricular ejection fraction, LVEF)和左室短轴缩短率(left ventricular fractional shortening, LVFS)、心肌组织miR-378下降,左室舒张末期内径(left ventricular end diastolic dimension, LVEDD)、左室收缩末期内径(left ventricular end systolic diameter, LVESD)、血浆NT-pro BNP、TGF-β1、COL-1、COL-3及α-SMA mRNA及蛋白表达升高,差异均有统计学意义(P<0.01);细胞排列紊乱,纤维化明显。与TAC组比较,DH组LVEF、LVFS、心肌组织miR-378上升,LVEDD、LVESD、血浆NT-pro BNP、TGF-β1、COL-1、COL-3及α-SMA mRNA及蛋白表达下降,差异均有统计学意义(P<0.01);细胞排列趋于整齐,胶原纤维沉积减轻。结论 丹红注射液能够改善压力超负荷心力衰竭大鼠心肌纤维化,其机制与调控miR-378/TGFβ-1信号通路表达有关。
〔关键词〕 丹红注射液;miR-378;心力衰竭;心肌纤维化;压力超负荷;转化生长因子β1
〔中图分类号〕R256.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.004
Mechanism of Danhong Injection on the myocardial fibrosis of heart failure
rats with stress overload based on miR-378
XIONG Xiajun1, HU Siyuan2, ZHONG Senjie2, ZHANG Qian2, FAN Xingyu2, HU Zhixi2*
1. Changsha Economic Development Zone Hospital, Changsha, Hunan 410019, China; 2. Hunan University of
Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the effect and mechanism of Danhong Injection(DHI) on myocardial fibrosis in heart failure rats with stress overload. Methods Fifty rats received transverse aortic constriction (TAC), and after 9 weeks of modeling, they were randomly divided into model (TAC) group, Danhong Injection (DHI) group (6.0 mL·kg-1), Captopril (8.8 mg·kg-1) group. And another 10 rats were set as the sham-operated group. After 15 days of intervention, echocardiogram detection was performed on rats in each group. Serum N-terminal pro brain natriuretic peptide (NT-pro BNP) content was determined by enzyme-linked immunoassay; myocardial pathology and fibrotic change was observed by HE and Masson staining; transforming growth factor-β1 (TGF-β1), collagen-1 (COL-1), collagen-3 (COL-3) and α smooth muscle act (α-SMA) expression of myocardial tissue was detected by Western blot; the expression of miR-378, TGF-β1 mRNA, Col-1 mRNA, Col-3 mRNA, and α-SMA mRNA of myocardial tissue was detected by qRT-PCR. Results Compared with the sham-operated group, the left ventricular ejection fraction (LVEF), the left ventricular fractional shortening rate (LVFS), and miR-378 of myocardial tissue in the TAC group decreased; the left ventricular end-diastolic diameter (LVEDD), the left ventricular end systolic diameter (LVESD), plasma NT-pro BNP, TGF-β1, COL-1, COL-3, α-SMA mRNA and protein expression were significantly higher (P<0.01); disordered arrangement of the cells and obvious fibrosis was shown. Compared with TAC group, the expression of LVEF, LVFS and miR-378 of myocardial tissue increased, and the LVEDD, LVESD, plasma NT-pro BNP, TGF-β1, COL-1, COL-3, α-SMA mRNA and protein expression decreased significantly in DHI group (P<0.01); cell arrangement tended to be neat, and the deposition of collagen fibers was reduced. Conclusion DHI can reduce myocardial fibrosis in heart failure rats with stress overload, and its mechanism is related to the expression regulation of miR-378/TGFβ-1 signaling pathway.
〔Keywords〕 Danhong Injection; miR-378; heart failure; myocardial fibrosis; stress overload; transforming growth factor β1
慢性心力衰竭(chronic heart failure, CHF)是指由心脏结构或功能异常,导致心室充盈或射血能力受损所致的一组复杂临床综合征,臨床表现为体循环淤血、肺循环淤血及各器官、组织灌注不足,是各种心血管疾病的终末阶段[1]。CHF是全球性的心血管疾病,据统计,目前全世界心力衰竭患者近3770万人,其中,我国心力衰竭患者约400万人,预计到2030年全球心力衰竭患病率将增加25%,且相关的医疗支出预计将增加1倍以上[2-4]。目前,心力衰竭的治疗取得一定进展,但发病率和死亡率(5年死亡率约50%)仍然很高,成为全球公共卫生的一大难题[5]。心脏重构是心力衰竭的主要病理特征。心肌纤维化是心脏重构重要的形态改变,两者在心力衰竭的发生发展中起主要作用,影响疾病的向愈和向逆。因此,抑制心肌纤维化是防治CHF的关键环节。
MicroRNA属于短链非编码RNA,常作为细胞内介质参与转录后基因调控[6]。研究证实,MicroRNA在人类和鼠类的血流动力学压力过载中异常表达,是调节心脏重构和纤维化的关键成分[7-9]。MicroRNA-378(miR-378)在心脏组织中高表达,具有改善心肌缺血、抑制心肌肥厚、改善心肌纤维化等作用。心肌纤维化归属于中医学“心悸”“胸痹”等范畴,病机为本虚标实、久病入络,本虚为阳气亏虚,标实为痰浊、瘀血。其中血瘀是心肌纤维化病变过程中的重要病机和病理产物。因此,活血化瘀法日益受到重视[10]。本课题组前期基于“以方测证”法证实主动脉弓缩窄术(transverse aortic constriction, TAC)心力衰竭大鼠为心血瘀阻证,活血化瘀代表药物丹红注射液能够显著改善TAC心力衰竭大鼠心肌纤维化[11]。因此,本研究从miR-378探讨压力超负荷心力衰竭心血瘀阻证心肌纤维化机制及丹红注射液干预作用,为临床防治心力衰竭提供实验指导。
1 材料
1.1 实验动物
SD大鼠购自湖南斯莱克景达实验动物有限公司,共60只,雄性,6周龄,体质量(210±10) g,合格证号:SCXK(湘)2019-0004,饲养于湖南中医药大学实验动物中心SPF级实验室。研究方案经湖南中医药大学实验动物伦理委员会批准,批准号LL2021011302。
1.2 主要仪器及药物
SonoScape-S2N型超声诊断仪(深圳开立科技公司),MB-530 型酶标仪(深圳汇松科技发展公司),RWD407型呼吸机(深圳瑞沃德生命科技公司),DYY-6C型电泳仪(北京六一生物科技有限公司),DYCZ-40D型转膜仪(北京六一生物科技有限公司)。氨基末端脑钠肽前体(N-terminal pro brain
natriuretic peptide, NT-pro BNP)试剂盒(武汉华美生物工程有限公司,批号:G28032936)。一抗转化生长因子β1(transforming growth factor-β1, TGF-β1)、Ⅰ型胶原蛋白(collagen-1, COL-1)、Ⅲ型胶原蛋白(collagen-3, COL-3)、α平滑肌肌动蛋白(α-smooth muscle actin, ɑ-SMA)、二抗HRP goat anti-mouse IgG均购自美国proteintech,货号分别为21898-1-AP、67288-1-Ig、22734-1-AP、14395-1-AP、SA00001-1。丹红注射液(山东丹红制药有限公司,规格20 mL/支,批号:20112012),卡托普利片(重庆科瑞制药集团有限公司,规格25 mg/片,批号:641003),注射用青霉素钠(山东鲁抗医药有限公司,规格0.48 g/瓶,批号:43200909)。
2 方法
2.1 模型制备
SPF级实验室适应性喂养大鼠7 d后随机将大鼠分为假手术(Sham)组10 只和造模组50只。TAC模型的制备参照文献[11],先称取大鼠体质量,采用10%水合氯醛以3.5 mL·kg-1腹腔注射麻醉大鼠,仰卧位固定大鼠四肢及头部于恒温台,前胸部及颈部脱毛处理后消毒备皮。沿颈部正中线切开表皮再钝性分离颈部结缔组织及气管两侧肌肉,暴露气管后行气管插管并机械通气。于左侧第2、第3肋间隙作横向切口钝性分离开胸,分离胸腺以充分暴露主动脉胸段。采用4-0号手术线穿过左颈总动脉与无名动脉间,并提起主动脉弓,缩窄垫针紧贴主动脉弓进行结扎,经游标卡尺测量,缩窄率为60%~65%,结扎完成后抽出垫针。逐层缝合肋间隙、肌肉及表皮,并用聚维酮碘消毒,待大鼠恢复自主呼吸后予以脱机。Sham组主动脉弓只穿线不结扎,余步骤与TAC制备保持一致。两组术后连续3 d肌内注射青霉素钠20万U。
2.2 心力衰竭模型评价方法
术后第9周,麻醉大鼠行超声心动图检测大鼠心脏左室射血分数(left ventricular ejection fraction, LVEF)、左室短轴缩短率(left ventricular fractional shortening, LVFS)、左室舒张末期内径(left ventricular end diastolic dimension, LVEDD)、左室收缩末期内径(left ventricular end systolic diameter, LVESD),眼眶取血检测NT-pro BNP含量。与Sham组比,TAC组LVEF、LVFS显著降低,LVEDD、LVESD显著上升,血清NT-pro BNP显著增高视为心力衰竭,模型复制成功。
2.3 分组与给药
成模大鼠按随机数字表法分为模型(TAC)组、丹红注射液(DH)组和卡托普利(Captopril)组。大鼠给药时间均为15 d。给药剂量[11]:(1)DH组腹腔注射,单次剂量 6.0 mL·kg-1,并按 4.0 mL·kg-1灌胃生理盐水;(2)Captopril组:卡托普利片溶于生理盐水中,按8.8 mg·kg-1剂量灌胃,并按 6.0 mL·kg-1腹腔注射灭菌注射用水;(3)Sham组、TAC组:按4.0 mL·kg-1灌胃生理盐水,按6.0 mL·kg-1腹腔注射灭菌注射用水。
2.4 标本采集与处理
药物连续干预15天后,对大鼠再次行治疗后超声心动图检测及血清、心肌组织样本采集。大鼠经水合氯醛麻醉固定后,打开腹腔,用棉球小心分离肠道及黏膜组织,暴露腹主动脉,行腹主动脉取血,取血时针尖缺口朝下,每只取血约 5 mL,离心后(3 000 r·min-1,离心半径 12 cm,时间15 min)每组选取6个样本,每样本取200 μL,后续采用ELISA法检测NT-pro BNP含量。取血完毕开胸小心剪取完整心脏,轻轻挤掉心脏内血液再经PBS洗净残存血液,滤纸吸干后选取心尖部位剪取约200 mg左心室组织,装入预先标记编号好的冻存管,并立即放于液氮低温保存,用于后续Western blot及qRT-PCR相关检测,上述操作均于低温冰块上进行;剩余组织用4%多聚甲醛溶液固定,后续用于HE染色和Masson染色,采用Image J软件进行蛋白灰度分析。
2.5 qRT-PCR法检测心肌组织中miR-378、TGF-β1等相关指标
取0.25 mg心肌组织,加入1 mL Trizol,充分研磨,混匀室裂解5 min,提取总RNA。以组织总mRNA为模板,逆转录cDNA(反应体系dNTP Mix 4 μL、Primer Mix 2 μL、RNA Template 7 μL、5×RT Buffer 4 μL、DTT 2 μL、HiFiScript 1 μL),42 ℃孵育15 min,85 ℃ 孵育 5 min 。其中miRNA反转录如下:根据所需用RNA的量,按ATP稀释系数=5000/(RNA起始量),加1 mmoL Tris(pH 8.0)去稀释10 mmoL ATP,加入反应体系(总共RNA 3 μL、10×Poly(A) Polymerase Buffer1×2 μL、稀释后的ATP 0.8 μL、E.coli Poly(A) Polymerase(5U/μL)0.4 μL、RNase-Free Water 11.8 μL,总量20 μL),37 ℃的条件下孵育15 min。
修饰后的miRNA cDNA第一链合成的过程:加入反应体系[Poly(A)反应液4 μL、超纯dNTPs(10 mmoL each) 1 μL、25 μmoL RT primer 3 μL、5×RT Buffer 4 μL、SuperRT Reverse Transcriptase 0.5 μL、RNase-Free Water 7.5 μL],在反应体系中50 ℃及85 ℃条件下分别孵育50 min和5 min。各引物序列详见表1。
以上述表格中所列基因序列实时定量PCR,按照预先配制好的扩增液进行定量扩增。详见表2。95 ℃中预变性10 min,95 ℃ 15 s、60 ℃ 30 s,重复扩增40个循环。收集每循环第3个步骤荧光信号量,反应结束后读取Ct值,△Ct=目的基因Ct值-内参基因Ct值,-ΔΔCt=对照组ΔCt-各样品ΔCt,2-ΔΔCt反映各样品相对于对照组样品目的基因的表达水平,重复3次取均值进行统计分析。
2.6 Western blot检测蛋白表达
称取约25 mg心肌组织置于200 bp RIPA裂解液反复研磨并置于冰上裂解10 min,4 ℃ 12 000 r·min-1离心15 min(离心半径7 cm),吸取上清液分装保存,参照BCA试剂盒说明书测定蛋白浓度。然后电泳、转膜、封闭、一抗孵育,用1×TBST将一抗按照一定比例稀释,TGF-β1(1∶1000)、COL-1(1∶5000)、COL-3(1∶500)、α-SMA(1∶1000),GAPDH(1∶3000)。將封闭后的膜与一抗放于孵育盒,置于4 ℃冰箱放置12 h,再在室温(25 ℃)静置1 h,孵育结束后,回收一抗,然后将孵育盒置于摇床上用1×TBST洗涤15 min,重复3次。洗涤结束后,将预先稀释好的二抗与膜置于摇床上室温下孵育90 min。孵育结束后将孵育盒置于摇床用1×TBST 洗涤15 min,重复3次。现配现用ECL化学发光液,将膜平铺在显影仪,吸取发光液均匀滴在膜上,反应约1 min,然后将膜旁边多余的发光液用滤纸吸干,关上显影仪在暗盒内显色曝光约8 min。曝光完成后选取最佳图片,数据分析采用Image J软件。
2.7 统计学分析
数据分析采用 SPSS 25.0软件处理,计量资料数据采用“x±s”表示,两组间实验数据比较采用独立样本t检验,多组间比较采用单因素方差分析法,事后多重比较采用LSD法;若数据不满足正态分布或方差不齐,则采用非参数检验(Kruskal-Wallis H),以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠成活情况
大鼠主动脉弓手术操作过程中共死亡12只,经解剖发现其死亡原因涉及主动脉弓结扎过紧导致的急性左心衰、抽取缩窄针致主动脉弓破裂、纵隔胸膜破裂致气胸及肺部损伤等因素;后续成模阶段共死亡老鼠9只,其死亡原因涉及呼吸障碍、心力衰竭。最终TAC组剩余29只,按照随机数字表法分为TAC组10只,DH组10只,Captopril组9只;Sham组因开胸导致纵隔胸膜破裂死亡1只,剩余9只。
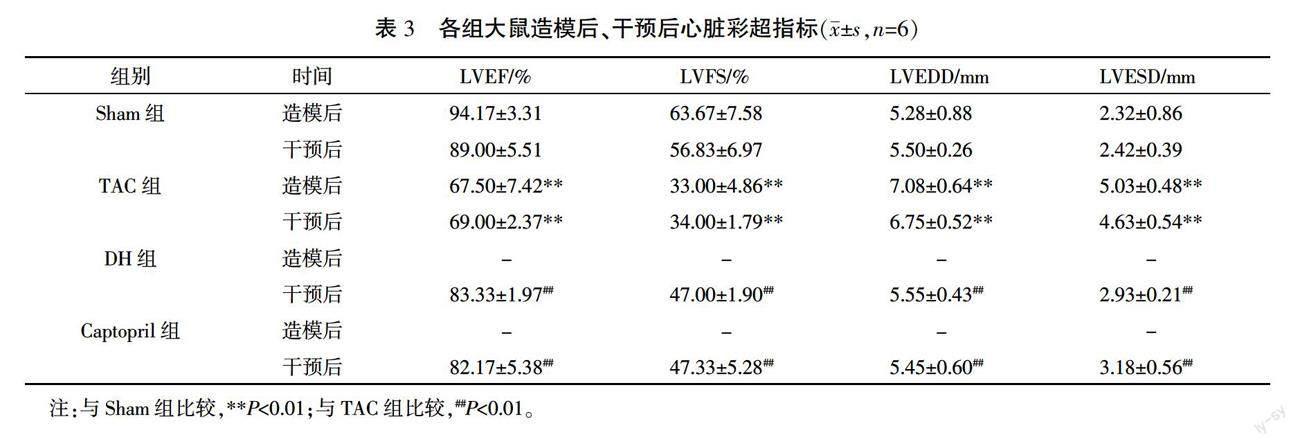
3.2 各组超声心动图结果
造模9周后,与Sham组比较,TAC组LVEF和LVFS显著下降(P<0.01),LVEDD和LVESD显著升高(P<0.01)。药物干预15天后,与Sham组比较,TAC组LVEF和LVFS显著下降(P<0.01),LVEDD和LVESD显著上升(P<0.01);与TAC组比较,DH组和Captopril组LVEF和LVFS显著上升(P<0.01),LVEDD和LVESD明显下降(P<0.01)。详见表 3。
3.3 各组血清NT-pro BNP结果
压力超负荷造模9周后,与Sham组比较,TAC组NT-pro BNP显著升高(P<0.01)。药物干预15天后,与Sham组比较,TAC组NT-pro BNP显著升高(P<0.01);与TAC组比较,DH组、Captopril组NT-pro BNP显著下降(P<0.01)。详见表4。
3.4 HE染色结果
光镜下观察HE染色,Sham组细胞排列整齐、轮廓清晰,闰盘、横纹清晰可见,细胞核大小形态正常;TAC组细胞排列明显紊乱不齐,细胞间隙明显增宽,部分细胞出现水肿并伴细胞核消失及凝固性坏死;DH组及Captopril组心肌细胞排列趋于整齐,细胞结构较为完整,未见明显细胞水肿及坏死。详见图1。
3.5 Masson染色结果
光镜下观察Masson染色,与Sham组比较,TAC组肌纤维排列紊乱,其间可见明显胶原纤维沉积;与TAC组比较,DH组及Captopril组蓝染胶原纤维明显减少。详见图2。
3.6 各组大鼠干预后纤维化相关蛋白表达量
各组干预15天后,与Sham组比较,TAC组心肌组织中TGF-β1、α-SMA、COL-1、COL-3蛋白均显著升高(P<0.01);与TAC组比较,DH组、Captopril组心肌组织中TGF-β1蛋白、α-SMA蛋白、COL-1蛋白、COL-3蛋白均显著下降(P<0.01)。详见表5,图3。
3.7 各组大鼠干预后纤维化因子相对表达量
各组干预15天后,与Sham组比较,TAC组心肌组织中miR-378表达显著下降(P<0.01),TGF-β1、α-SMA、COL-1、COL-3 mRNA表达显著升高(P<0.01);与TAC组比较,DH组、Captopril组心肌组织中miR-378表达显著升高(P<0.01),TGF-β1、α-SMA、COL-1、COL-3 mRNA表达显著下降(P<0.01)。详见表6。
4 讨论
心力衰竭归属于中医学“心胀”“心痹”“心水”等范畴。心力衰竭病机为本虚标实,本虚为气虚、气阴两虚、阳虚,标实为痰饮、瘀血及水饮。正如《素问·水热穴论》所言:“水病,下为胕肿大腹,上为喘呼不得卧者,标本俱病。”后世医家认为“瘀血”为心力衰竭关键病机[12],如清代医家王清任、唐容川等认為“血管无气,必停而为瘀”,“血积既久,其水乃成”,“瘀血化水,亦发水肿”。现代医家多认为血瘀既是病机又是病理产物,贯穿心力衰竭发展始终。如《慢性心力衰竭中医诊疗专家共识》[13]及《慢性心力衰竭中西医结合诊疗专家共识》[14]认为血瘀是心力衰竭关键病机,心血瘀阻是其中心环节。中医古籍中并无心肌纤维化相关记载,基于络病学说心肌纤维化可归属“络病”范畴[15],正如《医林改错》记载:“久病入络为瘀。”瘀血是心肌纤维化关键病理机制,活血化瘀是其关键治则,现代研究同样证实活血化瘀法能够显著改善心肌纤维化及心室重构[16-17]。
TAC是在模拟主动脉瓣狭窄基础上,造成左室后负荷增加,持续的压力负荷造成左室失代偿及心肌纤维化,最早由ROCKMAN研制用来研究心室重构[18]。本研究在造模第9周后对两组大鼠眼眶取血,Elisa检测大鼠血清NT-pro BNP值;并进行超声心动图检查。结果表明:与Sham组比较,TAC组NT-pro BNP、LVESD、LVEDD值升高,LVEF、LVFS显著降低。LVEF是评价心功能重要指标。心力衰竭根据LVEF分为三类[19]:射血分数降低的心力衰竭、射血分数中间值的心力衰竭、射血分数保留的心力衰竭。但临床在诊断心力衰竭时,此项指标存在一定主观性,故往往需借助NT-pro BNP值对心力衰竭做出准确判断。NT-pro BNP由左心室心肌分泌,生物变异率低、代谢周期较长,在血浆中较为稳定[20],各大指南均将NT-pro BNP作为心力衰竭诊断的重要标记物[21-22]。本研究结果提示TAC组LVEF、LVFS下降,LVESD、LVEDD增大,NT-pro BNP增高,说明主动脉弓缩窄致心力衰竭模型复制成功,与相关实验研究基本一致[23]。
纤维化可影响各器官,纤维化正成为全球医疗负担[24]。心肌纤维化是心室重构重要因素,是心力衰竭发生发展的关键因素,抗纤维化治疗是目前研究的热点及难点。中医药治疗纤维化疗效显著,在TAC大鼠心力衰竭模型中,丁超[25]、顾燕频[26]、陈仁山[27]等证实活血法在治疗心肌纤维化疗效显著。基于此,本研究采用丹红注射液干预TAC大鼠心力衰竭模型。
miRNA在心力衰竭的发病机制中起着重要作用,能够调节适应性和不适应性心室重构过程的基因表达水平[28]。miR-378是心肌纤维化调控因子之一,在压力超负荷心力衰竭模型中,上调miR-378可以改善心室重构及心功能[29]。LIU等[30]在TAC大鼠模型中研究发现,miR-378通过抑制MAPK的磷酸化而减轻心肌纤维化。本研究结果发现,与Sham组相比,TAC组心肌纤维化更为明显,心肌组织中miR-378显著下调;与TAC组相比,DH组心肌纤维化改善明显,心肌组织中miR-378显著上调,miR-378可能是丹红注射液治疗心肌纤维化的可能机制及潜在靶点。
心肌纖维化根据病理特点分为修复性纤维化、间质纤维化和血管周围纤维化[31]。在压力负荷心力衰竭中常发生间质纤维化[32]。细胞外基质(extracellular matrix, ECM)过度积累是纤维化主要病理表现,正常心脏组织中胶原蛋白生成、降解处于动态平衡;压力负荷等刺激可打破此平衡,造成胶原生成过度及比例失衡,最终导致间质纤维化,心功能失代偿。心脏ECM主要由Ⅰ型和Ⅲ型原纤维胶原组成。Ⅰ型和Ⅲ型原纤维胶原是构成细胞外骨架的主要结构蛋白。在正常心脏中,Ⅰ型胶原约占总心肌胶原的85%,负责构建赋予其抗拉强度的厚纤维。Ⅲ型胶原蛋白占总胶原蛋白的11%,负责基质网络的弹性[33]。α-SMA是心脏成纤维细胞活化为肌成纤维细胞标志物[34],活化的肌成纤维细胞可大量分泌胶原蛋白促进心肌纤维化。TGF-β1是心脏成纤维细胞活化的关键因子,故抑制TGF-β1是改善心肌纤维化的关键所在。本次实验结果显示:与Sham组相比,TAC组TGF-β1、胶原蛋白Ⅰ、胶原蛋白Ⅲ及α-SMA mRNA及蛋白均显著增高;与TAC组相比,DH组TGF-β1、胶原蛋白Ⅰ、胶原蛋白Ⅲ及α-SMA mRNA及蛋白均显著下调。从以上结果可知miR-378与TGF-β1呈负相关,即TAC组miR-378显著下调,TGF-β1明显上调,DH组miR-378显著上调,TGF-β1却明显下调,故推测丹红注射液能够上调心肌组织中miR-378水平,抑制TGF-β1表达,从而改善心肌纤维化。
综上所述,本研究通过主动脉弓缩窄诱导压力超负荷心力衰竭大鼠模型,研究丹红注射液对心力衰竭大鼠心肌纤维化的改善机制。实验结果表明,丹红注射液能够下调心肌组织中胶原蛋白Ⅰ、胶原蛋白Ⅲ及α-SMA蛋白,改善心肌纤维化,其作用机制可能与提高心肌组织中miR-378表达,下调TGF-β1有关。心脏成纤维细胞活化是心肌纤维化的主要机制,相关研究表明miR-378在心肌细胞中大量表达,在心脏成纤维细胞中不表达,丹红注射液是否与提高心肌细胞中miR-378表达,后通过某种机制再调控心脏成纤维细胞,从而改善纤维化,有待深入研究。
参考文献
[1] METRA M, TEERLINK J R. Heart failure[J]. The Lancet, 2017, 390(10106): 1981-1995.
[2] HEIDENREICH P A, ALBERT N M, ALLEN L A, et al. Forecasting the impact of heart failure in the United States: A policy statement from the American Heart Association[J]. Circulation Heart Failure, 2013, 6(3): 606-619.
[3] WRITING GROUP MEMBERS, LLOYD-JONES D, ADAMS R J, et al. Heart disease and stroke statistics: 2010 update: A report from the American Heart Association[J]. Circulation, 2010, 121(7): e46-e215.
[4] ZIAEIAN B, FONAROW G C. Epidemiology and aetiology of heart failure[J]. Nature Reviews Cardiology, 2016, 13(6): 368-378.
[5] ZARRINKOUB R, WETTERMARK B, WANDELL P, et al. The epidemiology of heart failure, based on data for 2.1 million inhabitants in Sweden[J]. European Journal of Heart Failure, 2013, 15(9): 995-1002.
[6] WANG H J, CAI J. The role of microRNAs in heart failure[J]. Biochimica et Biophysica Acta Molecular Basis of Disease, 2017, 1863(8): 2019-2030.
[7] VERJANS R, PETERS T, BEAUMONT F J, et al. MicroRNA-221/222 family counteracts myocardial fibrosis in pressure overload-induced heart failure[J]. Hypertension (Dallas, Tex: 1979), 2018, 71(2): 280-288.
[8] ZHANG J C, LANG Y, GUO L H, et al. MicroRNA-323a-3p promotes pressure overload-induced cardiac fibrosis by targeting TIMP3[J]. Cellular Physiology and Biochemistry, 2018, 50(6): 2176-2187.
[9] GARC?魱A R, SALIDO-MEDINA A B, GIL A, et al. Sex-specific regulation of miR-29b in the myocardium under pressure overload is associated with differential molecular, structural and functional remodeling patterns in mice and patients with aortic Stenosis[J]. Cells, 2020, 9(4): 833.
[10] 吴美芳,吕仕超,张军平.心肌纤维化中医诊疗思路探析[J].时珍国医国药,2015,26(3):677-679.
[11] 钟森杰,熊霞军,张 倩,等.基于“方证对应”理论探讨主动脉弓缩窄致心力衰竭大鼠模型的中医证型与代谢标志物[J].中国实验方剂学杂志,2022,28(16):130-139.
[12] 张伯礼,吴勉华,林子强.中医内科学[M].北京:中国中医药出版社,2019.
[13] 冠心病中医临床研究联盟,中国中西医结合学会心血管疾病专业委员会,中华中医药学会心病分会,等.慢性心力衰竭中医诊疗专家共识[J].中医杂志,2014,55(14):1258-1260.
[14] 中国中西医结合学会心血管疾病专业委员会,中国医师协会中西医结合医师分会心血管病学专家委员会.慢性心力衰竭中西医结合诊疗专家共识[J].中国中西医结合杂志,2016,36(2):133-141.
[15] 郑 钰,刘 创,庞立健,等.基于络病理论防治多器官纤维化异病同治刍议[J].时珍国医国药,2018,29(5):1175-1177.
[16] 张蓓蓓,蔡 辉.丹参酮ⅡA对心室重构作用的研究进展[J].安徽医药,2014,18(12):2230-2233.
[17] 任雪萍,许姝雯,曹程浩,等.抗纤益心方通过调控miR-125b-5p抑制扩张型心肌病心肌纤维化的研究[J].时珍国医国药,2021,32(9):2109-2113.
[18] ROCKMAN H A, ROSS R S, HARRIS A N, et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy[J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(18): 8277-8281.
[19] 中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2018[J].中华心血管病杂志,2018,46(10):760-789.
[20] 吴蓝津,吴万芬,陆山河.NT-proBNP在心力衰竭中应用的研究进展[J].心血管康复医学杂志,2018,27(1):114-117.
[21] YANCY C W, JESSUP M, BOZKURT B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: A report of the American college of cardiology/American heart association task force on clinical practice guidelines and the heart failure society of America[J]. Journal of Cardiac Failure, 2017, 23(8): 628-651.
[22] PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. European Heart Journal, 2016, 37(27): 2129-2200.
[23] 張玮玮.血管紧张素Ⅱ通过AT1R/StAR/AS/醛固酮信号通路参与调节心肌肥厚和心脏纤维化[D].太原:山西医科大学,2018.
[24] HENDERSON N C, RIEDER F, WYNN T A. Fibrosis: From mechanisms to medicines[J]. Nature, 2020, 587(7835): 555-566.
[25] 丁 超,谢利平,李荣成.丹酚酸A对压力超负荷大鼠心功能减退和心室重构的改善作用[J].南京医科大学学报(自然科学版),2014,34(1):12-17.
[26] 顾燕频,章 忱,郭 炜,等.益气活血方对压力超负荷致大鼠心肌肥厚的影响[J].中华中医药学刊,2015,33(1):64-66,5.
[27] 陈仁山.丹酚酸B对压力过负荷致小鼠心力衰竭的保护作用及机制研究[D].广州:广州中医药大学,2016.
[28] 刘素晓,王幼平,谢世阳.MicroRNA在心血管系统发育和疾病中作用的研究进展[J].中西医结合心脑血管病杂志,2019,17(12):1819-1822.
[29] GANESAN J, RAMANUJAM D, SASSI Y, et al. MiR-378 controls cardiac hypertrophy by combined repression of mitogen-activated protein kinase pathway factors[J]. Circulation, 2013, 127(21): 2097-2106.
[30] LIU W Y, SUN H H, SUN P F. MicroRNA-378 attenuates myocardial fibrosis by inhibiting MAPK/ERK pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(10): 4398-4405.
[31] 邱羽菲,史嘉翊,宋旭东,等.心肌纤维化的发生机制及治疗研究进展[J].心脏杂志,2021,33(5):553-557.
[32] D?魱EZ J, GONZ?魣LEZ A, KOVACIC J C. Myocardial interstitial fibrosis in nonischemic heart disease, part 3/4: JACC focus seminar[J]. Journal of the American College of Cardiology, 2020, 75(17): 2204-2218.
[33] 孫帅锋,刘 巍.心肌纤维化病理机制及诊疗策略进展[J].国际心血管病杂志,2020,47(5):264-267.
[34] LI L, ZHAO Q, KONG W. Extracellular matrix remodeling and cardiac fibrosis[J]. Matrix Biol, 2018, 68/69: 490-506.
〔收稿日期〕2023-03-04
〔基金项目〕国家自然科学基金项目(81774208,82274412);湖南省自然科学基金项目(2019JJ50447);广东省重点领域研发项目(2020B1111100001);湖南省中医药科研计划项目青年课题(2021180)。
〔第一作者〕熊霞军,男,硕士研究生,主治医师,研究方向:心血管疾病证本质与诊治规律。
〔通信作者〕*胡志希,男,教授,博士研究生导师,E-mail:515800272@qq.com。

