利用分子轨道理论解决几个中学化学疑难问题
叶益晨 林肃浩







摘要:结合中学化学教学,利用分子轨道理论系统分析了“甲烷氯代反应的产物纯度问题”、“碘单质在不同溶剂中颜色呈现问题”以及“NH、PH、AsH的键角差异问题”。以期培养学生宏微结合的学科素养,提升教师的学科专业素养。
关键词:轨道能量;相互作用;杂化程度;教学研讨
共价键理论经历了Lewis学说、价键理论和分子轨道理论。福井谦一的著作《化学反应与电子轨道》中认为分子轨道是为了解释分子中电子的行为,而使用了电子的“轨道”这一概念。与前两种理论相比,分子轨道理论着眼于分子的整体性,数学形式更完整,可对许多价键理论无法说明的问题给予较合理的解释,特别在结合计算机技术后,分子轨道理论应用范围进一步扩大。本文将利用分子轨道理论和结合计算机技术对高中化学的几个疑难问题进行分析与解释。
1甲烷氯代反应的纯度问题
当甲烷和氯气反应生成一氯甲烷后,由于氯原子的存在,其高电负性和自身的孤对电子都会对轨道能量产生影响。一方面,高电负性的氯原子有强烈的吸电子效应,使得碳原子带有一定的正电性,间接增加了碳原子的电负性,导致一氯甲烷分子中的HOMO轨道和LOMO轨道的能量降低。另一方面,氯原子上的孤对电子可以与碳氢键的反键轨道相互作用,电子排斥作用增强,使得相应的HOMO轨道能量升高(图1)。
图1一氯甲烷的分子轨道
笔者利用Gaussian 09软件计算得到两种分子的轨道能量,见表1。
表1甲烷和一氯甲烷的能量
计算结果表明,氯原子的孤对电子对HOMO轨道的排斥作用大于其高电负性的吸引作用,故氯原子的存在最终降低了一氯甲烷中反键轨道的能量。因此,一氯甲烷中碳氢键的成键轨道和反键轨道能量的差比甲烷分子中碳氢键的成键和反应轨道能量差更小,即一氯甲烷的碳氢键的键能比甲烷的碳氢键键能更小,相比较甲烷更容易与氯气发生取代反应。继续分析可推知甲烷、一氯甲烷、二氯甲烷和三氯甲烷(氯仿)中碳氢键的键能依次降低,即碳氢键的活性依次升高,越来越容易发生氯代反应。因此,甲烷的氯代反应总是得到四种氯代产物的混合物,即使是过量的甲烷和氯气反应,反应也不会仅停留在生成一氯甲烷这一步上,仍会继续发生取代反应生成其他氯代产物。
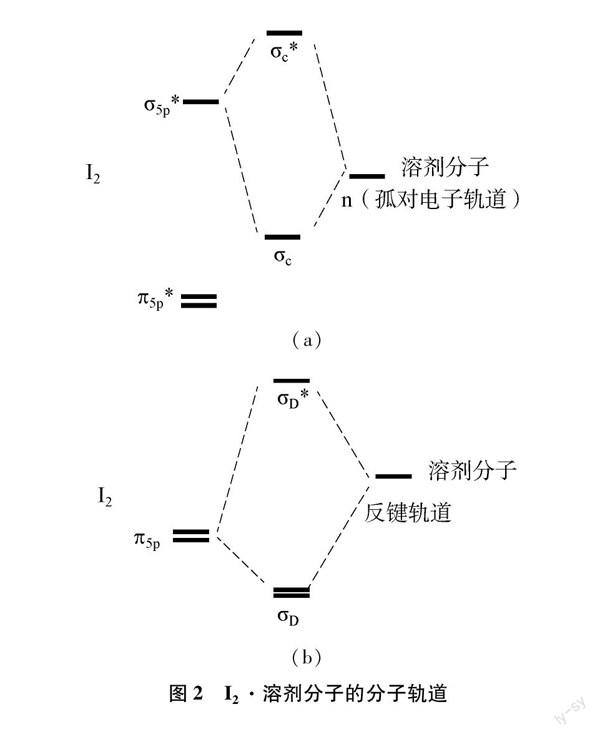
2碘单质在不同溶剂中的颜色问题
碘单质在不同试剂中会出现多种颜色,且颜色区别较大(表2),这类问题同样可以利用分子轨道得到较好的解释。
表2不同碘溶液的颜色
当碘单质溶解后,溶剂分子的分子轨道可能与碘分子的分子轨道产生相互作用。该相互作用不仅增强了I在该溶剂下的溶解度,而且还将改变I在该溶剂中的颜色。一般将这种相互作用分为两类,一类是溶剂分子的轨道和I的σ相互作用(I的σ反键轨道轨道与溶剂占据的轨道对称性相同),从而组合成新的成键轨道σ和反键轨道σ(图2a),由于I·溶剂分子的π和σ轨道间的能量差大于I的π和σ,导致I·溶剂分子的吸收峰向短波方向移动,因而溶液就会偏向红色和棕黄色,如碘的苯溶液、乙醇溶液以及乙醚溶液等。另一类是I的HOMO和溶剂分子的反键轨道相互作用,从而组合成新的成键轨道σ和反键轨道σ(图2b)。同理,I·溶剂分子的轨道能量差也将增加,使得I·溶剂分子的吸收峰像短波方向移动,溶液的颜色发生变化,如碘的丙酮溶液、乙酸乙酯溶液等。
而当溶剂分子的HOMO轨道能量过低时,与碘分子的σ能量差过大,导致相互作用微弱,并不能改变碘分子电子跃迁能级,溶剂分子对碘分子轨道能级几乎无影响,故其碘溶液仍呈现气态分子的紫色,如碘的四氯化碳溶液、二硫化碳溶液。
3 NH与PH、AsH等分子的键角差异问题
NH、PH、AsH的键角数据见表3。
基于VSEPR理论,通常认为:当中心原子不同,但分子杂化方式相同、且配原子种类相同时,中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对间的斥力增大,键角也随之增大,故NH、PH、AsH的键角随之减小。但上述理论却无法解释NH与PH的键角相差较大(13.6°),而PH与AsH的键角相差较小(1.8°)的原因。
试着分析键角数据,不难发现NH分子的键角更接近于sp等性杂化时的键角(109.5°),而PH则更加接近于p轨道的夹角(90°),因此有理由推测两个分子的杂化方式可能存在差异。Pauling认为杂化轨道是由同一个原子中能量相近的不同类型(s,p,d,···)的几个原子轨道波函数相互叠加,而组成同等数目的能量完全相同的杂化原子轨道。故分子的杂化程度与其2s轨道和2p轨道的能量差异有较大关联,事实上,各分子的分子轨道能级高低并不是一成不变而是随分子不同而异。O与F的σ轨道能量低于π轨道的能量,而对于B、C、N等双原子分子的σ轨道能量却是高于π轨道的能量。
实际上轨道的能量高低与轨道自身的节面(电子出现概率为0的地方)有较大关联,而节面越多,电子的钻穿能力越弱,分子轨道的能量就越高。
1s轨道并无节面,而2s轨道存在一个节面,2p轨道同样存在一个节面,存在于竖直方向,3p轨道相比2p轨道又多了一个节面(如图3所示)。
由于节面的电子密度为0,使得电子较难从此处穿过,降低了该轨道电子的钻穿能力,导致该轨道的电子能量上升。2s轨道相比1s轨道增加了一个节面,能量上升,2p轨道虽然存在一个节面,但该节面穿过原子核,因此该节面的存在对电子的钻穿能力影响较小,相当于“零节面”,因此2p轨道能量较低。“节面效应”使得2s和2p的轨道能量接近,从而出现双原子分子如N,C中的s轨道,p轨道能量相互接近而发生sp混杂的现象。而对于O(或F)双原子分子而言,由于第二周期核电荷递增,内层原子轨道轨道离核越近,2s-2p能级差越大,因此不考虑2s和2p的相互作用,即不发生sp混杂。由于两种效应的共同作用,ns(≥3)与np(≥3)相比2s和2p的能级高低差异更大,所以更高周期的同原子双分子的分子轨道更类似于O与F的分子轨道,ns(≥3)与np(≥3)的杂化程度低。
综上所述,NHspPHNH的键角更加接近于109.5°,而PH则更加接近于90°(图4)。对于第四周期(As)以及之后的键角不断下降则是由于中心原子电负性的减小导致的,所以出现了NH与同主族其他简单氢化物的键角差异明显的现象。
4 结语
本文结合分子轨道理论系统分析了氯原子对碳氢键的分子轨道以及溶剂分子对碘分子的分子轨道的影响,解释了相关的取代反应活性问题和溶液颜色变化问题,同时结合分子轨道理论分析了ns和np轨道能量差异问题,较好的解释了NH、PH、AsH的键角差异问题。本文扩大了分子軌道理论在中学化学学习的应用场景,为分子轨道理论与中学化学的衔接提供了更多的角度和可能性。
参考文献
[1]福井谦一.化学反应与电子轨道[M].北京:科学出版社.1985:4
[2] [4]华彤文,王颖霞,卞江,陈景祖.普通化学原理(第4版)[M].北京:北京大学出版社,2013:284-290,278-283
[3] 胡列扬.碘溶液颜色形成的静电作用机制[J].中学化学教学参考,2015(6):47-50

