莓茶提取物对2型糖尿病大鼠糖脂代谢及肝脏SIRT1、AMPK、PGC-1α蛋白表达的影响
肖颖馥 王能 盛文 刘露梅 孙天松 李波男 何清湖
〔摘要〕 目的 探索莓茶提取物對2型糖尿病(type 2 diabetes mellitus, T2DM)大鼠糖脂代谢及肝脏沉默信息调节因子1(silence information regulator 1, SIRT1)、AMP活化蛋白激酶(AMP activated protein kinase, AMPK)、过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α, PGC-1α)蛋白表达的影响。方法 高脂高糖喂养联合链脲佐菌素(35 mg/kg)腹腔注射建立T2DM大鼠模型,建模成功后随机分为模型组、莓茶低剂量组(0.4 g/kg)、莓茶高剂量组(0.8 g/kg),另设普通饲料喂养大鼠为正常组,每组8只。各组灌胃给药6周后,行口服葡萄糖耐量试验计算血糖-时间曲线下面积(area under the curve, AUC),ELISA法检测空腹血胰岛素(fasting insulin, FINS)水平,计算稳态模型以评估胰岛素抵抗指数(homeostatic model assessment for insulin resistance, HOMA-IR),全自动生化分析仪测定血清总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醇(malondialdehyde, MDA)水平,HE染色观察肝脏组织形态学变化,Western blot检测肝脏SIRT1、AMPK、PGC-1α蛋白表达。结果 与正常组比较,模型组FBG、AUC、FINS、HOMA-IR、TC、TG、LDL-C、MDA均明显升高(P<0.01),HDL-C、SOD和SIRT1、AMPK、PGC-1α蛋白表达均明显降低(P<0.01),肝脏组织肝索排列紊乱,肝细胞间隙不清晰,呈脂肪变性改变。与模型组比较,莓茶低剂量组、莓茶高剂量组FBG、FINS、HOMA-IR、TG、MDA均明显降低(P<0.05,P<0.01),SOD和SIRT1、AMPK、PGC-1α蛋白表达均明显升高(P<0.05,P<0.01),肝脏组织肝索排列相对整齐,脂肪变性得到改善;莓茶高剂量组AUC、TC均明显降低(P<0.05),HDL-C明显升高(P<0.05)。与莓茶低剂量组比较,莓茶高剂量组FBG、AUC、FINS、TC、MDA均明显降低(P<0.05),SIRT1、AMPK、PGC-1α蛋白表达均明显升高(P<0.05)。结论 莓茶提取物能在一定程度上改善T2DM大鼠糖脂代谢,减轻胰岛素抵抗,其机制可能与改善氧化应激,调节肝脏SIRT1、AMPK、PGC-1α蛋白表达有关。
〔关键词〕 2型糖尿病;莓茶提取物;氧化应激;沉默信息调节因子1;AMP活化蛋白激酶
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.05.008
Effects of ampelopsis grossedentata extract on glycolipid metabolism and SIRT1, AMPK and
PGC-1α expressions of liver in type 2 diabetes mellitus rats
XIAO Yingfu WANG Neng SHENG Wen LIU Lumei SUN Tiansong LI Bonan HE Qinghu
1. College of Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Laboratory of Andrology, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 4. Hunan University of Medicine, Huaihua, Hunan 418000, China
〔Abstract〕 Objective To explore the effects of ampelopsis grossedentata extract on glycolipid metabolism and silence information regulator 1 (SIRT1), AMP activated protein kinase (AMPK) and peroxisome proliferator-activated receptor-γ coactivator 1-α (PGC-1α) expressions of liver in type 2 diabetes mellitus (T2DM) rats. Methods T2DM rat model was established by high-fat/high-sugar diet combined with streptozotocin injection (STZ, 35 mg/kg) intraperitoneally. Then, T2DM rats were randomly divided into model group, low-dose ampelopsis grossedentata extract group (0.4 g/kg), and high-dose ampelopsis grossedentata extract group (0.8 g/kg), with 8 rats in each one. In addition, normal diet rats (n=8) were set as the normal group. After 6 weeks of gavage administration, oral glucose tolerance tests were performed to calculate the area under the curve (AUC) of glucose-time, fasting insulin (FINS) levels were measured by ELISA, and homeostatic model assessment for insulin resistance (HOMA-IR) was performed. Total cholesterol (TC), triglycerides (TG), high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), superoxide dismutase (SOD) and malondialdehyde (MDA) levels were measured by automated biochemical analyzer. The morphological changes of liver were observed by HE staining, and the protein expressions of SIRT1, AMPK and PGC-1α in liver tissues were measured by Western blot. Results Compared with normal group, fasting blood glucose (FBG), AUC, FINS, HOMA-IR, TC, TG, LDL-C and MDA levels dramatically increased in model group rats (P<0.01), the expressions of HDL-C, SOD, SIRT1, AMPK and PGC-1α decreased significantly (P<0.01), the arrangement of hepatic cord in liver tissue was disordered, the hepatic intercellular space was unclear and hepatic steatosis was exhibited. Compared with model group, FBG, FINS, HOMA-IR, TG and MDA significantly decreased in low- and high-dose ampelopsis grossedentata extract groups (P<0.05, P<0.01), while the expressions of SOD, SIRT1, AMPK and PGC-1α significantly increased (P<0.05, P<0.01), the hepatic cord arrangement was relatively neat, and hepatic steatosis was alleviated. AUC and TC in high-dose ampelopsis grossedentata extract group were significantly lower (P<0.05), while HDL-C was notably higher (P<0.05). Compared with low-dose ampelopsis grossedentata extract group, FBG, AUC, FINS, TC and MDA were significantly reduced, while the expressions of SIRT1, AMPK and PGC-1α significantly increased (P<0.05) in high-dose ampelopsis grossedentata extract group (P<0.05). Conclusion Ampelopsis grossedentata extract can improve glucolipid metabolism and alleviate insulin resistance in T2DM rats to a certain extent. The mechanism may be related to mitigating oxidative stress and regulating expressions of SIRT1, AMPK and PGC-1α in liver.
〔Keywords〕 type 2 diabetes mellitus; ampelopsis grossedentata extract; oxidative stress; silence information regulator 1;AMP activated protein kinase
2型糖尿病(type 2 diabetes mellitus, T2DM)是以高血糖、胰岛素抵抗和胰岛素相对缺乏为主要特征的代谢性疾病,是最常见的糖尿病类型,占所有糖尿病的90%以上[1]。随着疾病进展,可以引起心脏、肾脏、神经、眼部、血管等多种器官病变[2],严重威胁人们的健康,因此,防治糖尿病具有重要意义。目前,防治T2DM的药物以双胍类、α-葡萄糖苷酶抑制剂等为主要代表,长期使用副作用大[3],因此,寻找天然安全的植物替代药具有重要价值和意义。
莓茶是土家族、瑶族、苗族等少数民族传统药茶,由我国民族特色植物——葡萄科显齿蛇葡萄的嫩叶制作而成,已有数百年饮用历史,被收载于《饮膳正要》《中草药汇编》《中华本草》等多部著作中。莓茶味甘、淡,性凉,归肺、肝、胃经,具有清热解毒、平肝降压、活血通络的功效,适用于治疗咽喉肿痛、風热感冒、头昏目胀等[4]。近期研究显示,饮用莓茶可改善T2DM患者的血糖水平和肾功能[5],但其具体机制尚不明确。现代药理研究发现,莓茶中富含的二氢杨梅素等黄酮类物质,可以激活骨骼肌细胞AMP活化蛋白激酶(AMP activated protein kinase, AMPK),AMPK是T2DM的关键信号通路,可以改善糖脂代谢、减轻胰岛素抵抗[6]。沉默信息调节因子1(silenceinformation regulator 1, SIRT1)是与机体代谢密切相关的调节酶,与AMPK存在相互调控的关系,可影响过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α, PGC-1α)和叉头转录因子O1等多种转录因子的表达[7],与活性氧(reactive oxygen species,ROS)的产生直接相关。因此,推测莓茶可能通过影响SIRT1、AMPK和PGC-1α的表达,减轻氧化损伤改善胰岛素抵抗。
因此,本研究通过高脂高糖饲料联合链脲佐菌素(streptozotocin injection, STZ)诱导T2DM大鼠模型,观察莓茶提取物对T2DM大鼠糖脂代谢及胰岛素抵抗的影响。肝脏是胰岛素调节糖脂代谢、维持血糖稳态的重要器官,以肝脏为研究对象,并初步探讨了莓茶对肝脏SIRT1、AMPK和PGC-1α蛋白的影响,以期为后续进一步实验研究提供依据。
1 材料与方法
1.1 动物
32只SPF级Wistar雄性大鼠,8周龄,体质量(320±10)g,购自北京维通利华实验动物技术有限公司,许可证号:SYXK(湘)2019-0009。动物饲养于湖南中医药大学实验动物中心,室内温度(24±2) ℃,相对湿度50%~70%。大鼠均自由摄食、饮水,适应性喂养1周后开始实验。此实验由湖南中医药大学动物实验伦理委员会审核批准,伦理编号:LLBH-202109010001。
1.2 主要药物与试剂
莓茶提取物(湖南省乾坤生物有限公司,批号:20211201);血糖试纸(北京华益精点生物技术有限公司,批号:EC22E0708);STZ、柠檬酸钠缓冲液、超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒、丙二醛(malondialdehyde, MDA)含量检测试剂盒均购自北京索莱宝科技有限公司(批号分别为S8050、C1013、BC0175、BC0025);总胆固醇(total cholesterol, TC)、低密度脂蛋白试剂盒(low-density lipoprotein cholesterol, LDL-C)、高密度脂蛋白测定试剂盒(high-density lipoprotein cholesterol, HDL-C)、甘油三酯(triglycerides, TG)测定试剂盒均购自南京建成生物研究所(批号分别为A111-1-1、A113-1-1、A112-1-1、A110-1-1);SIRT1抗体(英国Abcam公司,批号:ab189494);大鼠胰岛素ELISA试剂盒、AMPKα抗体、PGC-1α抗体、β-actin抗体均购自美国Proteintech公司(批号分别为40001129、10929-2-AP、66369-1-Ig、66009-1-Ig)。
1.3 主要仪器
血糖仪(北京华益精点生物技术有限公司,型号:EZ-8SIM);电子天平(美国双杰公司,型号:JJ224BC);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);高速组织研磨仪、涡旋混合器均购自武汉赛维尔生物科技有限公司(型号分别为KZ-II、MX-F);电热恒温水槽(上海精宏实验设备有限公司,型号:DK-8B);酶标检测仪(美国伯腾仪器有限公司,型号:Epoch);全自动生化分析仪(山东博科生物产业有限公司,型号:BK280);摇床(海门市其林贝尔仪器制造有限公司,型号:TS-92);切片机(浙江金华益迪试验器材,型号:YD-315);包埋机(常州中威电子仪器,型号:BMJ-A);精密pH计(上海雷磁仪器厂,型号:E-201-C);电泳仪、转膜仪均购自北京六一仪器厂(型号分别为DYY-6C、DYCZ-40D);显微镜(麦克奥迪实业集团有限公司,型号:BA210T)。
2 方法
2.1 动物造模分、组与给药
Wistar大鼠适应性喂养1周后,随机分成4组,选取1组为正常组,其余3组进行造模。正常组用普通饲料喂养6周,造模组用高脂饲料喂养6周。6周后,造模组大鼠空腹状态下腹腔注射STZ溶液30 mg/kg(溶于柠檬酸钠缓冲液,pH 4.5)建立T2DM模型[8],正常组腹腔注射30 mg/kg溶媒。注射3 d后,测随机血糖≥16.7 mol/L表示造模成功[9]。血糖不达标的大鼠再次腹腔注射20 mg/kg STZ后,按前述步骤继续观察,若腹腔注射2次血糖仍未达标者,剔除造模组麻醉下处死。造模组大鼠成模后,随机分为模型组、莓茶低剂量组、莓茶高剂量组。将莓茶提取物加入蒸馏水溶解,制成0.1 g/mL溶液,以李佳川等[10]的实验剂量为依据,结合本课题组前期预实验结果,莓茶低剂量组灌胃量为0.4 g/kg,莓茶高剂量组灌胃量为0.8 g/kg,正常组与模型组大鼠用等体积蒸馏水灌胃,1次/d,连续灌胃6周。
2.2 空腹血糖(fasting blood glucose, FBG)及葡萄糖耐量
尾静脉采血法测定大鼠FBG,用碘伏棉球消毒大鼠尾静脉,一次性刺针刺破大鼠尾部毛细血管,试纸条测试区放置出血处,直至血液浸透测试区,血糖仪读取数据后进行记录,连续检测6周。干预6周末,行口服葡萄糖耐量试验(oral glucose tolerance test, OGTT),各组大鼠隔夜禁食12 h,测定FBG后予2 g/kg无水葡萄糖溶液灌胃,分别于糖负荷后0.5、1、1.5、2 h测定血糖值,并根据各时间点血糖值计算血糖-时间曲线下面积(area under the curve, AUC)。
AUCOGTT=(0 h血糖+2×0.5 h血糖+3×1 h血糖+2×2 h血糖)/4[11]。
2.3 空腹血胰岛素(fasting insulin, FINS)及胰岛素抵抗指数(insulin resistance index, HOMA-IR)检测
第6周末次給药前12 h,大鼠禁食不禁水,1.5%戊巴比妥钠麻醉。腹主动脉采血,室温静置1 h,以3000 r/min(半径8 cm)离心15 min,收集上清液,置于-80 ℃冰箱内保存。采用ELISA试剂盒检测大鼠FINS,所有步骤按试剂盒说明书进行。根据各组FINS、FBG数值,计算HOMA-IR。
HOMA-IR=(FBG×FINS)/22.5[12]。
2.4 血脂、氧化应激指标检测
取血清操作同“2.3”,使用全自动生化分析仪测定大鼠血清中TC、TG、HDL-C、LDL-C、SOD、MDA水平。
2.5 HE染色观察肝脏组织形态学变化
末次给药结束后,大鼠禁食12 h,予以1.5%戊巴比妥钠腹腔注射麻醉,冰上操作收集肝脏标本,称量后放置于4%多聚甲醛溶液固定,经脱水,石蜡包埋切片,二甲苯脱蜡,酒精梯度脱水后,进行HE染色,显微镜下观察大鼠肝脏病理形态学变化。
2.6 Western blot检测肝脏SIRT1、AMPK、PGC-1?琢蛋白表达
收集肝脏标本操作同“2.5”。取肝脏组织剪碎,放入2 mL EP管中清洗,加入300 μL RIPA裂解液反复研磨,冰上裂解10 min,4 ℃。以12 000 r/min半径8 cm离心15 min,收集上清液,BCA蛋白定量法测定蛋白浓度。配制10%分离胶、4.8%的浓缩胶,加入TEMED后摇匀灌胶,加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液混合,煮沸变性后进行电泳,转至PVDF膜,封闭液中封闭90 min,加入SIRT1、AMPKα和β-actin抗体,4 ℃过夜,TBST洗3次,每次10 min,加二抗孵育90 min,洗膜,ECL化学发光液与膜孵育1 min,凝胶成像系统成像。
2.7 统计学分析
实验数据使用SPSS 26.0统计软件进行分析,GraphPad Prism 9进行作图。正态分布计量资料以“x±s”表示,组间比较采用单因素方差分析;不满足方差齐性时用非参数检验。以P<0.05表示差异有统计学意义。
3 结果
3.1 莓茶提取物对各组大鼠FBG的影响
干预前后各时间点,模型组FBG明显高于正常组(P<0.01)。干预4周后,莓茶高剂量组FBG明显低于模型组(P<0.05)。干预6周后,莓茶高剂量组、莓茶低剂量组FBG均明显低于模型组(P<0.05,P<0.01)。与莓茶低剂量组比较,莓茶高剂量组干预4周后、干预6周后FBG均明显降低(P<0.05)。详见表1。
3.2 莓茶提取物对各组大鼠血糖的影响
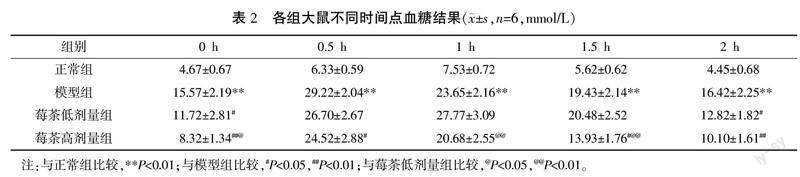
与正常组比较,模型组0、0.5、1、1.5、2 h血糖均明显升高(P<0.01)。与模型组比较,莓茶低剂量组0、2 h血糖均明显降低(P<0.05),莓茶高剂量组0、0.5、1.5、2 h血糖均明显降低(P<0.05)。与莓茶低剂量组比较,莓茶高剂量组0、1、1.5 h血糖均明显降低(P<0.05)。详见表2。
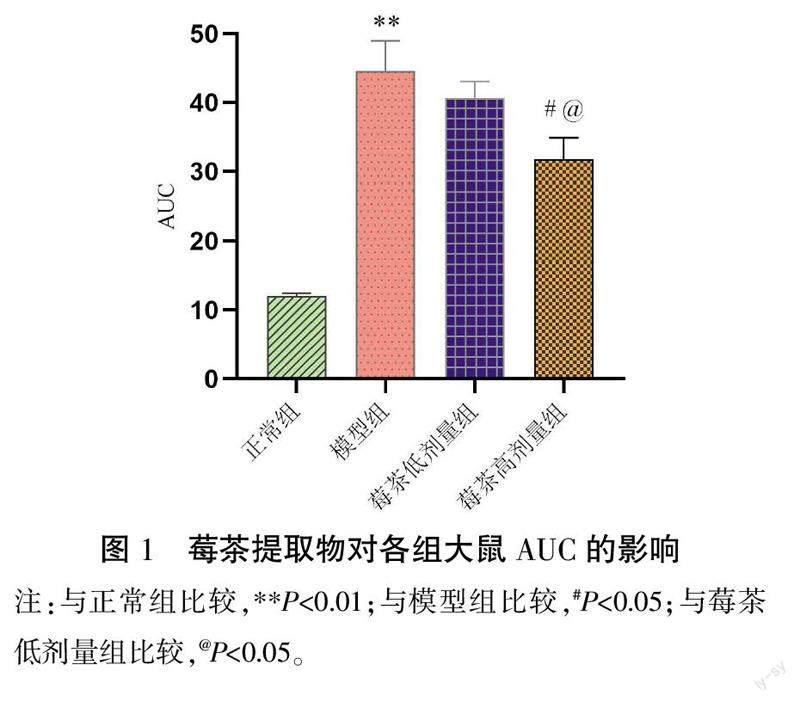
与正常组比较,模型组AUC明显升高(P<0.01)。与模型组比较,莓茶高剂量组AUC明显降低(P<0.05)。与莓茶低剂量组比较,莓茶高剂量组AUC明显降低(P<0.05)。详见图1。
3.3 莓茶提取物对各组大鼠FINS、HOMA-IR的影响
与正常组比较,模型组FINS、HOMA-IR均明显升高(P<0.01)。与模型组比较,莓茶低剂量组、莓茶高剂量组FINS、HOMA-IR均明显降低(P<0.05,P<0.01)。与莓茶低剂量组比较,莓茶高剂量组FINS明显降低(P<0.05)。详见图2。
3.4 莓茶提取物对各组大鼠血脂的影响
与正常组比较,模型组TG、TC、LDL-C均明显升高(P<0.01),HDL-C明显降低(P<0.01)。与模型组比较,莓茶低剂量组TG明显降低(P<0.05);莓茶高剂量组TG、TC均明显降低(P<0.05,P<0.01),HDL-C明显升高(P<0.05)。与莓茶低剂量组比较,莓茶高剂量组TC明显降低(P<0.05)。详见图3。
3.5 莓茶提取物对各组大鼠氧化应激的影响
与正常组比较,模型组SOD含量明显降低(P<0.01),MDA含量明显上升(P<0.01)。与模型组比较,莓茶低剂量组、莓茶高剂量组MDA含量均明显降低(P<0.05,P<0.01),SOD含量均明显升高(P<0.05,P<0.01)。与莓茶低剂量组比较,莓茶高剂量组MDA含量明显降低(P<0.05)。详见图4。
3.6 莓茶提取物对各组大鼠肝脏组织的影响
正常组肝细胞大小均匀,以肝小叶为中心,肝索呈放射状分布,细胞间无充血和水肿,未见明显炎性细胞浸润,偶见小泡性脂肪滴空泡。模型组肝脏组织结构被破坏,肝细胞间隙不清晰,呈脂肪变性改变,肝索排列紊乱,可见炎性细胞浸润,伴有散在点状肝细胞坏死。与模型组比较,莓茶低剂量组、莓茶高剂量组肝脏组织结构形态明显恢复,肝索排列相对整齐,炎性细胞及脂肪变性均有减少。
3.7 莓茶对各组大鼠肝脏组织SIRT1、AMPK、PGC-1α蛋白表达的影响
与正常组比较,模型组SIRT1、AMPK、PGC-1α蛋白表达均显著降低(P<0.01)。与模型组比较,莓茶低剂量组、莓茶高剂量组SIRT1、AMPK、PGC-1α蛋白表达均明显升高(P<0.05,P<0.01)。与莓茶低剂量组比较,莓茶高剂量组SIRT1、AMPK、PGC-1α蛋白表达均明显升高(P<0.05)。详见图6。
4 讨论
T2DM发病的两大基本环节是胰岛素抵抗和胰岛素分泌相对不足,其中,胰岛素抵抗贯穿于T2DM发生、发展的整个过程,糖代谢和脂代谢紊乱是T2DM发生的重要表型,与胰岛素抵抗密切相关[13-14]。胰岛素抵抗是引起糖、脂代谢紊乱的关键环节,高血脂又可以启动氧化应激,损伤胰岛β细胞,影响糖代谢,加重胰岛素抵抗[15]。本实验通过高脂饮食联合STZ成功建立T2DM大鼠模型,发现莓茶提取物可以降低T2DM大鼠的FBG和血脂,改善OGTT,并能够明显降低T2DM大鼠胰岛素抵抗、HOMA-IR,改善其胰岛素抵抗状态。
氧化应激是导致胰岛β细胞功能损伤及外周胰岛素抵抗的重要因素,可以诱发糖尿病[7],在肥胖小鼠肝细胞研究中发现,高水平ROS可以刺激胰岛素抵抗,过氧化氢的消耗则可以改善胰岛素抵抗[16]。MDA是氧自由基攻击生物膜中不饱和脂肪酸而形成的脂质过氧化物,是反应氧化应激损伤的重要指标,可反映機体内脂质过氧化程度和细胞受损伤的程度。SOD是一种抗氧化酶,主要功能是催化超氧阴离子自由基歧化为过氧化氢和氧可以直接捕获和清除自由基,从而消除和减少细胞损伤[17],是反应抗氧化损伤能力的关键指标。本实验结果表明,T2DM大鼠给予莓茶提取物治疗后,MDA含量下降,SOD含量升高,提示莓茶提取物能够增强机体的抗氧化能力有效减轻氧化应激损伤。
肝脏是胰岛素作用的主要靶点之一,是调节糖脂代谢的重要器官。在胰岛素抵抗过程中,肝脏胰岛素信号通路受到破坏,胰岛素不能发挥正常生理作用,造成糖脂代谢紊乱,最终发展为T2DM[18]。本实验研究发现,莓茶提取物能够明显改善T2DM大鼠肝脏的病理变化,经莓茶提取物治疗后,T2DM大鼠肝脏炎性细胞减少,脂肪变性得到改善。AMPK是机体维持细胞内能量平衡、调控全身能量代谢的一种关键能量调节元件。大量研究表明,AMPK在调节糖脂代谢、抗氧化应激等多方面发挥重要作用,AMPK可以促进抗氧化酶的转录表达,抑制ROS的生成,进而发挥抗氧化功能,改善胰岛素抵抗,被认为是糖尿病防控的重要靶点[19-21]。本研究检测了肝脏AMPK蛋白的表达,结果显示莓茶提取物可上调肝脏AMPK的表达,因此,推测莓茶提取物可能通过上调AMPK的表达,改善胰岛素抵抗状态。
SIRT1可介导AMPK的激活[22]。SIRT1和AMPK介导了PGC-1α在葡萄糖代谢中的表达[23]。体内外实验显示,AMPK可以通过增加PGC-1α的表达,促进骨骼肌摄取利用葡萄糖[24]。此外,被激活的SIRT1通过激活PGC1α参与线粒体能量调节,从而减轻氧化损伤。本实验检测了SIRT1、AMPK、PGC-1α蛋白表达的变化,实验结果显示莓茶提取物可以上调T2DM大鼠肝脏组织中SIRT1、AMPK、PGC-1α蛋白的表达,提示莓茶提取物可能通过干预肝脏SIRT1、AMPK、PGC-1α蛋白表达,改善氧化损伤和胰岛素抵抗。
综上所述,莓茶提取物对高糖高脂联合STZ诱导的T2DM大鼠糖脂代谢具有改善作用,可改善胰岛素抵抗、减轻氧化损伤,可能与影响肝脏AMPK、SIRT1、PGC-1α蛋白的表达相关。值得关注的是,糖尿病前期是糖尿病发展的前驱阶段,对糖尿病前期进行有效干预可以减少甚至逆转糖尿病的发生[25]。莓茶提取物是否可以改善糖尿病前期胰岛素抵抗状态,减缓甚至逆转糖尿病的发生,有待于进一步研究。
参考文献
[1] ZHENG Y, LEY S H, HU F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications[J]. Nature Reviews Endocrinology, 2018, 14(2): 88-98.
[2] 陈 锋, 张 帆, 郝二伟, 等. 中药多糖防治糖尿病及其并发症的作用机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(12): 256-266.
[3] SIAVASH M, TABBAKHIAN M, SABZGHABAEE A M, et al. Severity of gastrointestinal side effects of metformin tablet compared to metformin capsule in type 2 diabetes mellitus patients[J]. Journal of Research in Pharmacy Practice, 2017, 6(2): 73-76.
[4] 何清湖, 王 炜. 莓茶与健康[M]. 北京: 中国中医药出版社,2022: 30-35.
[5] RAN L, WANG X L, LANG H D, et al. Ampelopsis grossedentata supplementation effectively ameliorates the glycemic control in patients with type 2 diabetes mellitus[J]. European Journal of Clinical Nutrition, 2019, 73(5): 776-782.
[6] ENTEZARI M, HASHEMI D, TAHERIAZAM A, et al. AMPK signaling in diabetes mellitus, insulin resistance and diabetic complications: A pre-clinical and clinical investigation[J]. Biomedecine and Pharmacotherapie, 2022, 146: 112563.
[7] SINGH V, UBAID S. Role of silent information regulator 1 (SIRT1) in regulating oxidative stress and inflammation[J]. Inflammation, 2020, 43(5): 1589-1598.
[8] WANG L, WANG Z Y, YU Y, et al. Metabolomics analysis of stool in rats with type 2 diabetes mellitus after single-anastomosis duodenal-ileal bypass with sleeve gastrectomy[J]. Frontiers in Endocrinology, 2022, 13: 1013959.
[9] WANG Z, LI Q Q, HUANG C K, et al. Determination of CYP450 activities in diabetes mellitus rats by a UHPLC-MS/MS method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2023, 224: 115191.
[10] 李佳川, 李思穎. 基于分子对接技术的藤茶总黄酮对高尿酸血症肾功能损伤保护机制研究[J]. 中草药, 2021, 52(3): 727-735.
[11] LINGVAY I, BEETZ N, SENNEWALD R, et al. Triple fixed-dose combination empagliflozin, linagliptin, and metformin for patients with type 2 diabetes[J]. Postgraduate Medicine, 2020, 132(4): 337-345.
[12] BIAGETTI B, SIM?譫 R. Acromegaly: Diabetes and HOMA-IR[J]. Endocrinologia, Diabetes y Nutricion, 2021, 68(1): 1-2.
[13] 郑园园, 王 健, 蒋剑平, 等. 玄参多糖对2型糖尿病大鼠糖脂代谢及肝胰岛素信号通路的影响[J]. 中草药, 2020, 51(6):1586-1592.
[14] 周 杨, 高明松, 彭 聪, 等. 五味子联合阿卡波糖对2型糖尿病小鼠胰岛素抵抗及降血糖作用机制研究[J]. 湖北中医药大学学报, 2022, 24(3): 12-15.
[15] STRINGER D M, ZAHRADKA P, TAYLOR C G. Glucose transporters: Cellular links to hyperglycemia in insulin resistance and diabetes[J]. Nutrition Reviews, 2015, 73(3): 140-154.
[16] AHMED B, SULTANA R, GREENE M W. Adipose tissue and insulin resistance in obese[J]. Biomedicine and Pharmacotherapy, 2021, 137: 111315.
[17] 王 萍, 冯树军, 王 宇, 等. 透刺经筋法对周围性面瘫患者血清SOD、NO水平及免疫功能的影响[J]. 陕西中医, 2022, 43(4): 527-530.
[18] HE F, HUANG Y R, SONG Z, et al. Mitophagy-mediated adipose inflammation contributes to type 2 diabetes with hepatic insulin resistance[J]. The Journal of Experimental Medicine, 2021, 218(3): e20201416.
[19] MENG Q H, QI X, FU Y, et al. Flavonoids extracted from mulberry (Morus alba L.) leaf improve skeletal muscle mitochondrial function by activating AMPK in type 2 diabetes[J]. Journal of Ethnopharmacology, 2020, 248: 112326.
[20] DINIZ T A, DE LIMA JUNIOR E A, TEIXEIRA A A, et al. Aerobic training improves NAFLD markers and insulin resistance through AMPK-PPAR-α signaling in obese mice[J]. Life Sciences, 2021, 266: 118868.
[21] WANG L, TANG J H, WANG L, et al. Oxidative stress in oocyte aging and female reproduction[J]. Journal of Cellular Physiology, 2021, 236(12): 7966-7983.
[22] 楊 娴, 阮金兰. 鸡血莲黄酮通过调节AMPK/Sirt1/NF-κB信号通路改善小鼠非酒精性脂肪肝的实验研究[J]. 中医药导报, 2021, 27(4): 10-14.
[23] ZHANG Y, ZHOU B, WEN M, et al. ZG02 improved hepatic glucose metabolism and insulin sensitivity via activation of AMPK/Sirt1 signaling pathways in a high-fat diet/streptozotocin-induced type 2 diabetes model[J]. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, 2020, 13: 4333-4339.
[24] SANG A, WANG Y, WANG S, et al. Quercetin attenuates sepsis-induced acute lung injury via suppressing oxidative stress-mediated ER stress through activation of SIRT1/AMPK pathways[J]. Cellular Signalling, 2022, 96: 110363.
[25] MANGAN A, DOCHERTY N G, LE ROUX C W, et al. Current and emerging pharmacotherapy for prediabetes: Are we moving forward[J]. Expert Opinion on Pharmacotherapy, 2018, 19(15): 1663-1673.

