家族性腺瘤性息肉病相关硬纤维瘤的分子机制及诊疗进展
葛赛,王晰程△
1 北京大学肿瘤医院暨北京市肿瘤防治研究所消化肿瘤内科 北京 100142
2 北京大学肿瘤医院暨北京市肿瘤防治研究所恶性肿瘤发病机制及转化研究教育部重点实验室 北京 100142
硬纤维瘤(desmoid tumors,DT),又称硬化性纤维瘤、侵袭性纤维瘤病,是一种罕见的成纤维细胞肿瘤,没有远处转移的能力,但具备局部侵袭的潜能,占全部软组织肿瘤的3%不到,年化发病率为(2~4)/100万[1-2],发病高峰年龄段为30~40岁,女性和男性发病比例为2∶1[3-4]。大部分DT 为散发出现,其中5%~10%为家族性腺瘤性息肉病(familial ade⁃nomatous polyposis,FAP)相关DT[5-7]。FAP 是一种常染色体显性遗传病,约1%的结直肠癌由FAP 所致,FAP 主要由腺瘤性结肠息肉病(adenomatous polyposis coli,APC)基因突变引起,该病以结直肠广泛分布腺瘤样息肉为临床特征。FAP相关DT大部分发生在腹腔内或腹壁,是DT 最严重的类型,约11%的FAP 患者死于DT[8-9],但其生物学行为又各不相同,60%患者诊断后生存时间超过10年[10-11]。总体而言,FAP相关DT是一类罕见疾病,临床工作中容易误诊、漏诊及选择错误的治疗方案,本文结合文献就FAP相关DT的分子机制及诊疗进展进行述评。
1 FAP相关DT的临床特征
1962年,Gardner[12]首次报道一个FAP 家族,该家族成员既有大量肠道息肉,又合并骨瘤、表皮囊肿和DT等肠外病变,FAP合并DT、骨瘤三联征又被称为Gardner综合征。10%~20%的FAP患者可能合并DT[13]。FAP 患者发生DT 的风险为普通人群的852倍[14]。Gardner 综合征的DT 发病高峰年龄段为28~31岁,但任何年龄都有可能发生,此类DT的发生可能先于肠道息肉,是Gardner 综合征的首发临床表现。虽然DT 为良、恶交界性肿瘤,不会发生远处转移,但其部分生物学行为具有高度侵袭性,可造成患者发生相关并发症或死亡。尤其是侵及肠系膜的DT可能造成病变与空腔脏器之间形成瘘管、穿孔、梗阻或出血等。因腹腔内DT易侵犯重要脏器造成手术难度较高,且即使是完全切除病灶后其复发率也极高,因此对于FAP合并腹腔内DT的患者,除发生肠梗阻、尿道梗阻、脏器缺血等严重并发症必须手术外,近年来已不推荐手术治疗作为该类患者首选的治疗方法。由于FAP 患者大部分在30 岁之前即接受预防性肠道切除术[15],FAP 相关DT 尤其好发于手术部位(如,结肠切除术后的肠系膜或腹壁、回肠贮袋—肛管吻合口),手术史是FAP 患者发生DT 明确的独立危险因素[13-16]。既往研究报道罹患腹腔内DT的FAP患者中68%有腹部手术史,多在手术后5年内发生腹腔内DT[17]。我中心既往报道的FAP相关DT患者的诊断时间为术后7~62 个月,中位诊断时间为术后21个月[18]。
除手术史外,妊娠史和创伤史也被证实与DT的发生显著相关[17,19]。妊娠相关创伤(包括既往剖宫产的手术伤口瘢痕[19])和高雌激素水平可能都参与DT的发生,但高雌激素水平与DT相关的证据主要来自个案报道和回顾性报道[20]。约30%的DT 患者有既往创伤史[21],尤其是FAP患者的手术创伤史。
2 与FAP 相关DT 的发生及严重程度相关的基因表型
绝大部分FAP 患者携带APC基因胚系突变,但FAP相关DT的生物学行为却不大相同,部分FAP相关DT进展缓慢甚至可自发缓解,部分进展迅速最终导致患者死亡。关于DT的发生及严重程度与APC基因胚系突变表型相关性研究已被广泛报道。2015年,Church等[22]报道了由克利夫兰消化疾病研究中心收集的77 例FAP 相关DT 患者APC基因胚系突变位点与DT的发生及严重程度的相关性数据,结果显示APC基因胚系突变位点位于密码子400 的5’端、密码子401至密码子1 400及密码子1 400的3’端的FAP患者发生DT 的比例分别为14.9%、23.2%和37.1%。此外,Church 等[22]根据DT 的大小、症状(腹痛、梗阻、出血等)、生长速度对DT 的严重程度进行分型(见表1)。该研究结果提示症状严重甚至威胁生命的需积极干预的Ⅲ~Ⅳ级DT 在上述三类患者中的比例分别为0、29.5%及43.5%。我中心既往报道了我国16例FAP相关DT的基因—表型分析数据提示在密码子1 062的3’端和5’端发生Ⅲ~Ⅳ级DT的比例分别为14.3%和77.8%,且全部3例突变位点位于密码子1 400的5’端的FAP 患者所合并DT 均为Ⅲ~Ⅳ级[18]。前述研究结果提示靠近APC5’端的突变位点,尤其是密码子1 400之后的FAP患者在考虑预防性手术切除时机选择时,需同时考虑术后发生高度危险性DT的可能性。尤其应慎重评估可否在FAP 肠道息肉可控制的情况下延迟预防性全结直肠切除的手术时机。

表1 克利夫兰FAP相关腹部DT严重程度的分型[22]
3 FAP相关DT的分子机制研究进展
3.1 Wnt/β-连环蛋白信号通路
Wnt/β-连环蛋白信号通路与DT之间的关系已被广泛研究[23-24]。Wnt蛋白家族涉及脏器形成、干细胞更新、细胞存活等多个重要功能,调节β-连环蛋白在细胞质和细胞核内的表达水平,经典的Wnt/β-连环蛋白信号通路是涉及胚胎发育、组织稳态最关键的级联信号通路之一[25]。在没有Wnt配体的情况下,细胞质中存在的β-连环蛋白分子被腺瘤性息肉病结肠蛋白APC和支架蛋白Axin、糖原合酶激酶3β(GSK3β)和酪蛋白激酶1(CK1)共同形成的破坏复合物结合和加工[26]。一旦β-连环蛋白与破坏复合物结合,它就会依次被CK1α 和GSK3β 磷酸化。磷酸化的β-连环蛋白与E3 泛素连接酶β-转导重复蛋白(β-TrCP)相互作用,该蛋白靶向其蛋白酶体降解,从而将β-连环蛋白的细胞质浓度维持在低水平,并阻止其易位到细胞核[27]。在Wnt/β-连环蛋白信号通路没有被激活的状态下,细胞核中的TCF/LEF 蛋白与Groucho蛋白相互作用,共同作为转录抑制因子起到抑制细胞生长的作用。
而当Wnt 配体存在的情况下,在细胞膜上形成了一个包含Fzd蛋白和低密度脂蛋白受体相关蛋白5和6(LRP5/6)的受体复合物,诱导LRP5/6 被GSK3β磷酸化和CK1α的二次磷酸化。随后,过量的Dvl 蛋白和Axin 蛋白被招募到细胞膜上,通过Dvl 与Fzd 蛋白的c 端尾部相互作用,Axin 蛋白与过度磷酸化的LRP5/6相互作用造成β-连环蛋白与破坏复合物隔绝,从而抑制β-连环蛋白的磷酸化,从而导致大量胞质β-连环蛋白的蓄积,并转移到细胞核取代Groucho 蛋白与TCF/LEF 转录因子结合,导致下游信号通路的激活。
全外显子组测序和基因组分析可识别几乎所有患者样本中的CTNNB1和Wnt信号通路调节蛋白的改变[28]。绝大部分APC基因的胚系突变会造成APC 蛋白截短及连环蛋白调节结构域的丢失,使得细胞中β-连环蛋白发生蓄积并进一步激活转录因子TCF3、TCF4[29]。在伤口愈合的增殖期,成纤维细胞中的β-连环蛋白水平和TCF 转录活性有所升高[30]。转基因小鼠模型中细胞内β-连环蛋白的蓄积会导致间充质细胞增殖、运动性和侵袭力失调,并诱发DT[30]。
DT 患者Wnt 信号通路的失调导致参与增殖和纤维化的Wnt 信号通路相关基因过度表达,包括参与血管生成调节的VEGF,启动激活生长因子受体PDGFRα 和PDGFRβ 的COX2,以及ADAM12、Fap-1α、WISP1和SOX11等[31-32]。鉴于此,目前关于Wnt信号通路的抑制剂相关治疗试验已经开展多年,治疗靶点包括小分子抗血管生成药物、COX2 抑制剂等,但由于Wnt 信号通路功能高度保守性,找到有效且不损害细胞正常修复、成体干细胞功能的药物仍是药物研发的难点,定位为Wnt 抑制剂的各种早期临床研究尚无阳性结果报道。
3.2 Notch信号通路
由于Notch信号通路和Wnt信号通路存在相互作用,关于Notch信号通路抑制剂的开发成为近年来DT相关的研究热点。与Wnt信号通路一样,Notch信号通路在进化上是高度保守的,在细胞发育和分化中起着重要作用,具有从胚胎发育到稳态维持等关键功能[33]。Notch信号通路包括4个受体(Notch 1~4)和至少5个配体【Jagged1(JAG1)、 JAG2,delta-like 1(DLL1)、DLL3、DLL4】。Notch受体包含三个结构域:胞外结构域(NECD)、跨膜结构域(NTMD)和胞内结构域(NICD)。在与配体结合后,Notch 受体蛋白依次被金属蛋白酶家族成员(ADAM10/17)和γ 分泌酶连续裂解,释放NICD,然后易位到细胞核,与转录因子结合激活下游信号通路。
3.3 Hedgehog信号通路
研究发现一系列Hedgehog 信号通路相关分子(GLI1、PTCH1、HHIP)在DT 组织中显著上调,而Hedgehog 信号通路通过将间充质祖细胞维持在分化较低、更大增殖潜能的状态,可能以类似的方式影响DT细胞的增殖[34]。
4 FAP相关DT的治疗
需要指出的是,由于DT 为罕见的软组织肉瘤,目前相关治疗指南的制定、试验的设计大部分是针对散发的DT,而尚无专为FAP 相关DT 制定的诊疗规范及临床试验。
4.1 积极的监测
10%~20%的DT 患者的肿瘤可能发生自发消退。研究证实观察等待可将DT 临床干预的时间显著推迟[35-37],故目前美国硬纤维瘤协作组指南认为几乎所有无症状的DT 患者都应接受一段时间的主动监测。尤其是FAP 相关DT,多发生在肠道切除手术后,二次手术导致手术操作困难程度进一步增加。而存在症状、监测后持续进展或解剖部位(如头/颈、肠系膜)可能随DT进展而发生功能破坏的患者则需要积极治疗[38]。根据美国硬纤维瘤协作组指南的诊治流程,在经过粗针穿刺活检明确DT的病理诊断后,积极的监测时间(每3~6 个月复查MRI)可长达2年,观察到连续2 次甚至3 次肿瘤进展后才考虑治疗。2022年ESMO 会议报道的Ⅲ期DeFi 临床研究[39]提示安慰剂组无进展生存期(progression-free survival,PFS)为15.1个月,索拉非尼Ⅲ期研究提示安慰剂组的疾病缓解率为20%(均为部分缓解)[40],虽然其中FAP 所占全部患者比例为10%左右(绝大部分为散发DT),但提示部分患者自然进程即存在自发缓解倾向,对无症状或症状轻微患者需要充分观察后再进入积极治疗。同时需要注意的是,位于胸腹盆腔的DT,往往不易被察觉,且体积较大,更容易压迫重要脏器引起临床症状甚至出现严重并发症,故此部位的DT在治疗时机及方案的选择方面,相较四肢躯干的DT 更为积极。而FAP 相关DT 大部分发生在腹盆腔,因此这类患者的观察等待结束时机需个体化制定。对于存在症状、肿瘤体积逐步增大或即将危及邻近组织结构功能的DT仍需采取积极干预模式。
4.2 手术治疗
FAP 患者的腹腔内DT由于常发生弥漫性浸润肠系膜,常为多发性,通常不可切除。尝试切除DT通常需要切除部分小肠,术后可能出现包括肠缺血、粘连所致梗阻、瘘管形成等严重并发症[41]。一项回顾性报道提示6 例经历减瘤手术的DT 患者中,4 例出现DT 侵袭性进展[42]。这可能与前文提到的创伤后瘢痕形成过程中,成纤维细胞中的β-连环蛋白水平和TCF转录活性有所升高,造成Wnt信号通路被激活有关。多项回顾性研究提示DT 切除后的复发率较高,且复发肿物通常比初始DT 更具侵袭性[43-44]。2011年荷兰报道的一项回顾性研究,评估62 例FAP 合并腹腔内DT 患者的临床结局,中位随访时间为8年,结果显示保守治疗(保守治疗的选择包括塞来昔布、舒林酸、伊马替尼、化疗、介入治疗等)和手术治疗患者的临床结局相当(10年PFS 率:49%vs.33%)[37]。目前药物治疗亦可选择小分子抗血管生成药物和Notch 抑制剂,因此,手术治疗已不再是DT 首选的治疗方案。根据美国硬纤维瘤协作组的推荐,只有腹壁的DT 首选治疗方案为手术治疗[38],因为此类手术容易达到R0切除且不会带来严重并发症,DT切除可能需要植皮或皮瓣重建以关闭缺损及尽量降低疝的发生风险。鉴于DT易于复发的倾向,重建应考虑到未来再次切除和重建的可能性。总而言之,多学科管理对于DT 是非常重要的。因为一旦手术介入,后期监测模式一定发生改变。
4.3 药物治疗
由于DT总体发病率低,目前尚无药物治疗先后顺序的推荐,总体治疗原则建议遵循药物低毒性至高毒性循序渐进原则。
4.3.1 细胞毒类药物蒽环类药物是最常报道的治疗DT的药物,基于多柔比星的单药或联合方案自20世纪90年代开始被广泛报道。2022年ASCO 报道的一项来自美国的多中心研究提示,应用脂质体多柔比星治疗21 例腹腔内DT 患者的客观缓解率(ob⁃jective response rate,ORR)达66.7%,其中8 例为FAP 相关DT 患者,而19 例腹腔外DT 患者的ORR 仅为5.26%。此外由于DT 患者相对年轻,该研究中并没有急性或长期的心脏毒性的报道。尚缺乏联合化疗的前瞻性Ⅱ期临床研究报道,一项回顾性研究提示[45],使用多柔比星(60~90 mg/m2)和达卡巴嗪(750~1 000 mg/m2)联合治疗的11 例DT 患者,中位治疗周期为5 个周期,9 例可评估患者中有6 例客观缓解(2例完全缓解,4例部分缓解)。此联合治疗最常见的副作用是心脏毒性、骨髓抑制、黏膜炎和恶心。甲氨蝶呤联合长春碱类药物是经典的DT化疗方案。我国一项回顾性研究显示[46],71例DT患者接受长春瑞滨联合小剂量甲氨蝶呤的化疗,疾病控制率(dis⁃ease control rate,DCR)为87.3%,ORR 为35.2%,2、3、5年PFS率分别为79.9%、68.4%和36.3%。
4.3.2 小分子TKI抗血管的小分子TKI类药物治疗DT的基本原理是抑制Wnt信号通路靶基因产物的活性,包括VEGFR和PDGFR等。伊马替尼是最早用于治疗DT 的靶向药物,如表2所示,不论是口服小剂量或大剂量伊马替尼,ORR均不足20%,1年PFS率为37%~67%。索拉非尼治疗DT 的Ⅲ期临床试验数据已于2018年发布[40],该研究共纳入87例DT患者(50 例口服索拉非尼治疗,37 例口服安慰剂治疗),剂量为每天400 mg,ORR 为33%,索拉非尼组1年的PFS 率为87%。值得注意的是,安慰剂组同样观察到20%的患者的肿瘤发生自发消退,安慰剂组1年的PFS 率为43%。索拉非尼最常见不良反应包括皮疹、高血压、乏力、疼痛。2019年公布的培唑帕尼在DT中的Ⅱ期临床试验的数据提示[47],48例每天接受培唑帕尼治疗(800 mg)的患者,其ORR 与索拉非尼相近,达到33%,12个月PFS率达到86%。
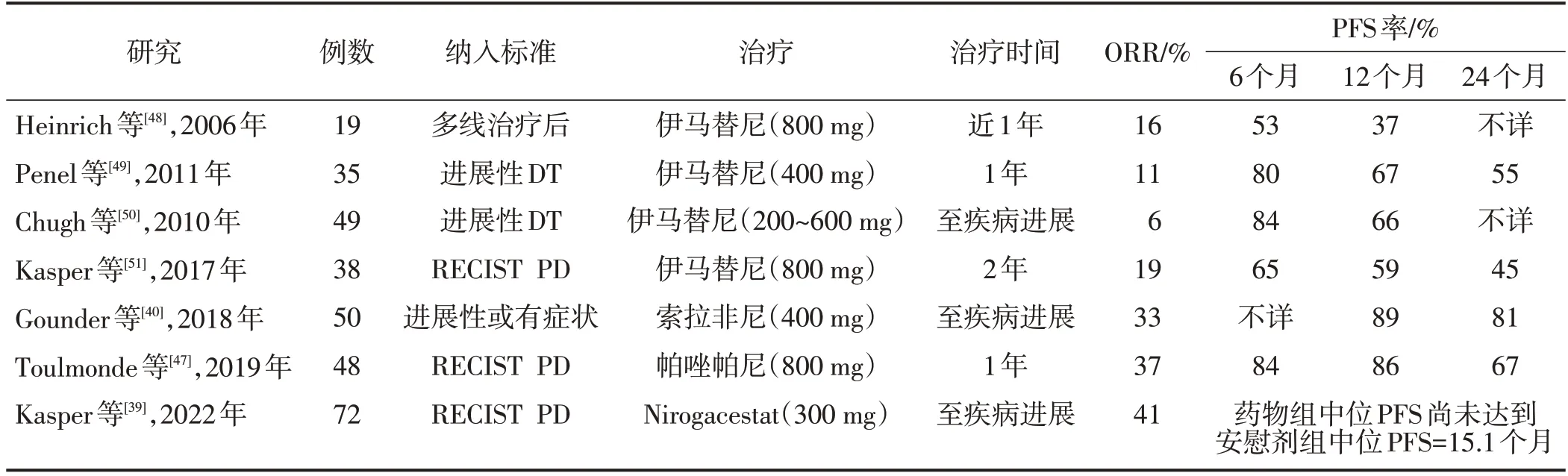
表2 小分子靶向药物在DT治疗中的有效性和生存数据
4.3.3 Notch 抑制剂如前所述,Notch 信号通路和Wnt信号通路存在密切的相互作用,通过抑制γ分泌酶的蛋白水解活性可防止NICD的释放及其向细胞核的易位,从而阻断下游信号通路的激活。目前已有多个小分子γ 分泌酶抑制剂被报道在DT 显示出不俗的抗肿瘤活性,其中最为瞩目的药物是口服的γ分泌酶抑制剂Nirogacestat(PF-03084014)。2022年ESMO大会上公布了Ⅲ期DeFi研究[39]的阳性结果,该研究共纳入来自欧洲和北美37 个国家的142 例进展性DT 患者(RECIST 标准评价为疾病进展或一线治疗后的患者),患者平均分配至每日2 次150 mg 的Nirogacestat组和安慰剂组,中位随访时间19.2个月,PFS 在Nirogacestat 组未达到,安慰剂组为15.1 个月(HR=0.29;P<0.001)。药物总体安全性良好,95%为1/2 级不良反应,其中最常见的是腹泻(84%)、恶心(54%)、疲劳(51%)、低磷血症(42%)和斑丘疹(32%)。另一个迈入Ⅲ期研究的药物是同时在ESMO 公布的AL102(RINGSIDE 试验),已于2021年3月启动,计划纳入192 名进展性DT 患者,初步结果提示低剂量和高剂量组均有效。
4.4 局部治疗
既往研究表明,单用放疗(50~60 Gy)或不完全切除DT 患者采用手术联合放疗可使70%~80%的DT得到长期局部控制[52-54],但上述研究均为散发DT 报道,目前关于FAP 相关DT 的局部治疗暂无推荐证据。美国硬纤维瘤协作组建议放疗的适应证是药物治疗不可行或效果不佳及老龄患者[38]。介入治疗在本病尚无大规模数据报道,前文提到的62 例FAP 合并腹腔内DT 患者中[37]有2 例计划接受介入治疗,但均由于未找到供血血管治疗而治疗失败。
5 小结
由于预防性手术的推行,DT已成为FAP 相关的第二大死亡原因。由于FAP相关DT大部分在腹腔内或腹壁,是DT最严重的类型,其干预措施和临床干预的积极程度与散发DT也有所不同。预防性肠道切除术后对于DT 的监测是必要的,尤其是有DT 家族史、女性、妊娠后及APC突变位点在密码子1 400的5’端的FAP 患者。治疗方面,手术治疗已经不再是首要推荐,而包括Notch 抑制剂在内的新型药物为DT的全身治疗带来新的希望。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。