新生儿窒息早期脑损伤患者血清IL-6、NSE、乳酸水平变化及临床意义
习颖,贾阳,安婷婷,苏芬玲,张磊
1.空军军医大学唐都医院儿科,陕西 西安 710000;2.西安大兴医院新生儿科,陕西 西安 710000
新生儿窒息属于围生期因为血液循环及呼吸障碍,导致新生儿在出生后1 min 出现只有心跳而没有规律性或自主呼吸的缺氧症状,新生儿窒息能导致诸多系统发生缺氧、缺血性损害,其中,脑损伤是最为常见的一种损害[1]。脑损伤包括多种类型,如缺氧缺血性脑病、脑水肿、颅内出血等,病情严重时还会危及新生儿的生命,为造成新生儿智力障碍、脑瘫及死亡的一个关键因素。相关文献显示,国内由于新生儿严重脑损伤残疾的患儿为27%左右,所以及时确诊并实施科学有效的干预,意义重大[2]。白细胞介素-6 (interleukin-6,IL-6)为具有多细胞源性、多功能的一种细胞因子,在正常生理状况下,脑内神经元、血管内皮细胞、胶质细胞等诸多细胞都可以分泌IL-6,然而其水平较低[3]。于脑组织遭遇损伤之后,脑内合成IL-6 明显增加,同时于血液、脑脊液中释放,导致局部IL-6表达提升,能够间接地对脑组织损伤度进行反映[4]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)在糖酵解期间发挥调节功能,主要在神经内分泌细胞及中枢神经系统内的神经元中表达,具有神经组织高度特异性,为可靠性较高的一种成活体体内外成熟神经元标志物,在诊断神经元损伤方面敏感性较高[5]。窒息后由于缺血缺氧,糖酵解提升,但是人体乳酸清除的能力却降低,导致乳酸水平显著提升[6]。相关研究显示,乳酸水平能够反映脑组织缺血、缺氧状况及颅脑灌注压情况[7]。本研究旨在探讨新生儿窒息早期脑损伤患者血清IL-6、NSE、乳酸水平的变化及其临床意义,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2020 年6 月至2022年6月在空军军医大学唐都医院诊治的108 例窒息新生儿的临床资料。纳入标准:(1)同新生儿窒息相关标准[8]相符;(2)单胎妊娠;(3)出生时体质量超过2 500 g;(4)胎龄超过35 周;(5)患儿出生后5 min 内Apgar 评分<7 分,同时脐动脉血气pH 不足7.15;(6)临床资料完整。排除标准:(1)染色体不正常;(2)先天性出生缺陷;(3)先天遗传代谢或先天畸形导致的脑损伤;(4)伴有感染性疾病;(5)合并神经肌肉疾病;(6)由于新生儿水肿使Apgar 评分较低。按照头颅超声结果分为脑损伤组42 例和无脑损伤组66 例。脑损伤组中男性25 例,女性17 例;孕周37~40 周,平均(39.13±0.58)周;体质量2.58~4.17 kg,平均(3.42±0.36) kg。无脑损伤组中男性39 例,女性27 例;孕周36~40 周,平均(38.97±0.61)周;体质量2.62~4.15 kg,平均(3.36±0.40)kg。两组患儿的基本资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 方法 (1)头颅超声检查:所有新生儿在出生后6 h 之内进行头颅超声检查,若其出现下述任意一项就诊断为脑损伤:①脑室发生改变,侧脑室变窄,表现为裂隙状,甚至消失;②发生脑水肿;③脑实质回声增强。(2)血清IL-6、NSE、乳酸水平检测:所有新生儿在出生后6 h 内收集5 mL 静脉血,其中少量进行乳酸检测,其余部分置入分离凝胶促凝管,并放于4℃环境中静置45 min,之后保持3 000 r/min 的速率8 min,分离血清,存放在-20℃环境中等待检测。选择酶联免疫吸附法对IL-6、NSE 水平进行测定,选择全自动血气分析仪AΒL90FLEX对乳酸水平进行测定。(3)新生儿行为神经测定(neonatal behavioral neurological assessment,NΒNA)评分[9]:于采血当日,使用NΒNA评分对患儿的脑功能进行评估,满分40 分,NΒNA 评分越低提示脑损伤程度越重。
1.3 统计学方法 应用SPSS20.0 统计软件进行数据统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,采用Pearson 相关系数进行相关性分析,同时采用多元Logistic 回归性分析显著性因素。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿的血清IL-6、NSE、乳酸水平及NΒNA评分比较 脑损伤组患儿的IL-6、NSE、乳酸水平明显高于无脑损伤组,NΒNA评分明显低于无脑损伤组,差异均有统计学意义(P<0.05),见表1。
表1 两组患儿血清IL-6、NSE、乳酸水平及NBNA评分比较(±s)Table 1 Comparison of serum IL-6,NSE,lactate levels,and NBNA score between the two groups(±s)
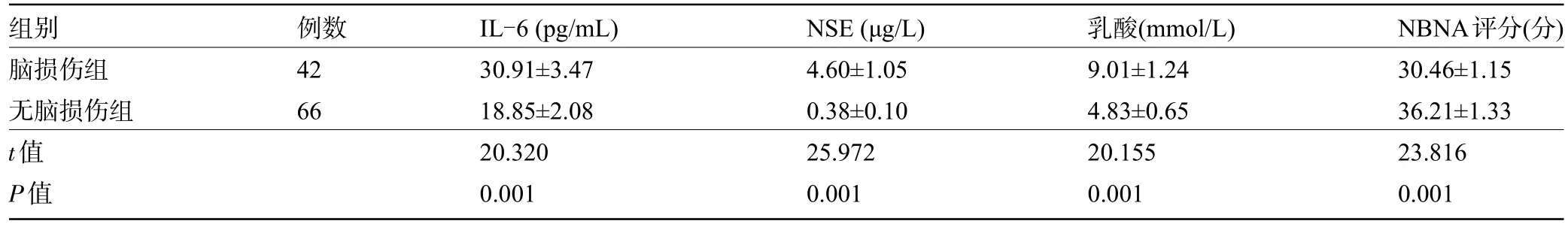
表1 两组患儿血清IL-6、NSE、乳酸水平及NBNA评分比较(±s)Table 1 Comparison of serum IL-6,NSE,lactate levels,and NBNA score between the two groups(±s)
组别脑损伤组无脑损伤组t值P值例数42 66 IL-6(pg/mL)30.91±3.47 18.85±2.08 20.320 0.001 NSE(μg/L)4.60±1.05 0.38±0.10 25.972 0.001乳酸(mmol/L)9.01±1.24 4.83±0.65 20.155 0.001 NΒNA评分(分)30.46±1.15 36.21±1.33 23.816 0.001
2.2 新生儿窒息早期脑损伤患儿血清IL-6、NSE、乳酸水平与NΒNA 评分的相关性 经Pearson相关性分析结果显示,新生儿窒息早期脑损伤患儿血清IL-6、NSE、乳酸水平与NΒNA 评分均呈负相关(r=-0.573、-0.736、-0.552,P=0.001、0.001、0.001)。
2.3 新生儿窒息早期脑损伤的危险因素 经多元Logistic回归性分析结果显示,IL-6、NSE、乳酸水平及NΒNA 评分为新生儿窒息早期脑损伤的独立危险因素(P<0.05),见表2。
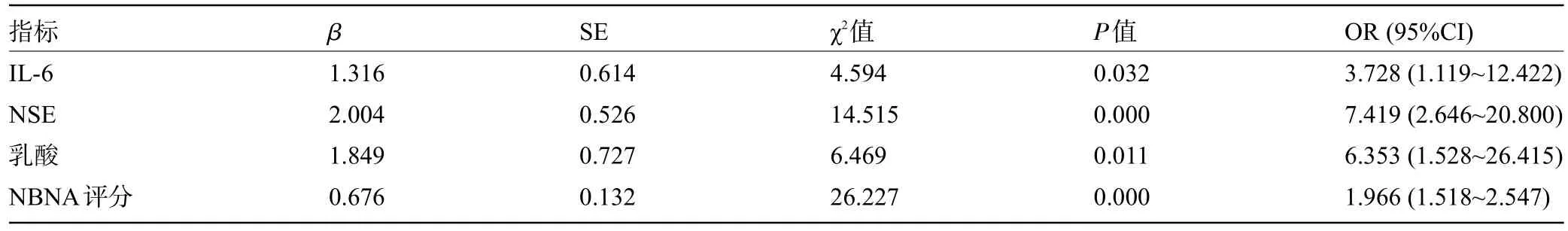
表2 新生儿窒息早期脑损伤危险因素的多元Logistic回归性分析Table 2 Multivariate Logistic regression analysis of risk factors for early brain injury in neonatal asphyxia
3 讨论
新生儿窒息引发的脑损伤的严重类型包括脑水肿、缺氧缺血性脑病及颅内出血等,极易引发神经元坏死,且具有不可逆性,严重威胁患儿的生命安全。相关研究显示,新生儿窒息的发生率为1.79%左右,是新生儿死亡的一个关键因素[10]。目前,新生儿窒息对多个器官功能产生损伤已被广大医学工作者广泛关注,特别是脑损伤领域的研究逐渐被重视。分析评估新生儿窒息后脑损伤严重度的指标,在改善其预后方面极其重要。
IL-6 属于功能广泛的一种多效细胞因子,主要产生于脑室边缘处的星形胶质细胞,但是在大脑皮层、海马、下丘脑或脑干结构等脑区中主要由神经元产生[11]。IL-6是新生儿窒息出现后引发缺氧、缺血性脑病发病时,较为明确的一种细胞因子,一旦脑组织处于缺血、缺氧状况下,就会经MEK/ERK途径加快脑动脉壁位置的单核巨噬细胞产生大量肿瘤坏死因子-α、核因子-κΒ等,此类因子能够对诸多细胞发挥直接作用,加快IL-6 的表达,同时伴随窒息与脑损伤的加重而逐渐增加[12-13]。本研究显示,新生儿窒息早期脑损伤患儿的IL-6 水平明显高于无脑损伤患儿,提示IL-6 参与脑损伤的发生过程,且经多元Logistic 回归性分析显示,IL-6为新生儿窒息早期脑损伤独立危险因素。
正常生理情况下,体液中的NSE 表达水平极低,若神经组织遭遇创伤之后,受损的脑神经细胞会释放大量NSE,同时进入血液与脑脊液内,所以NSE 表达能够成为评估神经损伤的有效分子标志物之一[14]。除此之外,新生儿窒息患者的NSE 表达会显著提升,同时窒息程度也同脑损伤有一定关系。相关文献显示,中枢神经系统在缺血、缺氧、应激及创伤状况中,NSE水平会显著提升,同时伴随脑损伤程度的加重而逐步增加[15]。本研究显示,新生儿窒息早期脑损伤患儿的NSE 水平明显高于无脑损伤患儿,且经多元Logistic回归性分析显示,NSE为新生儿窒息早期脑损伤独立危险因素,提示NSE能够有效评估新生儿窒息早期脑损伤。
乳酸为无氧酵解的最终产物,在窒息状态下,人体组织缺氧会增强糖酵解,进而提升乳酸表达。新生儿窒息会导致缺氧,这也是引发脑损伤的关键原因,脑组织在缺氧、缺血状态下,无氧分解活动会活跃,使乳酸堆积,进而增加H+,降低神经细胞外与内的pH,而pH 的降低又会导致生化指标、自身功能特点及神经细胞结构异常,且体感诱发电位及大脑放电的缺乏会进一步侵害神经细胞,最终引发脑细胞死亡的瀑布样反应[16]。诸多研究表明,乳酸的神经毒性具有直接性,加之,脑组织细胞非常敏感于低氧血症,早期乳酸水平能够对神经损伤状况进行评估,若乳酸水平超过9 mmol/L,其诊断中、重度脑损伤的特异性及灵敏性分别为67%、84%[17-18]。本研究显示,新生儿窒息早期脑损伤患儿的乳酸水平明显高于无脑损伤患儿,且经多元Logistic 回归性分析显示,乳酸为新生儿窒息早期脑损伤独立危险因素,提示乳酸水平能在一定程度上对窒息新生儿是否出现脑损伤进行判断。
综上所述,新生儿窒息早期脑损伤患者血清IL-6、NSE、乳酸水平明显较高,且血清IL-6、NSE、乳酸水平是新生儿窒息早期脑损伤的独立危险因素。

