青年肥胖患者左心室应变与心外膜脂肪厚度的关系
刘敏娜 陈文苏 李菲 胡晓芹 李承宗 张超群 朱孝成 王志荣
221000 徐州医科大学附属医院心内科
肥胖的发病率逐渐上升,过去20年中国居民超重率和肥胖率均显著增加[1]。内脏脂肪增多是肥胖的主要表现,与心血管疾病密切相关[2]。心外膜脂肪组织(epicardial adipose tissue,EAT)是内脏脂肪组织的一种,具有新陈代谢、产热和心脏的机械保护特性[3]。但持续的热量过剩会导致内脏脂肪组织扩张积聚,从而扩大正常的EAT,并改变其表型[4]。已有相关文献报道,EAT的累积损害了左心室的收缩和舒张功能[5-6]。然而,既往研究人群多为中老年患者,目前对青年肥胖患者的研究较少。
二维超声心动图是一种可靠、方便、经济和非侵入性的测量EAT的方法[7]。常规超声心动图往往无法发现微小的心功能不全,而形变成像技术可以提供关于心室力学的额外信息,具有良好的重复性[8]。本研究旨在探讨青年肥胖患者超声心动图测量的EAT厚度与左心室应变的关系。
1 对象和方法
1.1 研究对象
纳入2021年3月至2022年3月在徐州医科大学附属医院拟行减重手术的121例青年肥胖患者,年龄18~40岁。排除标准:收缩性心力衰竭病史、左室射血分数(left ventricular ejection fraction,LVEF)<50%、合并明显瓣膜病变(中重度狭窄或关闭不全)、心包疾病、心房颤动、心肌炎、急性心肌缺血、活动性感染、肺栓塞、先天性心脏病、心脏手术、图像不清晰。本研究获得徐州医科大学附属医院伦理委员会的批准(伦理号:XYFY2022-KL244),并取得了所有参与者的知情同意。
1.2 方法
测量并记录患者的身高、体重、腰围、臀围,计算体质指数(body mass index,BMI)。中国成人肥胖诊断标准为BMI ≥ 28.0 kg/m2[9]。计算腰围(cm)与臀围(cm)的比值为腰臀比(waist-to-hip ratio,WHR)。高血压定义为未使用降压药物的情况下诊室收缩压≥140 mmHg和(或)舒张压≥90 mmHg,或既往高血压病史或使用抗高血压药物。糖尿病定义为空腹血糖(fasting blood glucose,FBG)≥7.0 mmol/L或糖化血红蛋白(glycosylated hemoglobin,HbA1c)≥6.5%,或正在使用降血糖药物。根据肝脏超声检查,肝前场回声增强、后场回声衰减,肝内管道结构显示不清等特征诊断脂肪肝。
1.3 常规超声心动图检查
手术前,由一位经验丰富的超声医生进行盲法常规超声心动图检查。使用Philips IE33彩色多普勒超声心动图诊断仪,进行经胸超声心动图检查。所有超声心动图测量均根据最新指南进行[10]。应用M型二维超声心动图测量LVEF、左室短轴缩短率(left ventricular fractional shortening,LVFS)、舒张末期室间隔厚度(interventricular septal thickness,IVST)、左室后壁厚度(posterior wall thickness,PWT)和左心室舒张末期内径(left ventricular end diastolic diameter,LVEDd)、左心房内径(left atrial diameter,LAD),利用Devereux公式对左心室质量(left ventricular mass, LVM)校正,并用体表面积标准化,计算LVM指数(left ventricular mass index,LVMI)。应用频谱多普勒技术测量二尖瓣口舒张早期流速E峰和舒张晚期流速A峰,通过组织多普勒成像测量二尖瓣环侧壁及间隔舒张早期速度(e’),计 算E/A、E/e’。用Simpson双平面法于心尖四腔和心尖两腔测量左心房容积(left atrial volume,LAV),取其平均值,并用体表面积标准化,计算左心房容积指数(left atrial volume index,LAVI)。
1.4 超声心动图测量EAT厚度
EAT定义为心肌外壁和心包脏层间的无回声空间,按照文献共识,测量EAT的标准是在胸骨旁左室长轴切面,选择在收缩末期右室前壁垂直测量心外膜脂肪最厚处厚度(图1A),连续测量3次取其平均值[11]。
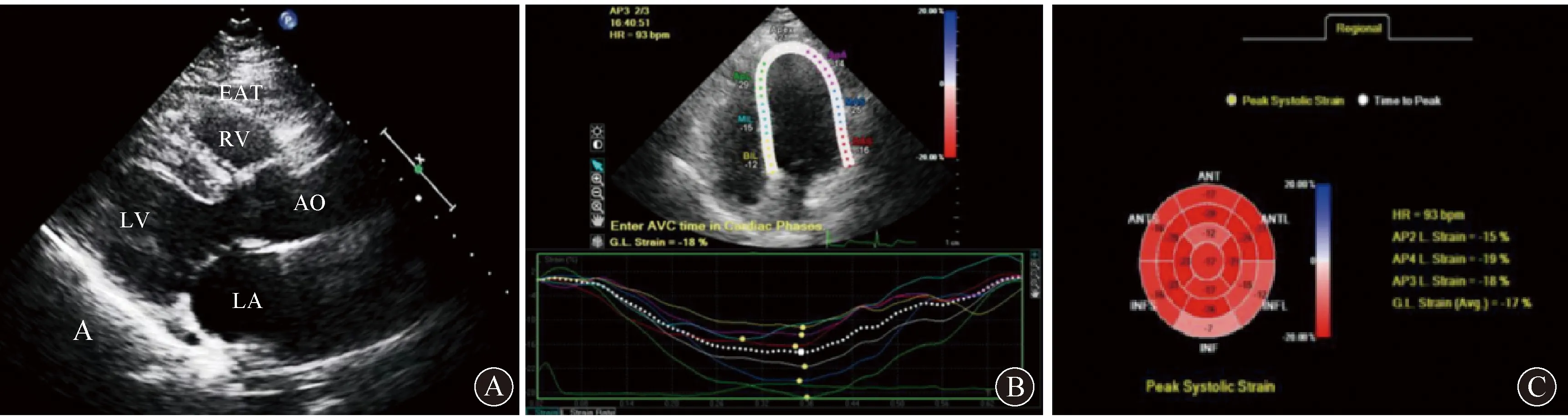
LA:左心房;LV:左心室;RV:右心室;AO:主动脉;EAT:心外膜脂肪组织
1.5 二维斑点追踪超声心动图检查
采集并储存心尖四腔、三腔、二腔切面的动态二维图像,尽量显示清晰的左室结构,每幅图像至少包括3个完整的心动周期。利用QLab软件中的CMQ软件进行分析,获得左室17节段收缩期整体纵向应变(global longitudinal strain,GLS),表示为绝对值(图1B、1C)。根据使用2D-STE的临床研究,GLS已被确定为心肌功能障碍成像的早期标志物[12],GLS<18%表明存在临床前收缩功能障碍[13]。利用HFA-PEFF评分表进行舒张功能评分[14]。其中,HFA-PEFF评分主要基于超声心动图和利钠肽水平,评分≤1分表示诊断为射血分数保留性心力衰竭(heart failure with preserved ejection fraction,HFpEF)可能性很小,2~4分表示诊断HFpEF存在不确定性,建议进一步评估。
1.6 实验室检查
入院次日空腹采血,测定白细胞计数、高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)、FBG、HbA1c、N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)、C肽、尿酸、血肌酐、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)等。
1.7 统计学方法

2 结果
2.1 患者临床基线特征比较
如表1所示,与GLS≥18%组比较,GLS<18%组患者的WHR、TC、TG、LDL-C、HbA1c和hs-CRP均较高(均为P<0.05),其他基线资料均相似,差异无统计学意义(均为P>0.05)。
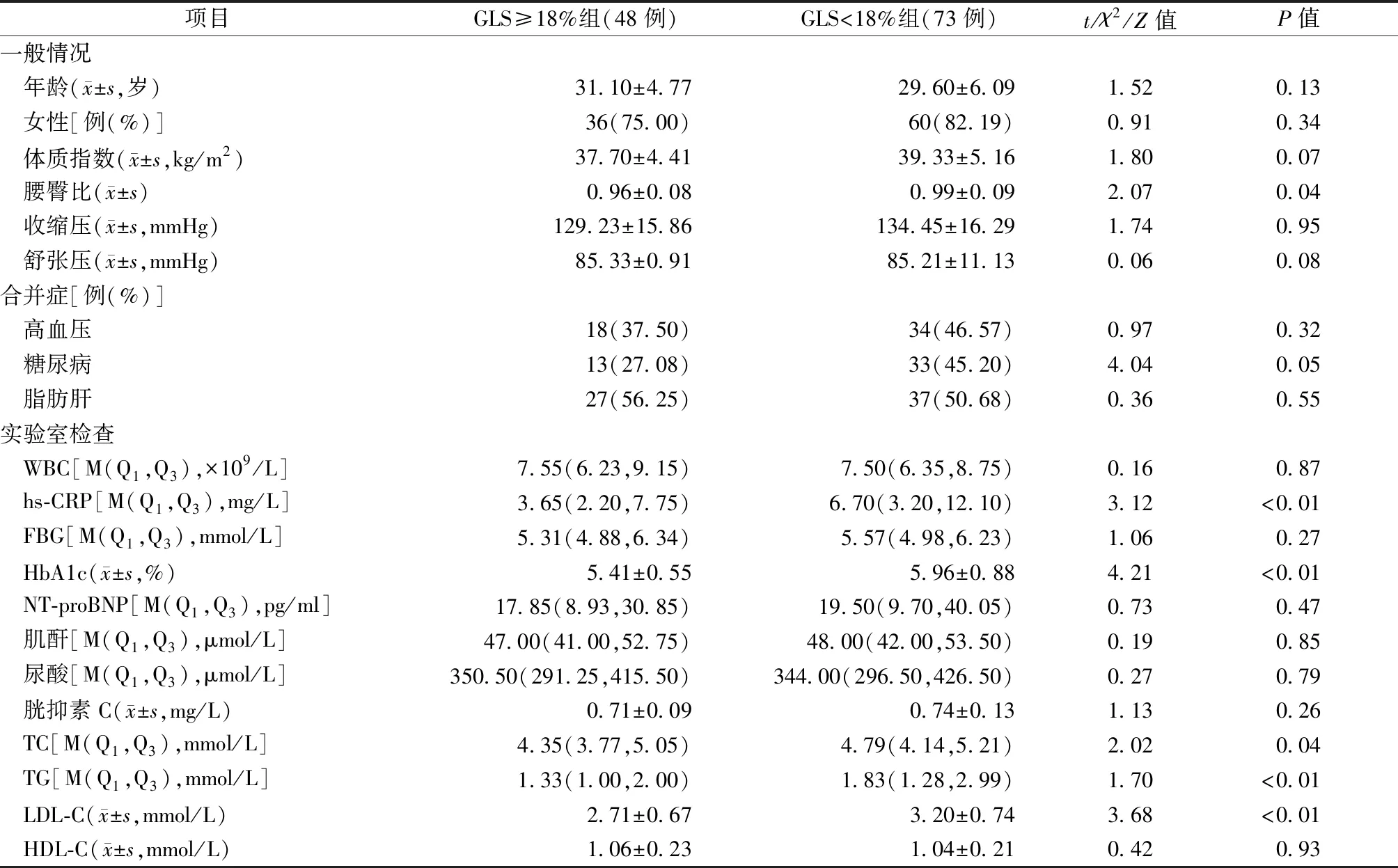
表1 两组的基线资料比较
2.2 患者心脏结构和功能的比较
如表2所示,GLS<18%组患者E/e’、LAV、LAVI、EAT和HFA-PEFF评分均显著高于GLS≥18%组患者(均为P<0.05),但两组的其他指标差异无统计学意义(均为P>0.05)。
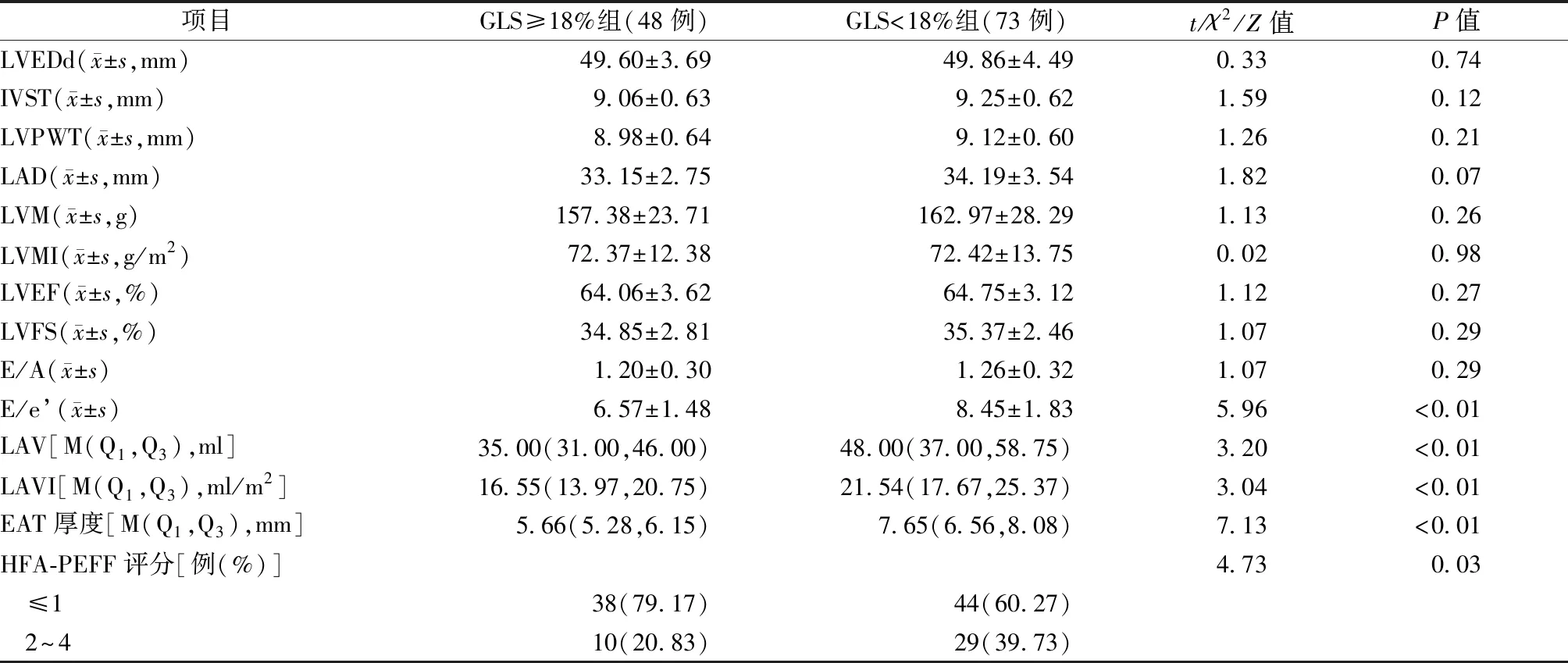
表2 两组的心脏结构和功能比较
2.3 线性回归分析
对左心室GLS的影响因素进行线性回归分析,单因素线性回归分析结果显示,BMI、WHR、EAT厚度、TG、LDL-C、HbA1c、hs-CRP均与左心室GLS线性相关(均为P<0.05)。
将有意义的单因素回归分析的变量(P<0.05)进入多变量模型时,结果显示EAT厚度、LDL-C、HbA1c和hs-CRP均与左心室GLS独立相关(均为P<0.05,表3)。EAT厚度每增加1个单位,GLS将降低1.32%;LDL-C每增加1个单位,GLS将降低0.62%;HbA1c每增加1个单位,GLS将降低0.52%;hs-CRP每增加1个单位,GLS将降低0.06%。
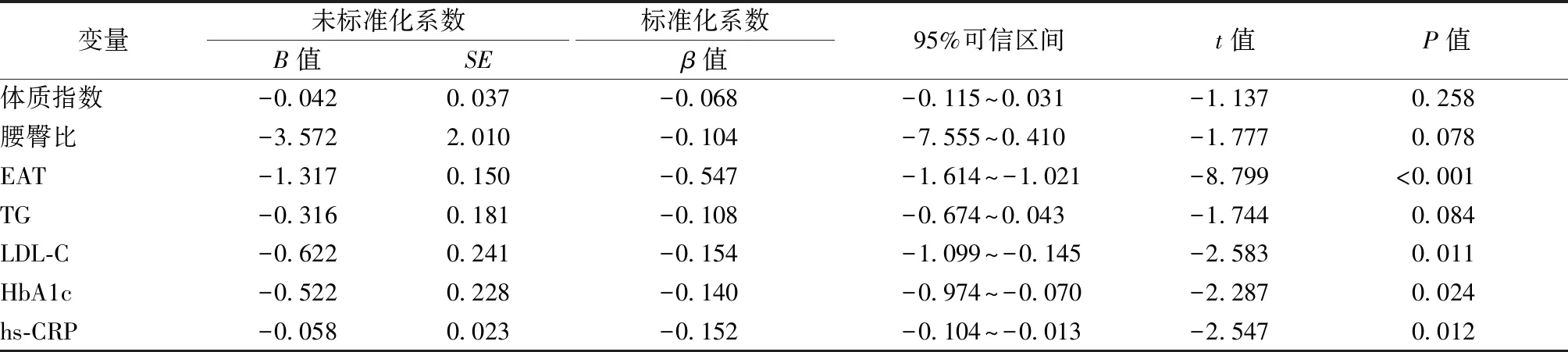
表3 多因素线性回归分析结果
3 讨论
本研究通过超声心动图检查来探讨EAT特征与青年肥胖人群左心室功能的关系。发现年轻女性居多(79.34%),38.02%合并糖尿病。虽然心脏结构正常,但EAT厚度增加,60.33%(73/121)患者GLS<18%,舒张功能异常比例高。多因素线性回归分析发现EAT厚度与左心室GLS独立相关;且随着EAT厚度的增加,心脏收缩和舒张功能会下降。EAT厚度与左心室功能的早期损害显著相关。
EAT与心脏结构和功能有关。Watanabe等[6]报道超声心动图测量EAT厚度与收缩期二尖瓣环速度和组织二尖瓣环位移百分比呈负相关,表明EAT与左室收缩功能障碍的发展有关。Homsi等[15]发现尽管射血分数正常,肥胖者的EAT体积增加,左心室收缩功能受损。Ng等[16]对射血分数保留患者的心功能分析发现,EAT容量和厚度与早期收缩功能受损均呈正相关。这与我们的研究结果是一致的,射血分数正常时左室收缩功能受损可视为肥胖型心肌病的早期征兆,并可能与室壁僵硬和间质纤维化有关[17]。
肥胖者的左心室GLS受损预示舒张期功能障碍[18]。Iacobellis等[19]发现EAT与心房大小和舒张期功能相关。Lu等[20]发现EAT体积和密度增高都与无冠状动脉疾病人群的心脏结构和功能相关。Fernandes-Cardoso等[21]发现,与健康的正常体重受试者相比,病态肥胖受试者的EFT更高,左心房内径扩大,P波离散度延长,左心室射血分数也较低。Koepp等[22]发现EAT沉积过多的HFpEF肥胖者的静息和运动时的血流动力学均显著受损,心室的相互依赖性增加,运动能力降低。上述改变均与EAT有关,提示心脏肥胖症和肥胖性心肌病间有重要的相互作用。然而,目前尚未证实这些细微的功能障碍是否会在肥胖持续时间较长的情况下进展为明显的心力衰竭。
EAT与心肌直接接触,代谢活跃。在低氧化应激下,EAT可以分泌一种胰岛素增敏激素-脂联素,其具有抗糖尿病、抗动脉粥样硬化和炎症的作用,可保护心肌细胞免受肥大刺激,并限制心肌的炎症和纤维化,保护心肌细胞。在肥胖、代谢综合征患者中,心外膜脂肪细胞分泌的脂联素和瘦素均少于健康人,脂联素表达降低会减弱内皮功能,并导致肿瘤坏死因子α产生增加,从而增加炎症和氧化应激[23]。瘦素水平升高促进单核细胞黏附、巨噬细胞转化为泡沫细胞以及脂肪组织中脂质和炎性细胞因子水平升高等改变[24]。升高的促炎细胞因子和脂肪因子可能通过内分泌和旁分泌引起邻近心肌的炎症[25]。EAT含量的增加通过炎症和代谢机制,促进心肌纤维化的发展[26-27]。心肌TG的蓄积和心肌纤维化是肥胖患者出现左心室功能障碍的重要机制[28]。
本项研究还发现LDL-C、HbA1c和hs-CRP均与左心室GLS独立相关。血脂、血糖异常可以通过增加血流动力学超载和神经体液激活,或通过产生促炎性脂肪因子,直接或间接影响心脏[29]。脂肪组织是产生hs-CRP的重要来源,它与脂联素和抗炎蛋白水平相互关联[30]。一项针对高血压患者的小样本研究报告,EAT和hs-CRP水平升高均与左室舒张功能障碍相关[31]。Cho等[32]的研究也证实,EAT厚度和hs-CRP水平的增加与亚临床心肌功能障碍明显相关。
我们的研究有一些局限性。(1)此为单中心研究,样本量较小,随访时间短。(2)超声心动图的EAT评估不能反映EAT的容量,而其他成像手段,如多层计算机断层扫描和心脏磁共振成像能更好地估计EFT容量。然而,这两种检查更昂贵、更难以获得。
总之,在青年肥胖群体中,我们证明了EAT与左心室功能的不良改变有关。需要进一步研究EAT对心脏重塑的作用机制、长期细微功能变化是否进一步进展为明显的心力衰竭,以及针对心外膜脂肪的干预措施等。
利益冲突:无