基于网络毒理学与分子对接技术初步探究准噶尔乌头炮制减毒的作用机制
李晓娟, 汤新乐, 热孜亚·艾力木江, 赵翡翠
(1新疆医科大学第四临床医学院, 乌鲁木齐 830054; 2新疆医科大学第六附属医院检验科, 乌鲁木齐 830092;3新疆医科大学附属中医医院药学部; 4新疆中药炮制研究重点实验室, 乌鲁木齐 830054)
准噶尔乌头(AconitumsoongaricumStapf.)为毛茛科植物准噶尔乌头的块根,主产于新疆北部,其性辛、苦、大热、有毒,多炮制减毒后使用,具有祛风散寒、消肿止痛、通经活络的功效,临床上主要用于镇痛、抗炎、抗肿瘤的治疗[1]。本课题组前期研究发现,通过“加热水煮”的炮制方法可降低准噶尔乌头的急性毒性,并验证了准噶尔乌头对心脏毒性的主要成分[2-3]。准噶尔乌头炮制品成分复杂,对其毒理学的研究主要集中在心肌细胞方面,未涉及到毒性靶蛋白[4-6]。传统“单成分-单靶点-单通路”揭示心脏毒性机制具有一定局限性,可能会遗漏一些毒性成分和毒性靶点,而通过网络毒理学构建“毒性成分-成分靶点-疾病靶点-通路”多维网络生物模型,能够阐明复杂的分子机制。本研究采用网络毒理学和分子对接技术对准噶尔乌头心脏毒性作用机制进行预测,挖掘其炮制产物中的心脏毒性成分和毒性靶点,现报道如下。
1 材料与试药
心肌细胞H9c2(普赛诺生物公司),准噶尔乌头碱(成都曼斯特生物技术有限公司,A0824),乌头碱(成都曼斯特生物技术有限公司,A0196),苯甲酰乌头原碱(成都曼斯特生物技术有限公司,A0631),LY294002(MCE,HY-10108)。
2 方法
2.1 准噶尔乌头心脏毒性成分的筛选通过TCMSP 2.3[7](https://www.tcmsp-e.com/)和文献检索准噶尔乌头的化学成分,以OB≥20%,DL≥0.1为标准筛选活性成分,通过TOXNET数据库挑选具有毒性的成分,得到准噶尔乌头中全部的毒性成分。
2.2 化合物-作用靶点预测及网络构建在有机小分子生物活性数据库(Pubchem)[8](https://pubchem.ncbi.nlm.nih.gov)中下载准噶尔乌头心脏毒性成分的2D结构化学式,导入Pharmmapper数据库[9](http://lilab-ecust.cn/pharmmapper/index.html)预测准噶尔乌头心脏毒性成分的靶点,以“Normalized Fit Score>0.9”为基准筛选高相关度靶点,经蛋白质(Uniprot)数据库[10](https://www.uniprot.org/)完成基因名(Gene Symbol)比对。采用Cytoscape 3.7.2软件构建“药物-成分-靶点”网络图[11]。
2.3 心脏毒性潜在靶点的获取心脏毒性关键词主要包括:心衰、心律不齐、房颤、心房扑动、心动过缓、心脏毒性等[12]。经CTD数据库[13](https://ctdbase.org/)、TTD数据库[14](http://db.idrblab.net/ttd/)、DisGeNET数据库[15](https://disgenet.org)、GeneCards数据库[16](https://www.genecards.org/)检索心脏毒性相关靶点。将4个数据库信息的合集作为心脏毒性靶点。
2.4 准噶尔乌头心脏毒性关键靶点的获取将“2.2”项下得到的毒性成分靶点与“2.3”项下检索到的心脏毒性靶点,经Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)在线工具获取准噶尔乌头心脏毒性的关键靶点,绘制韦恩图。
2.5 蛋白-蛋白相互作用(PPI)将关键靶点导入蛋白质相互作用(String 11.5)数据库[17](https://www.string-db.org/,去除游离靶点,经Cytoscape 3.7.2软件可视化分析,用Cytohubb插件进行网络特征分析,构建PPI拓扑图。
2.6 基因功能注释和作用途径分析使用R4.1.3软件(https://bioconductor.org/)及相关程序包[18],绘制关键基因的基因本体(GO)功能分析和京都基因和基因组百科全书(KEGG)的气泡图和条形图。
2.7 分子对接实验采用分子对接完成准噶尔乌头主要毒性成分与核心靶点的结合模式预测。归纳“2.6”项下靶点和通路之间的对应关系,选择前9个核心靶点和毒性成分。经Uniprot数据库获取核心靶点蛋白晶体结构,Pubchem数据库获取化合物3D结构。采用OpenBabel 2.3.2软件(https://openbabel.org/)、PyMOL 2.2.0软件(https://pymol.org/2/)、Autodock Tool(ADT)1.5.7软件[19](https://autodock.scripps.edu/)对蛋白质和化合物进行文件格式转换、加氢、去水、去配体等预处理,设置对接参数、生成活性口袋并运行对接。以最低结合能的复合物作为优势模式构象,对其氢键可视化分析[20]。
2.8 心肌细胞毒性实验
2.8.1 乌头碱、准噶尔乌头碱和苯甲酰乌头原碱母液的配制 用CMC-Na配制乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的母液,浓度分别为:50、100、150 mg/mL,使用前用DMEM稀释至所需浓度,混匀后使用。
2.8.2 细胞培养 取复苏心肌细胞H9c2至含有胎牛血清和青-链霉素中的DMEM培养基中培养,待贴壁密度达到80%时,加入0.25%胰酶溶液铺于细胞平面,待75%左右细胞脱落时用无菌PBS冲洗停止消化,显微镜下调至合适的细胞密度传代培养。
2.8.3 CCK-8法测定乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的IC50取“2.8.2”项下对数期细胞,于DMEM完全培养基中制备单细胞悬液,接种至96孔板中,放入37℃、5%CO2孵箱培养24 h后,加入梯度浓度药物(各6个复孔,检测3次),继续培养24 h,再加20 μL WST-8,培养2 h,检测光密度值(A450),计算IC50,抑制率=(1-A浓度组/A对照组)×100%。
2.8.4 不同浓度乌头碱、准噶尔乌头碱和苯甲酰乌头原碱对心肌细胞形态的影响 按“2.8.3”项下方法制备单细胞悬液,置于96孔板中,培养24 h,空白组(空白完全培养基),处理组(乌头碱的低、中、高浓度为0.2、0.4、0.6 mg/mL;准噶尔乌头碱的低、中、高浓度为0.3、0.6、0.9 mg/mL;苯甲酰乌头原碱组的低、中、高浓度为0.5、1.0、1.5 mg/mL),各组处理24 h后,100倍倒置荧光显微镜下观察细胞形态。
2.8.5 乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的乳酸脱氢酶(LDH)漏出率 按“2.8.3”项下方法制备单细胞悬液,按“2.8.4”项下方法分组,置于96孔板中,培养细胞密度达到80%,加入处理组和空白组溶液,孵育,按LDH试剂盒说明书测定490 nm处吸光度值,计算LDH漏出率[21]。另取对数生长细胞,置于96孔板中培养24 h,贴壁,加入梯度浓度单体溶液,按细胞毒性试剂盒说明书操作检测不同浓度单体对细胞的毒性,分为3组,每组5个重复。
2.8.6 检测乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的心肌细胞凋亡 按“2.8.4”项下方法分组,取9×104个细胞,3 000 r/min离心10 min,弃去上层,加入250 μL Annexin V-FITC轻悬细胞,再加入10 μL Annexin V-FITC混匀,孵育15 min,3 000 r/min离心10 min,弃去上层,加入300 μL Annexin V-FITC重悬细胞,加入PI 15 μL,混匀,孵育10 min,筛网过滤,流式细胞仪检测[22]。
3 结果
3.1 准噶尔乌头炮制品毒性成分筛选经TCMSP数据库和TOXNET数据库筛选得到准噶尔乌头的心脏毒性成分18个,见表1、图1。

表1 准噶尔乌头炮制品心脏毒性成分
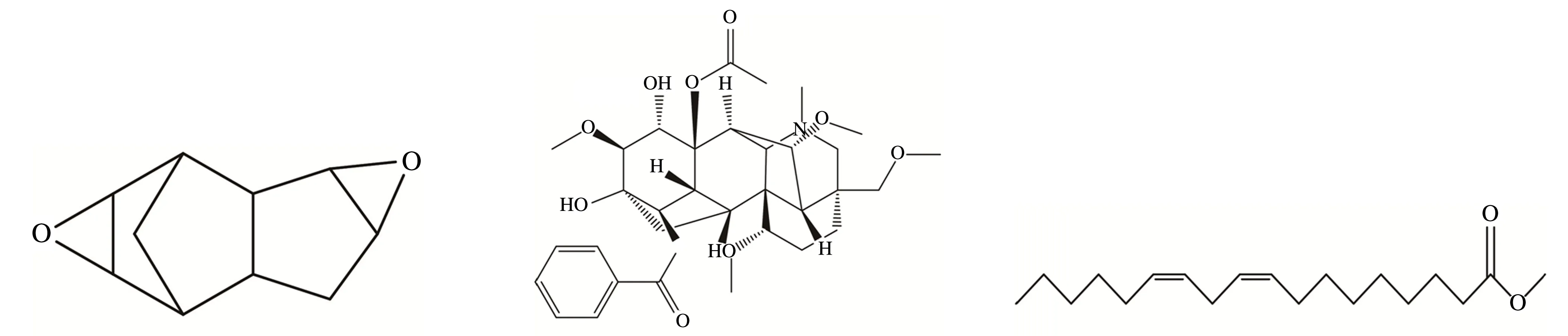
双环戊二醚次乌头碱亚油酸甲酯

3-脱氧乌头碱准噶尔乌头碱多根乌头碱

Izoteolin欧乌头碱

3-乙酰乌头碱、乌头碱、苯甲酰乌头原碱草乌甲素、滇乌头碱
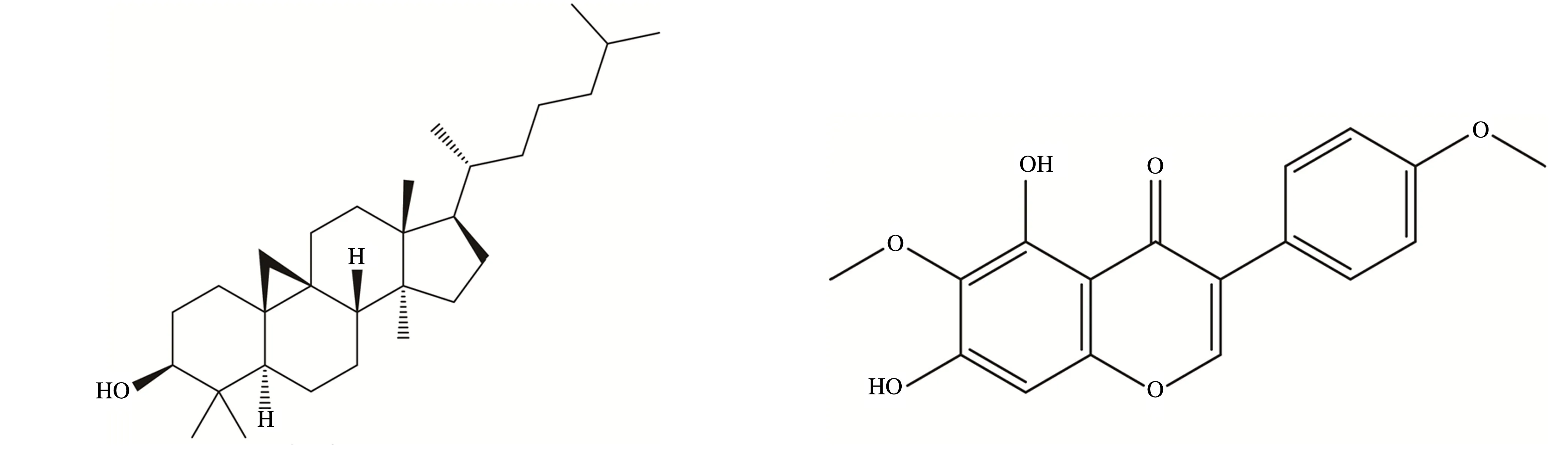
环阿尔廷醇尼泊尔鸢尾异黄酮
图1 准噶尔乌头炮制品18个毒性成分的化学结构式
高乌甲素、氢溴酸高乌甲素乌拉尔宁
3.2 准噶尔乌头炮制品毒性成分靶点筛选检索准噶尔乌头18个毒性成分相关靶点,去重后保留73个唯一靶点。“药物-毒性成分-靶点”网络图包含92个节点(1个药物、18个毒性成分及73个靶点),312条边,紧密度排名见表2,心脏毒性成分-靶点网络图。与靶点关联性较强的成分为草乌甲素、乌拉尔宁、氢溴酸高乌甲素、高乌甲素和亚油酸甲酯、苯甲酰乌头原碱等,见图2。
3.3 准噶尔乌头-心脏毒性靶点筛选通过心脏毒性的关键词共检索到1 436个靶点,去重后得到1 028个心脏毒性靶点。
3.4 准噶尔乌头潜在靶点与疾病靶点韦恩图的构建运用Venny 2.1.0在线工具,得到准噶尔乌头心脏毒性22个关键靶点,制作韦恩图,见图3。以靶点名称的缩写表示,即:Sex Hormone Binding Globulin(SHBG)、Butyrylcholinesterase(BCHE)、Thyroid Hormone Receptor Beta(THRB)、Peroxisome Proliferator Activated Receptor Gamma(PPARG)、Mitogen-Activated Protein Kinase 14(MAPK14)、Selectin P(SELP)、Coagulation Factor II,Thrombin(F2)、Transforming Growth Factor Beta Receptor 1(TGFBR1)、Bone Morphogenetic Protein 2(BMP2)、Estrogen Receptor 1(ESR1)、Glucosylceramidase Beta(GBA)、Caspase 7(CASP7)、Caspase 3(CASP3)、Matrix Metallopeptidase 3(MMP3)、Transthyretin(TTR)、Mitogen-Activated Protein Kinase 1(MAPK1)、Insulin Like Growth Factor 1 Receptor(IGF1R)、Plasminogen(PLG)、ADAM Metallopeptidase Domain 17(ADAM17)、Albumin(ALB)、Androgen receptor(AR)、Estrogen Receptor 2(ESR2)。

表2 心脏毒性成分与靶点的紧密度排名
3.5 PPI网络图构建及分析利用String数据库和Cytoscape 3.7.2软件构建准噶尔乌头心脏毒性关键靶点PPI网络图,见图4。网络图包含22个节点和81条边,其以度值(DC)为评判标准,DC越大,表明该靶点对心脏毒性越重要。计算靶点DC、中介中心性(BC)、紧密中心性(CC)、马修斯相关系数(MCC)的平均值,分别为7.36、14.09、14.11和528.90。DC、BC、CC、MCC都大于平均值的靶点有5个:ALB、CASP3、MAPK1、ESR1、MAPK14;大于2倍以上平均值的靶点有1个:ALB。17个成分(剔除1个未作用到靶点上的成分)和22核心靶点的对应关系,见表3。

图2 药物-心脏毒性成分-靶点网络图
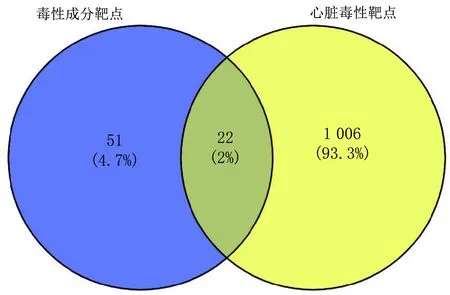
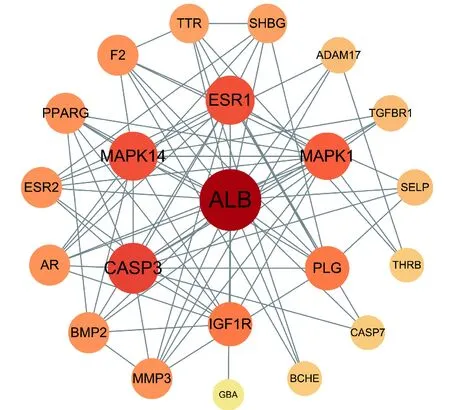
图3 准噶尔乌头潜在靶点与疾病靶点韦恩图图4 PPI蛋白相互作用图
3.6 GO和KEGG分析用R软件对22个核心靶点进行GO和KEGG分析,GO显示976条富集结果,其中生物过程条目847个,包括伤口愈合、生殖发育、细胞内受体信号通路、跨膜受体蛋白丝氨酸/苏氨酸激酶信号通路的正调控等。细胞组分条目23个,包括血液微粒、内质网腔、血小板α颗粒和血小板α颗粒内腔等。分子功能条目106个,包括核受体活性、MAP激酶活性、激素结合和类固醇结合等。对各功能的前10条目信息绘图,见图5。KEGG结果显示83条信号通路(P<0.05)主要涉及MAPK信号通路、IL-17信号通路、FoxO信号通路等。以P值为筛选条件,对前30信号通路绘图分析,见图6。气泡图的横坐标代表面积,面积越大说明通路中富集基因越多;纵坐标代表P值,数值越小,颜色越红,富集结果和信号通路越重要。
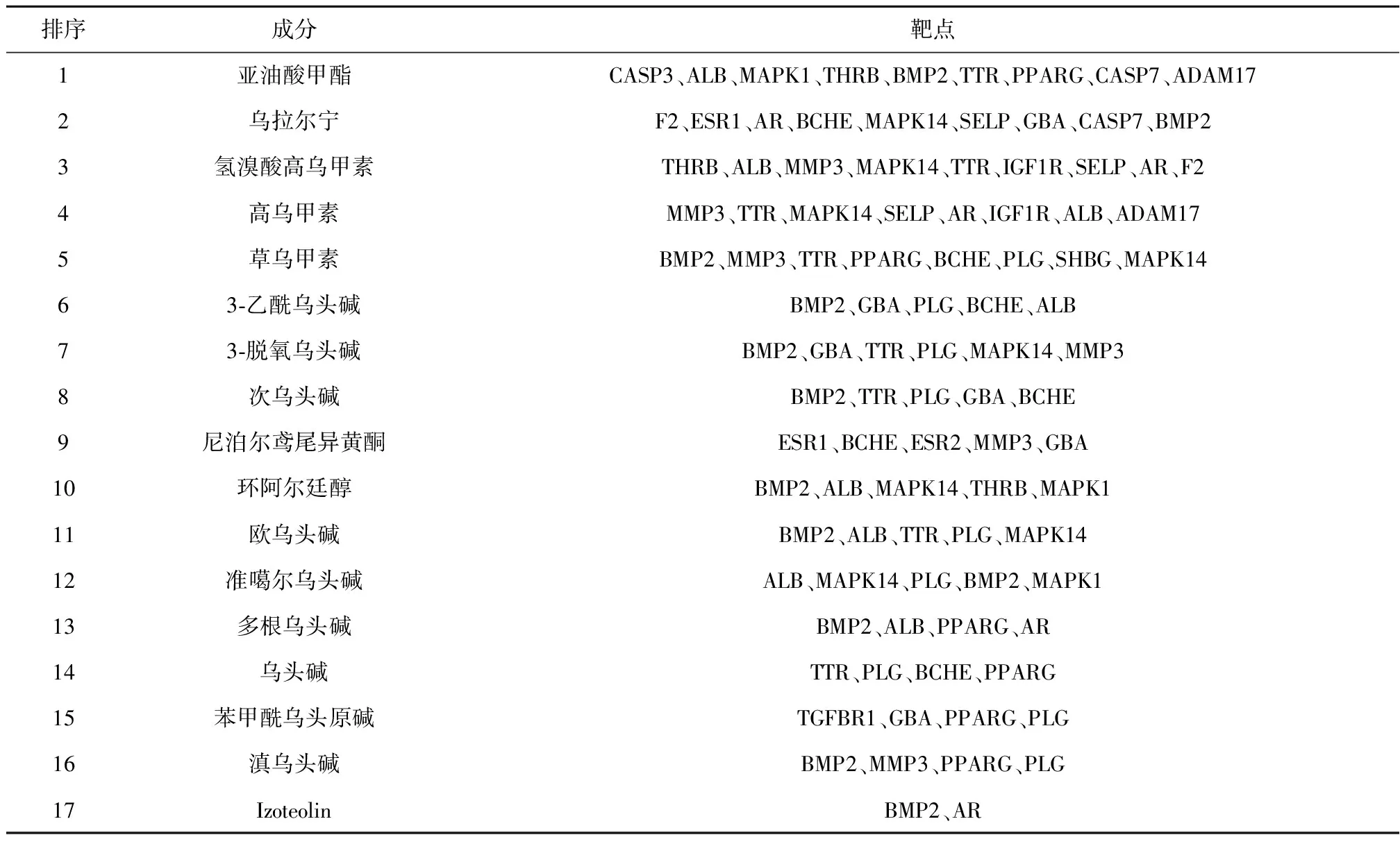
表3 准噶尔乌头心脏毒性成分-关键靶点的对应关系


图5 GO富集分析气泡图图6 KEGG富集分析气泡图
3.7 分子对接验证
3.7.1 准噶尔乌头心脏毒性-分子对接 以“3.6”项中的KEGG结果为依据,因MAPK14在Uniprot及PDB数据库中没有蛋白结构,选择MAPK1、CASP3、TGFBR1、MMP3、BMP2、IGF1R、PPARG、TTR、ALB为受体;草乌甲素、亚油酸甲酯、乌拉尔宁、氢溴酸高乌甲素、高乌甲素、3-脱氧乌头碱、乌头碱、苯甲酰乌头原碱、准噶尔乌头碱为配体进行对接验证。配体与受体的结合能,见表4,热图见图7,图中颜色由红变蓝,结合活性逐渐减弱。结果显示配体与受体间有强烈的结合活性,配体与受体之间主要通过范德华力、H-键、Pi-Pi和Pi-Cation等作用力维持稳定构象。草乌甲素、乌拉尔宁、准噶尔乌头碱、乌头碱、苯甲酰乌头原碱与ALB(6qio)的结合能分别为-14.2、-10.2、-10.0、-8.0、-8.6 kcal/moL。对形成氢键的复合物[乌拉尔宁、氢溴酸高乌甲素、高乌甲素与ALB(6qio)]进行可视化分析,见图8。
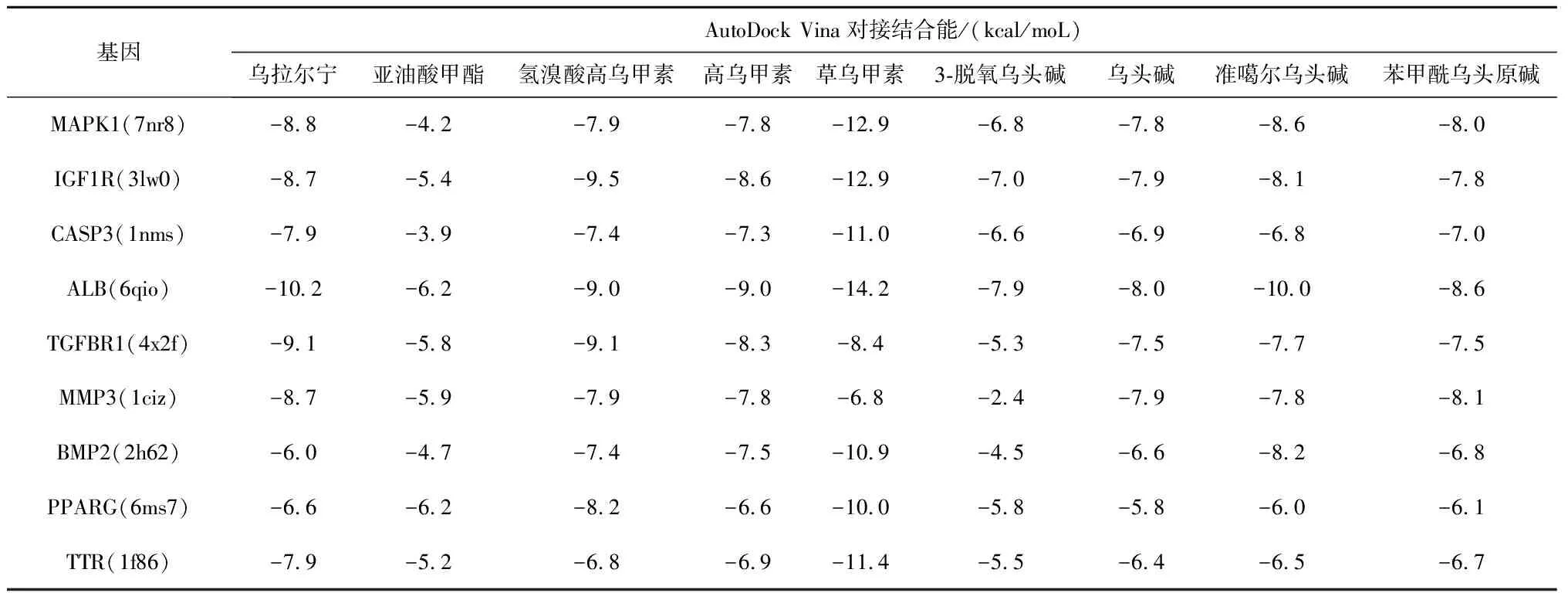
表4 核心心脏毒性化合物与核心心脏毒性靶点基因分子对接的结合能

图7 9个关键靶点与9个毒性成分的结合能热图
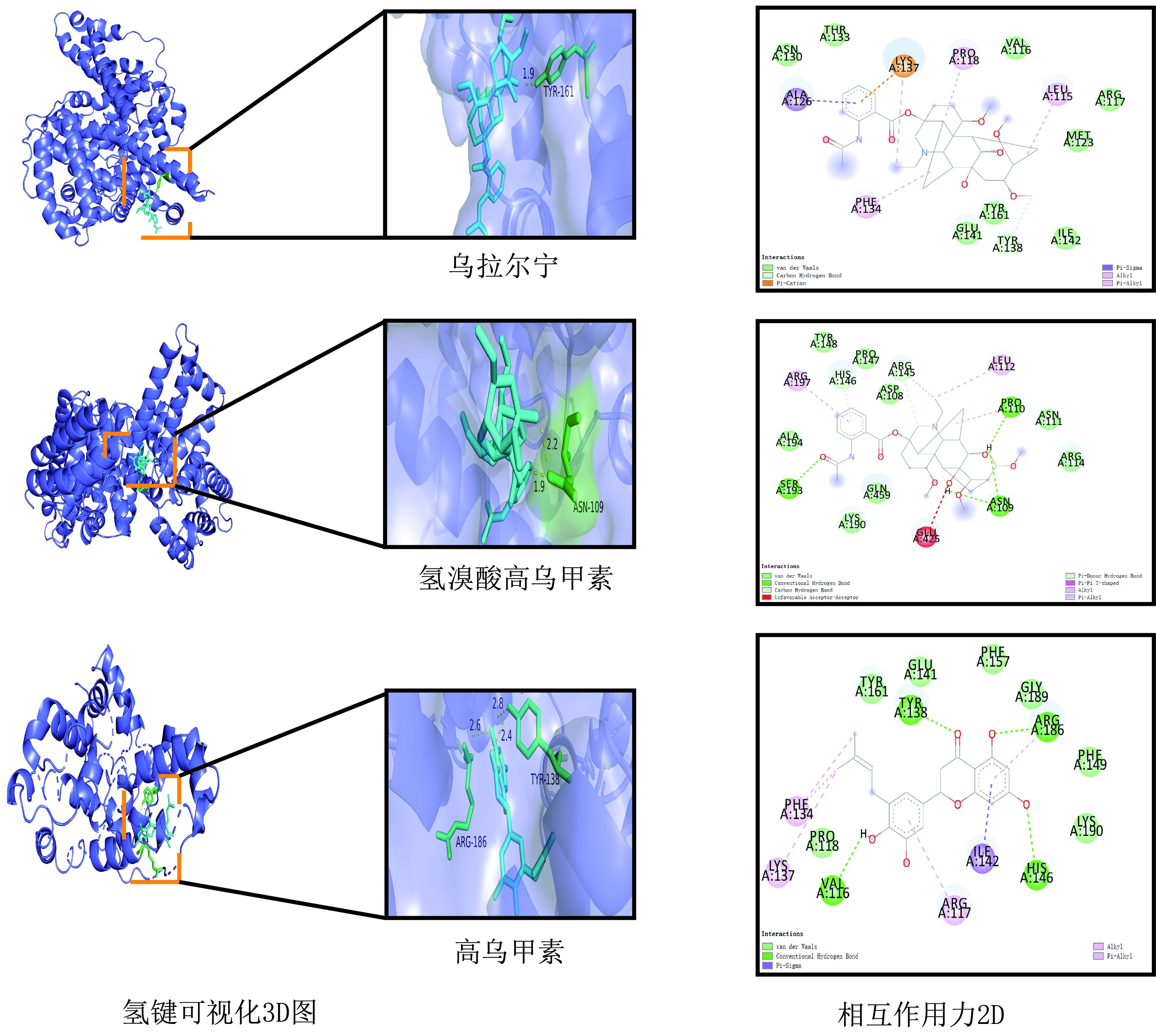
图8 乌拉尔宁、氢溴酸高乌甲素、高乌甲素与6qio相互作用图
3.7.2 准噶尔乌头炮制减毒的分子对接 课题组前期从准噶尔乌头中提取分离鉴定得到主要生物碱类成分为乌头碱、脱氧乌头碱、准噶尔乌头碱、12-表-欧乌碱和16,17-二氢-12β,16β-环氧欧乌头碱。其中乌头碱为C19双酯型生物碱,毒性较大,含量高,是准噶尔乌头中的主要毒性成分。而乌头碱经“加热水煮”法炮制后主要水解为单酯型的苯甲酰乌头原碱,毒性仅为乌头碱的1%~2%,大大降低了急性毒性,心脏毒性也随之降低。而C20型生物碱准噶尔乌头碱在炮制过程中结构较稳定未发生水解,心肌细胞毒性亦小于乌头碱,但其炮制减毒的分子机制尚不清晰。本研究采用分子对接技术对准噶尔乌头炮制前后主要特征成分乌头碱、准噶尔乌头碱、苯甲酰乌头原碱,进行炮制减毒的分子机制研究。比对表3中3个特征成分所对应的靶点。取交集靶点PLG(5ugg)进行分子对接验证。并对氢键复合物可视化分析,见图9。5ugg与乌头碱、准噶尔乌头碱、苯甲酰乌头原碱的对接结合能分别为-7.3、-6.1、-6.0 kcal/moL,故推测心脏毒性大小关系为:乌头碱>准噶尔乌头碱>苯甲酰乌头原碱。
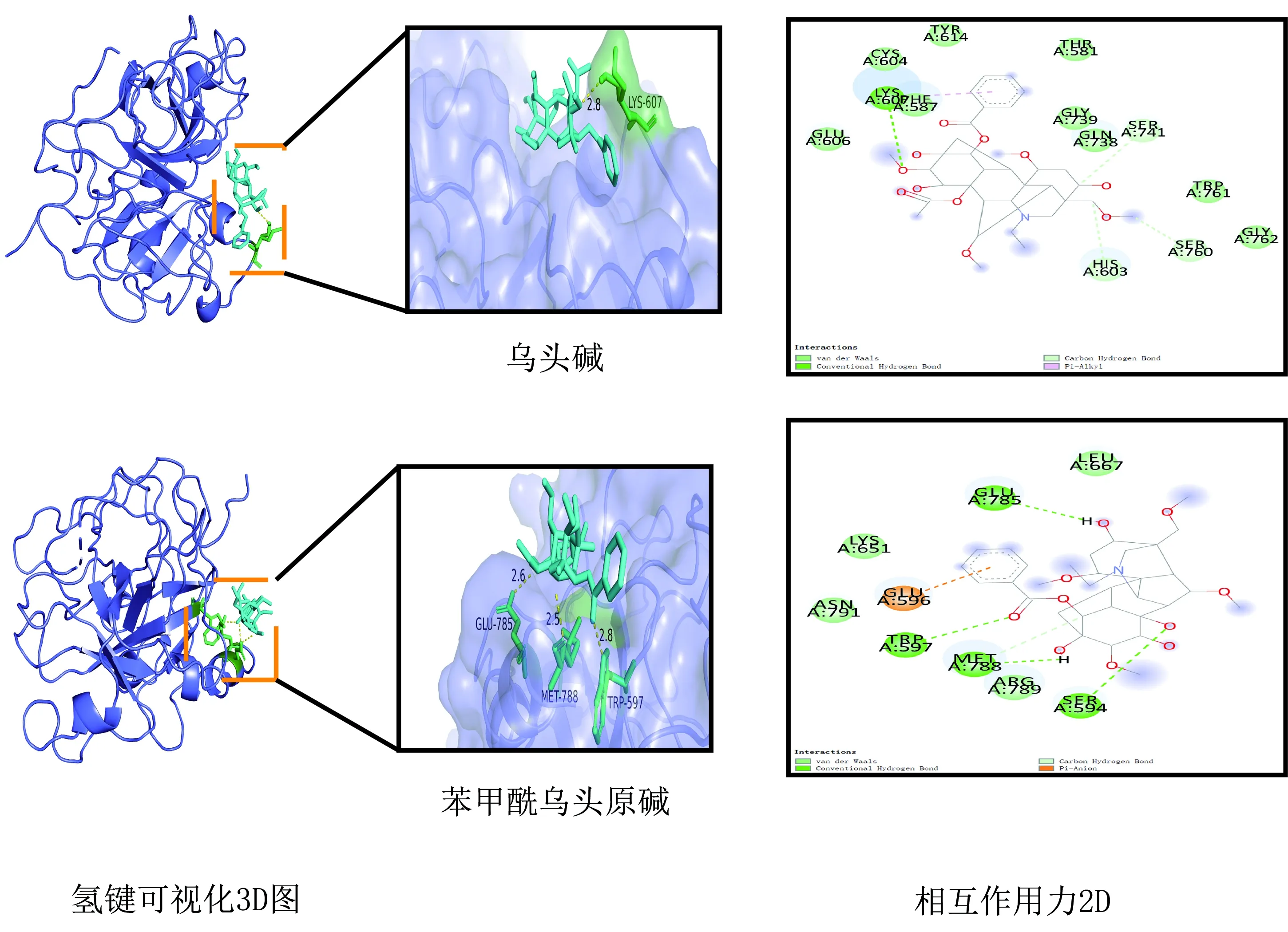
图9 乌头碱、苯甲酰乌头原碱与5ugg相互作用图
3.8 乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的心肌细胞毒性结果
3.8.1 心肌细胞抑制率 乌头碱、准噶尔乌头碱和苯甲酰乌头原碱的IC50分别为0.357、0.617、1.070 mg/mL,心肌细胞毒性:乌头碱>准噶尔乌头碱>苯甲酰乌头原碱,各剂量组间比较,差异有统计学意义(P<0.05),见表5。
3.8.2 细胞形态结果 空白组心肌细胞形态呈长梭形,处理组随着干预浓度升高细胞体积变小,皱缩成椭圆形或成不规则形状,胞体越亮,胞浆内黑褐色斑点也增多。其中乌头碱组的心肌细胞形态变化最明显,毒性较大,苯甲酰乌头原碱组的心肌细胞形态变化较小,毒性相对较低,见图10-12。

表5 不同浓度药物对心肌细胞抑制作用



图10 乌头碱空白(A)、低(B)、中(C)、高(D)浓度组心肌细胞形态图

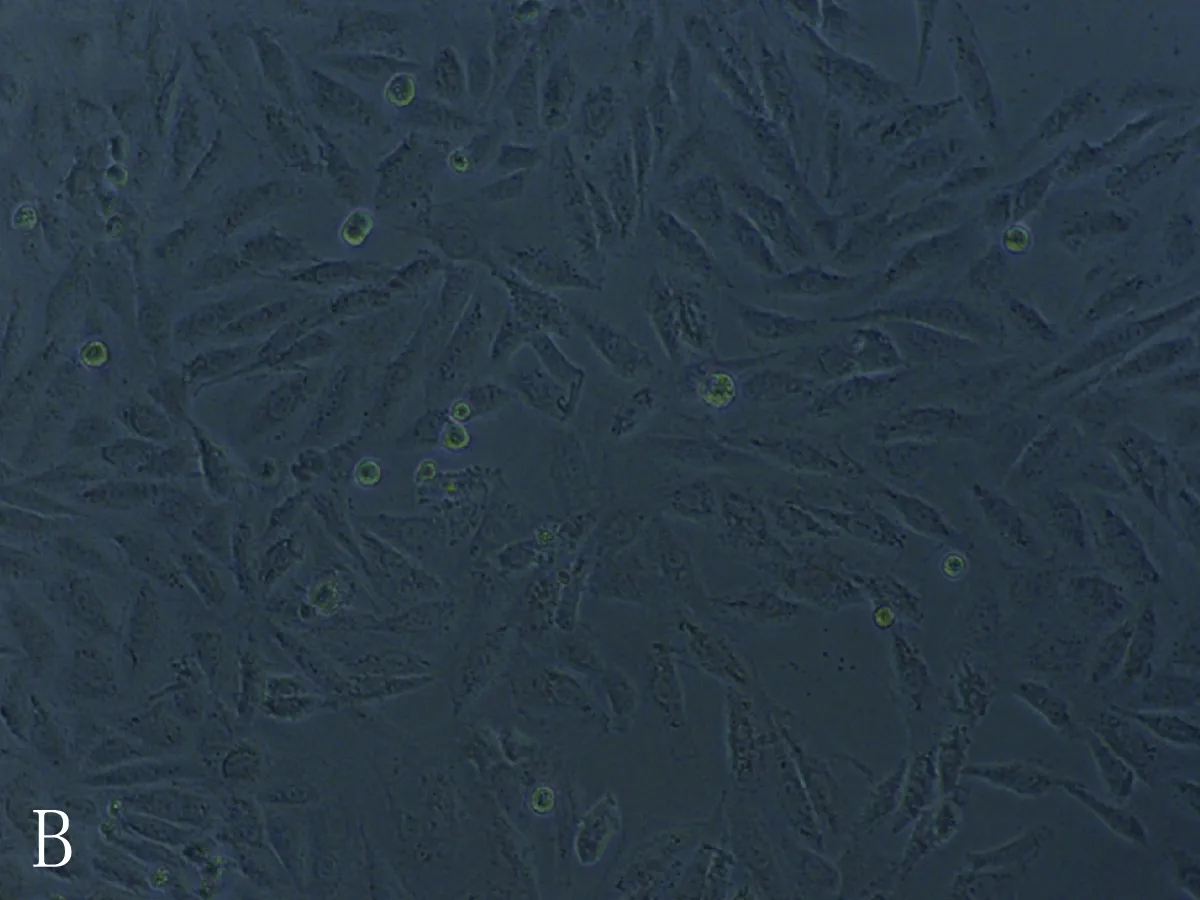
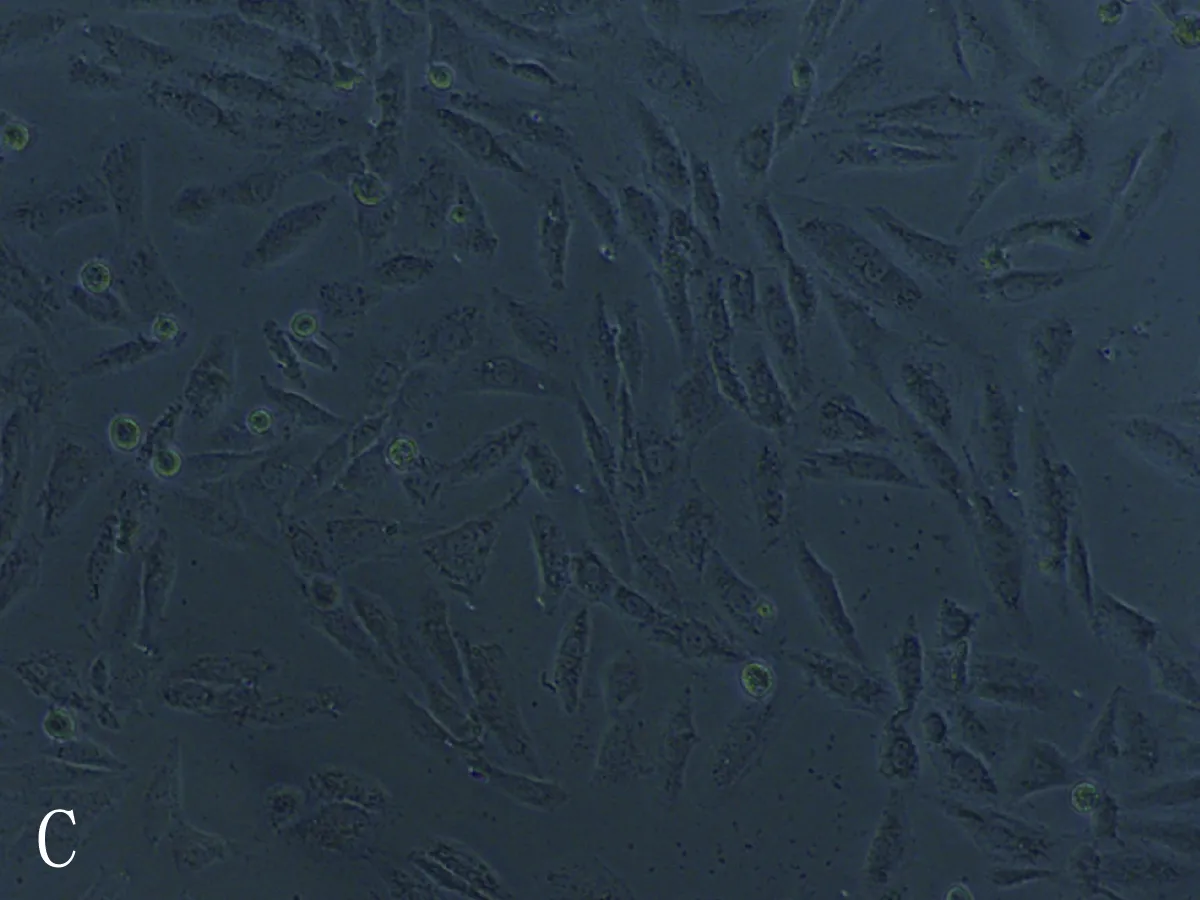

图11 准噶尔乌头碱空白(A)、低(B)、中(C)、高(D)浓度组心肌细胞形态图

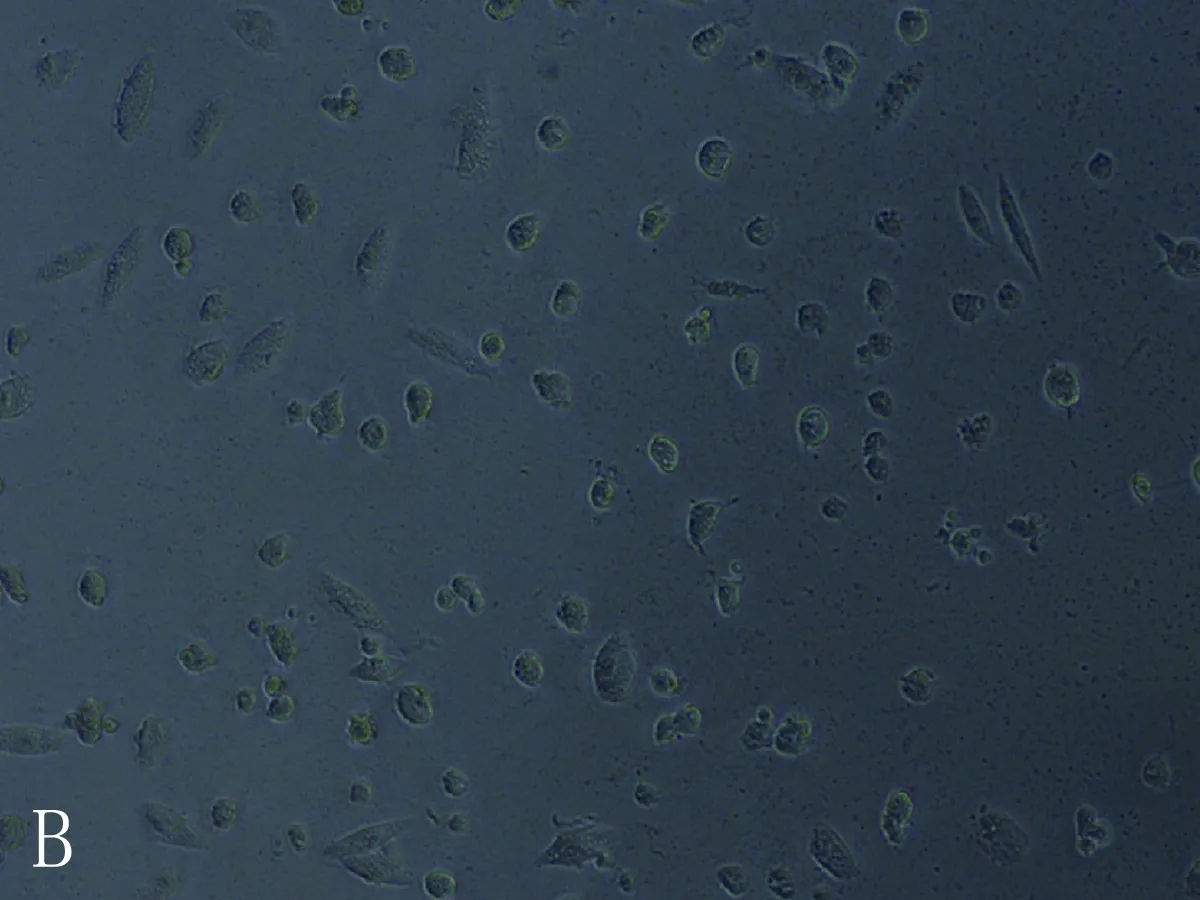


图12 苯甲酰乌头原碱空白(A)、低(B)、中(C)、高(D)浓度组心肌细胞形态图
3.8.3 LDH漏出率和凋亡率的测定结果 乌头碱组、准噶尔乌头碱组和苯甲酰乌头原碱组的LDH漏出率和凋亡率随着浓度的升高而增加,呈剂量依赖性。各剂量组间比较,差异有统计学意义(P<0.05),见表6。LDH漏出率实验结果发现当低浓度时准噶尔乌头碱的心肌细胞毒性最大,而在中剂量和高剂量浓度时,乌头碱的心肌细胞毒性最大。乌头碱的心肌细胞毒性是准噶尔乌头碱心肌细胞毒性的1.73倍,是苯甲酰乌头原碱心肌细胞毒性的3倍。
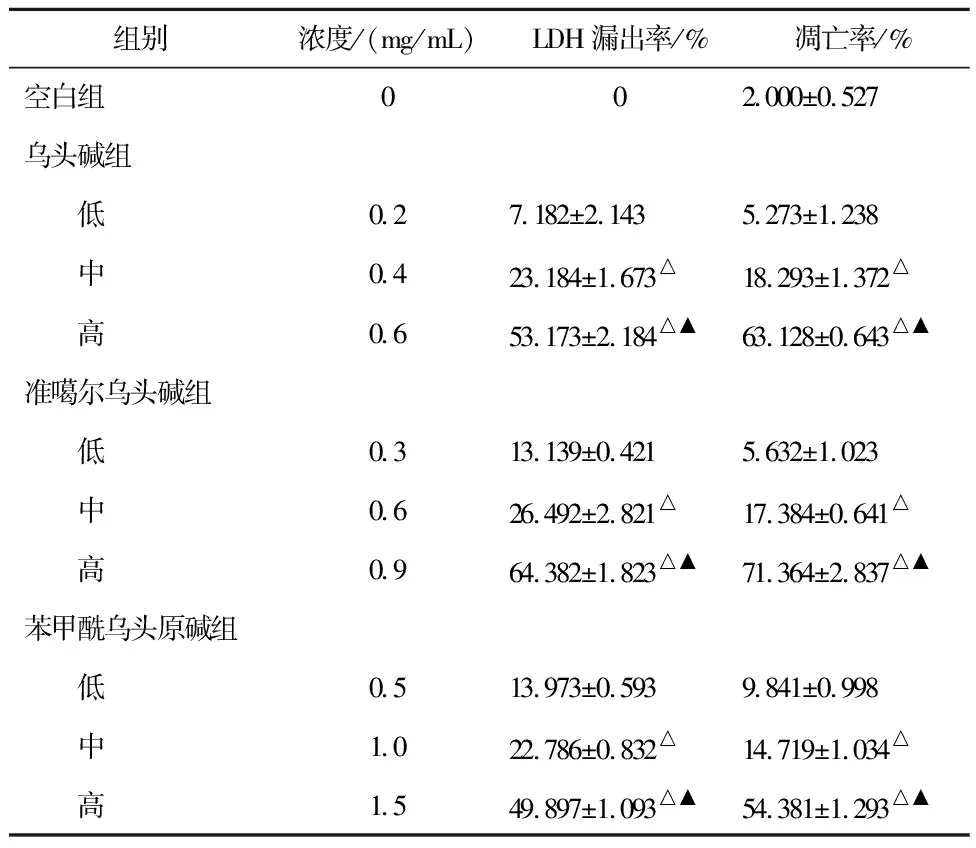
表6 心肌细胞活性LDH和凋亡率
3 讨论
本研究结果表明准噶尔乌头心脏毒性作用机制由准噶尔乌头碱、乌头碱、苯甲酰乌头原碱、3-脱氧乌头碱、草乌甲素等成分作用于MAPK、TNF、IL-17、FoxO等信号通路,通过调控MAPK14、MAPK1、ALB、CASP3等靶点导致生物分子网络紊乱,诱发心脏毒性。分子对接验证发现毒性成分与毒性靶点有强烈的结合活性,当乌头碱、准噶尔乌头碱和苯甲酰乌头原碱作用于PLG(5ugg)靶点时,结合能依次降低,表明准噶尔乌头炮制减毒的作用机制与PLG(5ugg)靶点有关。结合心肌细胞H9c2实验结果,进一步分析发现准噶尔乌头碱和主要炮制水解产物苯甲酰乌头原碱的心肌细胞毒性均小于乌头碱,其中乌头碱的心肌毒性是苯甲酰乌头原碱的3倍。证明准噶尔乌头炮制品的毒性大大降低,炮制达到了减毒的目的。准噶尔乌头与草乌、川乌在DNA分子、化学成分及药理方面有亲缘性关系,均含有C19乌头型生物碱[23-26]。由于准噶尔乌头基础研究较薄弱,故以乌头类药材亲缘性特点将草乌、川乌纳入检索范围,以期从乌头类复杂化学成分和毒性体系中挖掘准噶尔乌头潜在毒性成分和心脏毒性靶点,为后续生物学实验验证提供依据。
准噶尔乌头心脏毒性作用途径有MAPK信号通路、IL-17信号通路、FoxO信号通路等,其中MAPK信号转导途径为胞内调控炎症和氧化应激反应的主要通路,其家族中已被鉴定的基因包括胞外调节蛋白激酶1/2(Erk1/2)、p38丝裂原活化蛋白激酶(p38MAPK)和c-Jun氨基末端激酶(JNK)等[27]。在阿霉素诱导的心肌细胞凋亡实验证明激活p38MAPK活性会导致心脏重塑和心室扩张,进而导致严重的心肌疾病,抑制p38MAPK的激活对心肌损伤有保护作用[28]。Guo 等[29]研究发现生长/分化因子(Gdf15)可通过MAPK/ERK1/2途径促进心脏细胞纤维化,而诱发心脏病,因此抑制MAPK信号通路的激活可降低心脏疾病的发生。IL-17是由细胞亚群Th17产生的特异性促炎细胞因子,其能促使IL-1β、IL-6和TNF-α的释放,引起机体炎症反应[30]。研究证明[31]IL-17在室性心肌重塑中起关键作用,心室结构重塑主要表现为心室纤维化和心肌细胞凋亡,通过降低IL-17的表达水平,能抑制心室纤维化和心肌细胞凋亡从而对心室和心肌细胞起到保护作用[32]。FoxO因子是叉头转录调节因子大家族的一个亚类,具有特定的DNA结合基序,其亚组包括FoxO1、FoxO3、FoxO4和FoxO6,其中FoxO1在心血管形态改变和代谢应激诱导心脏重塑中具有关键作用,FoxO1从细胞核转移到细胞质,若磷酸化发生降解,则失去调节靶基因能力,加剧心肌的缺血性损伤。FoxO3缺乏会造成心脏肥大敏感,而FoxO4缺乏则会对心脏的缺血性损伤起保护作用,FoxO因子在心脏重塑有着不可或缺的作用[33-34]。
综上所述,网络毒理学以高效、合理的毒效评价方法预测药物的毒性成分和毒性靶点,提高了毒性目标成分和靶点识别的特异性和灵敏性。本研究通过网络毒理学和分子对接技术对准噶尔乌头心脏毒性的成分和作用靶点进行全面预测,与传统毒理学心肌细胞验证相比,有利于精准发现分子层面的毒性靶点。本研究挖掘出的毒性靶点有MAPK14、ALB、CASP3、TGFBR1、IGF1R、MMP3、BMP2、PPARG等,为后续准噶尔乌头心脏毒性作用机制的深入研究奠定了基础。

