STC2介导内质网应激在甲基苯丙胺致神经细胞凋亡中的作用研究
冯向阳, 闫 杰,, 张金龙, 王郁芳, 严 赫, 魏新荣, 牛淑亮
(1新疆医科大学基础医学院, 乌鲁木齐 830017; 2中南大学基础医学院法医系, 长沙 410000;3新疆医科大学基础医学院解剖学教研室, 乌鲁木齐 830017)
甲基苯丙胺(Methamphetamine,METH)是一种强效的精神兴奋剂,是全球滥用最广泛的非法药物之一[1]。除了成瘾性,METH对中枢神经系统,特别是对多巴胺能神经细胞具有很强的毒性作用[2]。METH可诱导细胞死亡,包括坏死、焦亡、凋亡等。内质网应激(Endoplasmic reticulum stress,ERS)通路是死亡受体信号通路和线粒体通路之外的经典凋亡通路,参与多种神经退行性疾病,包括帕金森和阿尔茨海默症[3]。ERS涉及的转录激活因子6(Activating transcription factor 6,ATF6)、肌醇需求酶1(Inositol-requiring enzyme 1,IRE1)和蛋白激酶 RNA 样内质网激酶(Protein kinase RNA-like endoplasmic reticulum kinase, PERK)等在ERS时与葡萄糖调节蛋白78(Glucose-regulated protein 78/binding immunoglobulin protein,GRP78)分离并激活[4],减轻细胞应激,使细胞存活,但强烈的应激会上调CCAT 增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)的表达,激活凋亡通路,诱导细胞发生凋亡[5]。METH可上调大鼠纹状体中GRP78、CHOP、剪切型半胱氨酸天冬氨酸蛋白激酶12(Cleaved caspase12)和剪切型半胱氨酸天冬氨酸蛋白激酶3(Cleaved caspase3)的表达[6],表明ERS凋亡通路在METH毒性机制中起重要作用,然而具体机制尚不清楚。斯钙素2(Stanniocalcin2, STC2)属于斯钙素家族基因,可调节钙和磷酸盐稳态,协调应对各种应激,包括辐射、缺氧和ERS[7],多表达于哺乳动物脑内[8],参与线粒体和内质网(Endoplasmic reticulum, ER)的亚细胞功能,在氧化应激和ERS时具有细胞保护特性[9]。在结直肠癌中促进肿瘤细胞增殖[10],而在乳腺癌中,却抑制癌细胞的增殖及细胞集落[11],同时STC2在缺血刺激时迅速上调以抵抗应激[12]。有研究表明,STC2可促进小鼠周围神经损伤后再生[13]。沉默STC2后,毒胡萝卜素诱导的小鼠脑神经瘤细胞(Mouse neuroblastoma neuro-2a cells, N2a)ERS和凋亡明显加强[14],说明STC2具有神经保护作用,但METH诱导ERS凋亡通路相关研究较少。本研究旨在通过在体内外沉默STC2表达,探讨STC2在METH诱导的神经元凋亡中的作用机制,为METH毒性机制相关靶点提供实验依据。
1 材料与方法
1.1 实验动物雄性SD大鼠,体重200~220 g,24只(湖南斯莱克公司),饲养在环境温度(23±2)℃,湿度(50±5)%,自由饮水取食,保持12 h/12 h的光照黑暗周期。所有实验程序均符合中南大学湘雅三医院医学伦理委员会伦理规范。
1.2 细胞培养与分组PC12细胞在10%胎牛血清(Fetal bovine serum, FBS)和1%双抗的高糖培养基(Dulbecco′s modified eagle medium, DMEM),37℃的条件下培养, 2~3 d传代一次。用0、1、1.5、2.0、2.5 mM METH处理24 h,收集细胞,并按剂量分为0 mM组、1 mM组、1.5 mM组、2 mM组和2.5 mM组。
1.3 试剂和仪器METH由长沙市公安局提供。PC12细胞(武汉普诺赛公司)。DMEM、磷酸盐缓冲溶液(Phosphate belanced solution, PBS)、胎牛血清、胰酶、青霉素链霉素溶液均购自美国Gibco公司。siRNA、GP-transfect-Mate转染试剂购自上海吉码公司。STC2抗体、GRP78抗体、caspase12抗体均购自英国Abcam公司。CHOP抗体、β-Tubulin抗体、Bcl-2抗体、Bax抗体、caspase3抗体均购自武汉三鹰公司。山羊抗小鼠、抗兔二抗购自武汉伊莱瑞特公司。Evo M-MLV反转录试剂盒、SYBR® Green Pro Taq HS qPCR试剂盒(湖南艾科瑞公司)。PCR引物(长沙擎科公司)。TUNEL试剂盒(上海碧云天公司)。Annexin V-FITC凋亡试剂盒(南京凯基公司)。PCR仪(美国ABI公司)。脑立体定位仪、小动物麻醉系统均购自深圳瑞沃德公司。
1.4 实验方法
1.4.1 qRT-PCR检测mRNA表达水平 使用Steady Pure Quick RNA Extraction Kit试剂盒提取总RNA。用Evo M-MLV反转录试剂盒进行逆转录。用SYBR® Green Pro Taq HS qPCR试剂盒进行qRT-PCR检测。反应体系:2X SYBR® Green Pro Taq HS Premix(ROX Plus)10 μL,上下游引物(0.01 mM)0.8 μL,cDNA 2 μL,无RNA酶水7.2 μL。内参为GAPDH,mRNA相对表达水平用(RQ)=2-△△Ct统计,引物序列见表1。

表1 引物序列
1.4.2 Western blot检测STC2及内质网应激凋亡相关蛋白表达水平 RIPA提取细胞和组织蛋白,二喹啉甲酸(Bicinchoninic acid, BCA)法检测蛋白浓度。凝胶电泳后转膜,37℃封闭1 h。加入STC2抗体(1∶1 000)、GRP78(1∶2 500)、CHOP抗体(1∶3 000)、Bcl-2(1∶500)、Bax(1∶1 000)、caspase12 (1∶1 000)、caspase3(1∶1 000)、β-Tubulin(1∶5 000),4℃孵育过夜。加入二抗(1∶5 000),37℃孵育1 h。增强型化学发光试剂(Enhanced chemiluminescence, ECL)显影,用Image J计算灰度值。
1.4.3 细胞转染 PC12细胞铺于6孔板内进行转染,并分为siRNA-NC组、siRNA-NC+METH组、siRNA-STC2组和siRNA-STC2+METH组,各6只。在离心管中加入200 μL DMEM、150 pmolsiRNA,混匀,静置5 min;另一离心管中加入200 μL DMEM、7.5 μL转染试剂,静置5 min;混匀2个离心管,静置15 min,转染,48 h后Western Blot检测沉默效率,筛选效率最高siRNA,进行后续转染实验,siRNA序列见表2。

表2 siRNA序列
1.4.4 TUNEL检测凋亡率 制作细胞涂片和石蜡切片。加入50 μLTUNEL检测液,37℃避光孵育60 min。滴加DAPI,避光孵育5 min。荧光显微镜下拍照,Image J计算TUNEL和DAPI双阳性细胞百分比。
1.4.5 流式细胞术检测细胞凋亡率 收集细胞,PBS洗涤1次,1 000 r/min离心5 min,200 μL Binding buffer重悬。滴加2 μL Annexin V-FITC、2 μL碘化丙啶混匀,避光孵育5 min,流式细胞仪检测细胞凋亡率。
1.4.6 体内基因沉默 大鼠固定于立体定位仪,10 μL注射器将siRNA-NC或siRNA-STC2(5 nmoL)以0.5 μL/min注入纹状体(前囟前1.0 mm,外侧3.0 mm,硬膜下4.5 mm), 停留5 min后拔出(1 mm/min)。48 h后, 腹腔注射生理盐水或METH(10 mg/kg, 4次,间隔2 h),最后一次注射24 h后进行灌注取材[15]。1%戊巴比妥麻醉大鼠,固定于鼠台上,剪开胸腹部皮肤后沿两侧肋骨剪开,暴露心脏。灌注针从左心室心尖部插入,落空感后用止血钳固定。在右心耳处剪一小口。生理盐水进行灌注,直至肝、肺等脏器颜色由鲜红色变为白色时,改用4%多聚甲醛继续灌注(Western blot检材无需此步骤),观察至大鼠四肢明显抽搐现象,身体及全部脏器僵直生硬。将大鼠断头取材,沿矢状缝剪开颅骨,暴露脑组织,取出全脑,浸泡于4%多聚甲醛,用于后续切片染色。Western blot检材在冰上操作,剥离纹状体脑区,切除小脑,沿矢状缝将左右半球切开,从内侧面慢慢剥离纹状体(分离干净白质),迅速转移至-80℃备用。
1.4.7 尼氏染色 切片常规脱蜡复水,尼氏染料染色0.5~1 min,超纯水漂洗,1%冰醋酸分化,镜下观察背景无色,尼氏小体染色明显后停止分化,中性树胶封片。
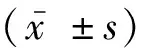
2 结果
2.1 METH对PC12细胞STC2,GRP78和CHOP mRNA和蛋白表达水平的影响qRT-PCR和Western blot结果显示,与0 mM组比较,1.5 mM组、2 mM组、2.5 mM组细胞STC2、GRP78和CHOP的mRNA和蛋白表达水平显著升高,且在2.5 mM组升高最显著(P<0.01)(图1)。
2.2 体外沉默STC2对METH诱导的PC12细胞ERS和凋亡相关蛋白表达水平的影响基于上述结果,选择2.5 mM进行后续实验。Western Blot结果显示,与siRNA-NC组比较,siRNA-NC+METH组STC2、GRP78、CHOP、Bax、cleaved caspase12、cleaved caspase3的表达水平升高,同时Bcl-2表达水平下降(P<0.01);在沉默STC2后,与siRNA-NC+METH组比较,siRNA-STC2+METH组ERS凋亡相关蛋白GRP78、CHOP、Bax、cleaved caspase12、cleaved caspase3的表达水平进一步升高,同时Bcl-2的表达水平进一步下降(P<0.05)(图2)。

注:A,各组STC2、GRP78、CHOP mRNA 相对表达水平;B,各组STC2、GRP78、CHOP 的Western blot图;C,各组STC2、GRP78、CHOP蛋白相对表达水平;与0 mM组比较,*P<0.05, **P<0.01。
>注:A,不同siRNA处理后各组STC2蛋白Western blot图;B,各组STC2蛋白相对表达水平;C,沉默STC2后各组STC2、GRP78、CHOP mRNA相对表达水平;D,沉默STC2后各组蛋白Western blot图;E-F,各组蛋白相对表达水平;与siRNA-NC组比较, *P<0.05, **P<0.01; 与siRNA-NC+METH组比较, #P<0.05, ##P<0.01。
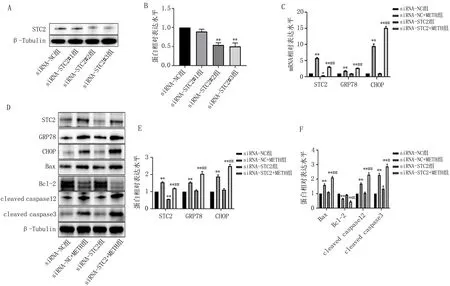
2.3 沉默STC2对METH诱导的PC12细胞凋亡的影响TUNEL实验结果显示,与siRNA-NC组比较,siRNA-NC+METH组TUNEL阳性细胞比例显著增加(P<0.01)。沉默STC2后,与siRNA-NC+METH组比较,siRNA-STC2+METH组TUNEL阳性细胞比例进一步升高(P<0.01),流式细胞术也呈现相同的趋势(图3)。
2.4 体内沉默STC2对METH诱导的大鼠纹状体神经元损伤的影响TUNEL实验结果显示,与siRNA-NC组比较,siRNA-NC+METH 组大鼠纹状体神经元出现显著凋亡(P<0.01);沉默STC2后,与siRNA-NC+METH组比较, siRNA-STC2+METH组TUNEL阳性细胞比例进一步上升(P<0.01)。尼氏染色结果显示,与siRNA-NC组比较,siRNA-NC+METH组纹状体内神经元排列不规则,胞内尼氏体减少,染色较浅;在沉默STC2后,METH对神经元的损伤进一步加重,尼氏体数量进一步降低,神经元排列更加紊乱(图4)。
>注:A,各组细胞TUNEL染色图(×200);B,TUNEL染色阳性细胞比例;C,各组细胞流式凋亡图;D,各组细胞凋亡率;与siRNA-NC组比较, **P<0.01; 与siRNA-NC+METH组比较, ##P<0.01。

>注:A,各组纹状体TUNEL染色图(×200);B,TUNEL染色阳性细胞比例;C,各组纹状体尼氏染色图;与siRNA-NC组比较, **P<0.01; 与siRNA-NC+METH组比较, ##P<0.01。
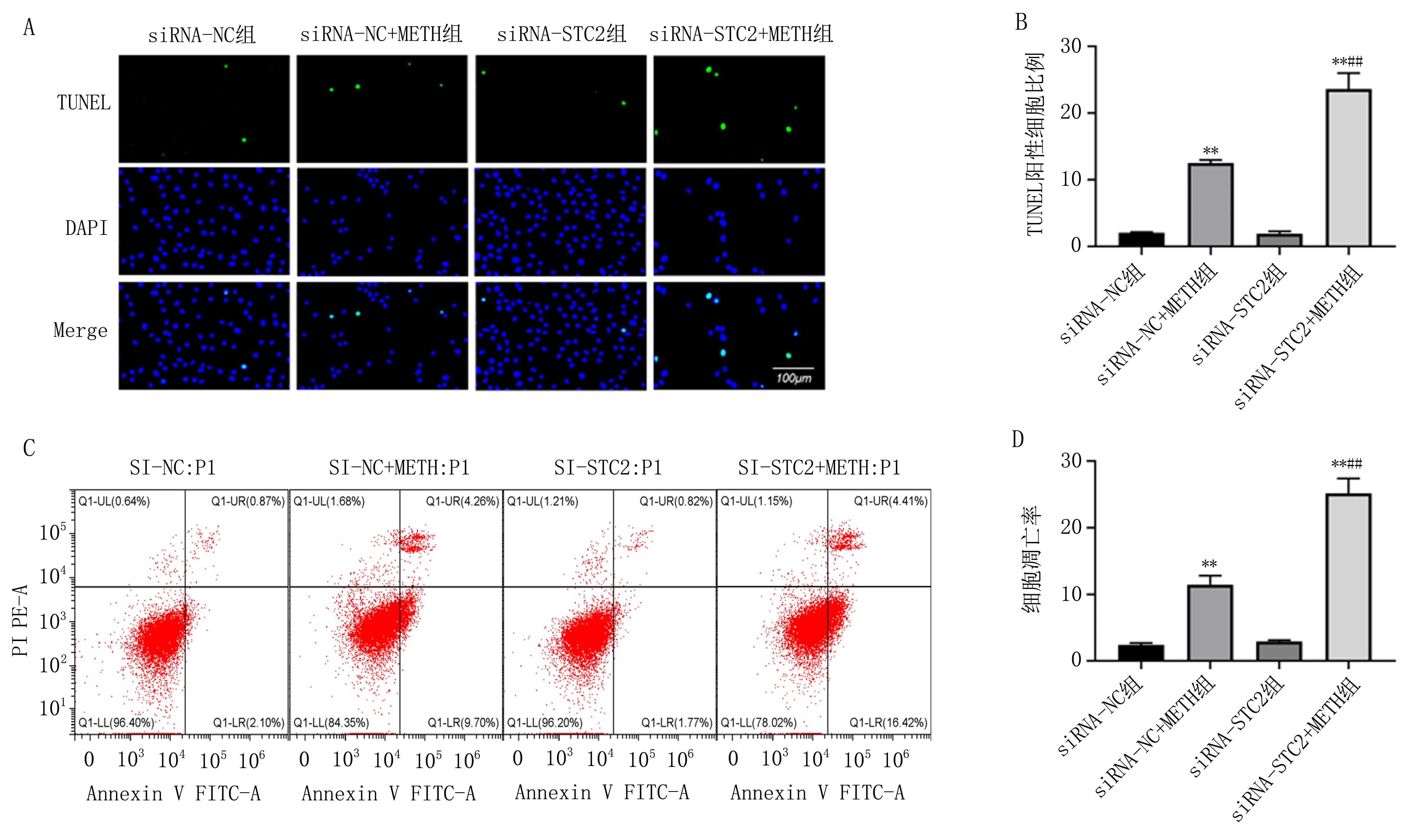
2.5 体内沉默STC2对METH诱导的大鼠纹状体ERS凋亡相关蛋白表达水平的影响Western blot结果显示,与siRNA-NC组比较,siRNA-NC+METH组大鼠纹状体内STC2、GRP78、CHOP、凋亡相关蛋白Bax、cleaved caspase12、cleaved caspase3表达水平显著增加,抗凋亡蛋白Bcl-2的表达水平下降(P<0.01);沉默纹状体内STC2表达后,ERS凋亡相关蛋白GRP78、CHOP、Bax、cleaved caspase12、cleaved caspase3的表达水平进一步升高,同时Bcl-2的表达水平进一步下降(P<0.05)(图5)。
>注:A,各组蛋白Western blot图; B-C,各组蛋白相对表达水平;与siRNA-NC组比较, **P<0.01; 与siRNA-NC+METH组比较, #P<0.05, ##P<0.01。
3 讨论
METH诱导的神经毒性机制主要有氧化应激、兴奋性毒性、神经炎症等。作为一种分泌蛋白,STC2以自分泌或旁分泌的形式发挥作用[16]。有研究表明,METH会导致谷氨酸(Glutamic,Glu)积累,过量的Glu激活N-甲基-D-天冬氨酸受体和代谢性谷氨酸受体,引起Ca2+内流,使细胞内Ca2+浓度增加,过量的Ca2+激活一氧化氮合酶,促进一氧化氮的产生,导致 ERS和凋亡通路的激活[17]。基质相互作用分子1(Stromal interaction molecule 1, STIM1)表达于ER中,参与调节细胞内的Ca2+浓度。有研究表明,STC2与STIM1结合,限制STIM1介导的Ca2+内流,降低胞内Ca2+浓度[18],避免ERS的发生,保护细胞在应激下存活。METH可激活ERS,通过PERK-真核翻译启动因子2α(Eukaryotic translation initiation factor 2-alpha, eIF2α)-转录激活因子4(Activating transcription factor 4, ATF4)-CHOP途径导致细胞凋亡[19],STC2可降低PERK的磷酸化,使eIF2α磷酸化降低,减少ATF4的表达,切断该通路,减少ERS通路的凋亡[20]。STC2在缺氧[21]和葡萄糖缺乏[22]时均可保护细胞应对刺激,减轻ERS。作为缺氧诱导因子1(Hypoxia inducible factor-1, HIF-1)的靶点,STC2在缺氧时被上调,通过抑制Kelch 样环氧氯丙烷相关蛋白 1(Kelch-1ike ECH- associated protein l, Keap1)的表达,保护细胞在缺氧时免受损伤[21]。此外STC2在葡萄糖缺乏时,可促进糖酵解,补充能量原料[22]。METH引起的细胞凋亡十分复杂,涉及多种机制,可致细胞内产生大量的活性氧(Reactive oxygen species, ROS),引起氧化应激和线粒体功能障碍,导致胞内能量代谢异常,引发ERS。有研究显示,STC2可直接作用于核因子红细胞系2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2),上调Nrf2的表达水平,激活下游信号通路,抑制ROS的产生,起到抗氧化的作用[23]。Wu等[24]的研究中,过表达STC2 激活磷酸化丝氨酸苏氨酸蛋白激酶(Phosphorylated protein kinase, strain AK, Thymoma, pAKT)信号通路,促进细胞增殖,使细胞免受氧化应激引起的凋亡,进而缓解细胞功能紊乱,避免ERS的发生。
本研究发现METH诱导的神经细胞凋亡可由STC2调节,沉默STC2会促进METH诱导的神经细胞凋亡,提示STC2在METH诱导的神经细胞凋亡中起保护作用,且该保护作用是由ERS通路介导的。 CHOP作为一种转录因子,被多种应激条件所诱导,且在ERS凋亡通路中发挥重要作用[25]。CHOP可调控多种凋亡基因的表达,下调B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)和上调Bcl-2相关X蛋白(Bcl2-associated X, Bax)的表达水平,介导细胞凋亡[26]。本实验结果显示,METH的干预可上调PC12细胞和大鼠纹状体中CHOP表达水平,增加Bax/Bcl-2的比率,启动半胱氨酸天冬氨酸蛋白激酶(Caspase)级联反应。在沉默STC2后,CHOP的表达水平进一步上调,同时细胞凋亡水平进一步加重,提示CHOP在METH诱导的凋亡中至关重要,但本实验缺少通过沉默CHOP验证其是否为STC2的下游靶分子。Caspase12是caspase蛋白家族中唯一参与ERS凋亡途径的成员,活化的caspase12贯序激活caspase9、caspase3,启动caspase家族经典凋亡途径导致细胞凋亡的发生[27]。本实验结果同样显示,沉默STC2后,METH引起的caspase12表达水平进一步上调,caspase3也进一步活化。值得注意的是,吸食者大脑中的METH峰值浓度可达0.1 mM,除ERS损伤机制外,METH还会引发免疫反应和高热作用,进一步加剧其神经毒性作用[28]。因此,在体外模型中需给予较高剂量的浓度才能模拟体内的毒性效果,这也是本研究中采用1 mM-2.5 mM METH进行探究的原因。
综上所述,本研究显示沉默STC2的表达可促进METH引起ERS,加剧神经细胞凋亡,表明STC2在METH引起的神经细胞凋亡中发挥保护作用,有望为METH诱导的神经损伤提供新的治疗策略和靶点。

