过滤速率对阿奇霉素干混悬剂微生物限度检查方法的影响
姬 俊,牛萌萌,朱世真,刘婷婷,王立云,陈 静
(1. 山东省青岛市食品药品检验研究院·国家药品监督管理局海洋中药质量研究与评价重点实验室,山东 青岛 266073; 2. 山东省青岛市中医医院·青岛市海慈医院,山东 青岛 266000)
阿奇霉素是氮杂类化合物,属大环内酯类抗生素,2020 年版《中国药典(二部)》收载的剂型有干混悬剂、片剂、胶囊剂、颗粒剂及注射剂[1],其中干混悬剂始载于2000 年版《中国药典》。不同剂型阿奇霉素的微生物限度检查方法多以离心后的上清液作为供试液[2-5],或用含中和剂的稀释液制备供试液[6],再通过薄膜过滤法消除其强抑菌性。在采用薄膜过滤法探索阿奇霉素干混悬剂的需氧菌和控制菌限度检查方法时,发现过滤速率影响微生物限度检查方法适用性试验结果,但《中国药典》对其并无明确规定。因此本研究中根据2020年版《中国药典(四部)》通则1105,1106[7]规定,对阿奇霉素干混悬剂进行方法适用性研究,建立了无离心、无中和剂的微生物限度检查方法;同时也对薄膜过滤法中的冲洗液过滤速率与去除该药抗菌性的关系进行初步探索,为薄膜过滤法试验条件的改进提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与菌株
仪器:SHP-160 型生化培养箱、GNP-9160E 型隔水式培养箱(上海三发科学仪器有限公司);INE500 型电热恒温培养箱(德国Memmert 公司);HTY - 302G 型微生物限度检验仪(杭州泰林生物技术设备有限公司);TD型电子天平(余姚金诺天平仪器有限公司);RH basic 2型磁力搅拌器(德国IKA公司)。
试药:阿奇霉素干混悬剂[辉瑞制药有限公司(HR),批号分别为DJ4557,DE7924,DK1763;黑龙江诺捷制药有限责任公司(NJ),批号为1902334;石药集团欧意药业有限公司(SY),批号为063191021;山东绿因药业有限公司(LY),批号为207220416;规格均为0.1 g];胰酪大豆胨琼脂培养基(TSA,批号为20201124),胰酪大豆胨液体培养基(TSB,批号为20201123),沙氏葡萄糖琼脂培养基(SDA,批号为20200628),麦康凯液体培养基(批号为20190211),pH 7.0 氯化钠- 蛋白胨缓冲液(批号为20210112),大豆卵磷脂(批号为20200901),均购自青岛海博生物科技有限公司;沙氏葡萄糖液体培养基(SDB,批号为20190630),麦康凯琼脂培养基(批号为20190723),均购自青岛日水生物技术有限公司;聚山梨酯80(国药集团化学试剂有限公司,批号为20201027)。
菌株:金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、铜绿假单胞菌[CMCC(B)10104]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、大肠埃希菌[CMCC(B)44102],均购自中国食品药品检定研究院。
1.2 方法
1.2.1 溶液制备
取各菌株适量,依法制备浓度为≤104cfu / mL和≤102cfu/mL 的各试验菌菌悬液[2]。取样品10 g,用缓冲液(pH 7.0 无菌氯化钠- 蛋白胨缓冲液,下同)定容至100 mL,混匀,作为不含中和剂的1∶10(m∶V)供试液(供试液Ⅰ);取适量,用缓冲液分别依次稀释成1∶50(V∶V)、1∶100(V∶V)、1∶500(V∶V)不含中和剂的供试液(供试液Ⅱ,Ⅲ,Ⅳ)。取样品10 g,用含3%聚山梨酯80及0.3%大豆卵磷脂的缓冲液定容至100 mL,混匀,作为含中和剂的1∶10(V/V)供试液(供试液Ⅴ)。
1.2.2 微生物计数方法适用性试验
1)需氧菌计数方法适用性试验
试验组1(前加菌):在滤杯中加入缓冲液100 mL,加入1.2.1 项下供试液Ⅱ,Ⅲ,Ⅳ各1 mL,以及菌浓度≤102cfu/mL 的各需氧菌(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、黑曲霉、白色念珠菌)菌液1 mL,滤过,并用缓冲液冲洗滤膜,每次100 mL,共冲洗4次。
试验组2(后加菌):在滤杯中加入缓冲液100 mL,取1.2.1 项下供试液Ⅱ,Ⅲ,Ⅳ各1 mL,滤过,并用缓冲液冲洗滤膜,每次100 mL,共冲洗4次,末次冲洗时加入菌浓度≤102cfu/mL的各需氧菌菌液1 mL。
菌液对照组:以缓冲液代替供试液,以200 mL/min的过滤速率进行过滤。同相应试验组操作。
供试液对照组:以0.9%无菌氯化钠溶液代替菌液。同相应试验组操作。
低速对照组:以缓冲液代替供试液,分别以100 mL/min或50 mL/min 的过滤速率进行过滤。同试验组1 操作。用于需氧菌计数的滤膜置TSA 平皿上。将TSA 平皿置30~35 ℃培养箱,并每日计数。试验组回收比=(试验组平均菌落数-供试液对照组平均菌落数)/菌液对照组平均菌落数;低速对照组回收比= 低速对照组平均菌落数/菌液对照组平均菌落数。
方法:分别以不同过滤速率冲洗试验组1 及试验组2的滤膜,过滤速率分别约为200,100,50 mL/min。
2)霉菌和酵母菌计数方法适用性试验
试验组3:取1.2.1 项下供试液Ⅰ10 mL,置无菌试管中,并分别加入菌浓度≤104cfu/ mL 的白色念珠菌菌液或黑曲霉孢子悬液0.1 mL,混匀。
菌液对照组:以缓冲液代替供试液。同试验组3操作。
供试液对照组:以0.9%无菌氯化钠溶液代替菌液。同试验组3操作。
方法:取含菌供试液各2 mL,置平皿中,每日1 mL,倒入温度≤45 ℃的SDA。将用于霉菌和酵母菌计数的平皿置20~25 ℃培养箱中,并每日计数。
1.2.3 控制菌(大肠埃希菌)检查方法适用性试验
试验组1(直接接种法):取1.2.1项下供试液Ⅰ10 mL,加入TSB中,混匀。
试验组2(直接接种法):取1.2.1项下供试液Ⅴ10 mL,加入含3%聚山梨酯80及0.3%大豆卵磷脂的TSB中。
试验组3(薄膜过滤法):取缓冲液100 mL,共5 份,分别加入1.2.1 项下供试液Ⅴ2 mL,摇匀,将含药缓冲液全部加至滤杯中,过滤,用缓冲液冲洗滤膜,每次100 mL,每张滤膜冲洗5次。5张滤膜置同一TSB中。
菌液对照组:以缓冲液代替供试液,同相应试验组操作。试验组3 的菌液对照组以150 mL/min 的过滤速率进行过滤。
供试液对照组:以0.9%无菌氯化钠溶液代替菌液。同相应试验组操作。
低速对照组:以缓冲液代替供试液,分别以100 mL/min或50 mL/min的过滤速率进行过滤。同试验组3操作。
阴性对照组:以缓冲液代替供试液,以0.9%无菌氯化钠溶液代替菌液。同相应试验组操作。
方法:设增菌培养基体积分别为200,500,700,1 000 mL,并在加入供试液或滤膜后向培养基中分别加入菌浓度≤102cfu/ mL 的大肠埃希菌,考察不同体积增菌培养基对大肠埃希菌检查方法适用性试验的影响。过滤速率分别设为150,100,50 mL/min,试验组3考察冲洗液的不同过滤速率对大肠埃希菌检出的影响。将以上含菌培养基置30~35 ℃培养箱中培养24 h。取培养物各1 mL,加入100 mL麦康凯液体培养基中,置42~44 ℃培养箱中培养24 h。用无菌接种环将麦康凯液体培养基培养物划线接种至麦康凯琼脂培养基平皿上,置30~35 ℃培养箱中培养24 h。
2 结果
2.1 金黄色葡萄球菌计数方法适用性试验
用受抑制最大的金黄色葡萄球菌进行试验,确定需氧菌计数方法。当冲洗液过滤速率为50 mL/min 时,试验组1 的3 批供试液Ⅳ(HR)的金黄色葡萄球菌回收比均为0.5~2.0,试验组2 仅1 批供试液Ⅲ(HR)的回收比为0.5~2.0。详见表1、表2。
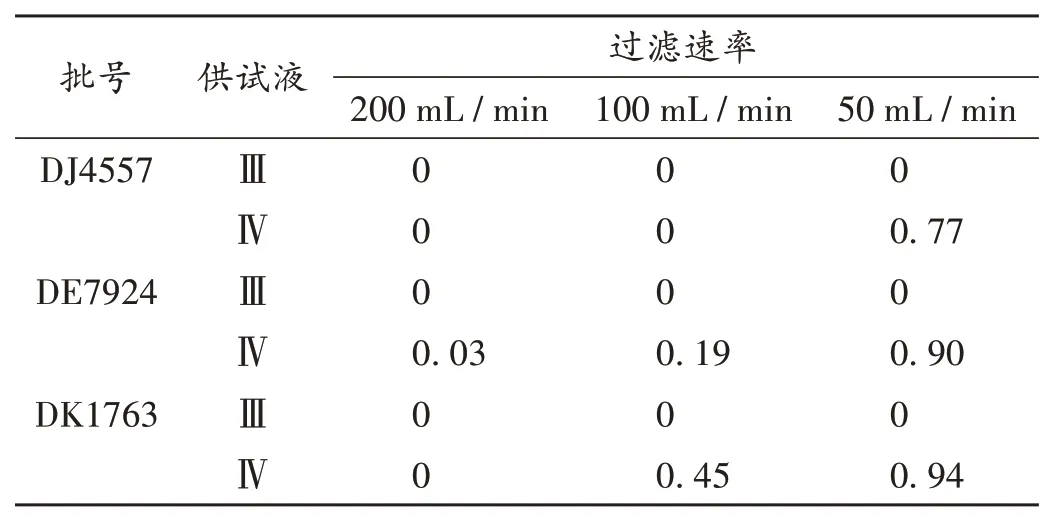
表1 前加菌薄膜过滤法金黄色葡萄球菌的回收试验结果(n=3)Tab.1 Results of the recovery test of Staphylococcus aureus by the membrane filtration method with bacteria-addition before filtration(n=3)

表2 后加菌薄膜过滤法金黄色葡萄球菌的回收试验结果(n=3)Tab.2 Results of the recovery test of Staphylococcus aureus by the membrane filtration method with bacteria-addition after filtration(n=3)
2.2 需氧菌低速对照组各试验菌的回收结果
按试验组1(前加菌)方法,当冲洗液过滤速率为50 mL/min 或100 mL/min 时,低速对照组各试验菌的回收比均为0.5~2.0。详见表3。
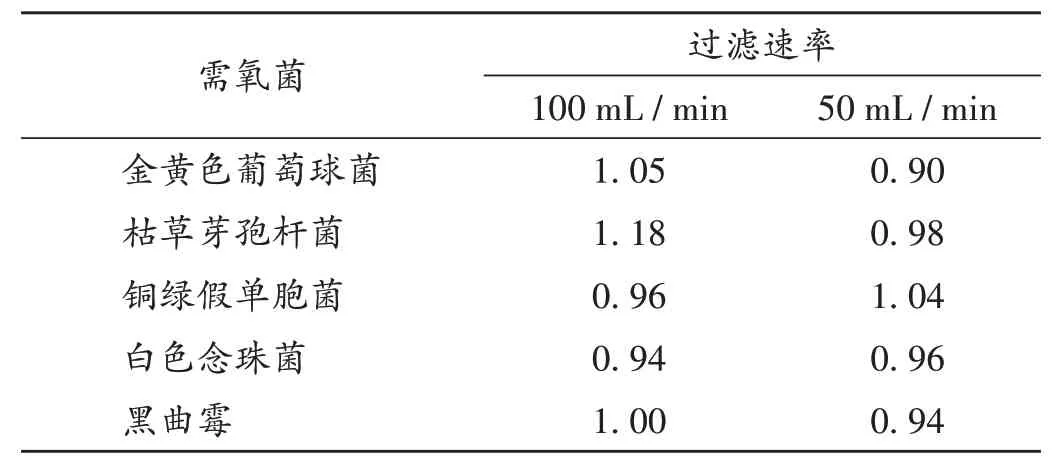
表3 前加菌需氧菌低速对照组的回收试验结果(n=3)Tab.3 Results of the recovery test of low-filtration-rate control group of aerobic bacteria by bacteria-addition before filtration(n=3)
2.3 需氧菌计数方法的确定
根据表1 至表3 结果,确定样品(HR)需氧菌计数方法采用薄膜过滤法(试验组1,前加菌),过滤速率为50 mL/min,取1∶500(V/V)供试液1 mL 进行试验。
2.4 其他需氧菌计数方法适用性试验结果
根据确认的需氧菌计数方法对其他需氧菌计数方法进行适用性试验,回收比均为0.5~2.0;3 批样品(HR)按平皿法操作,霉菌和酵母菌的回收比也均为0.5~2.0,符合药典要求。详见表4。

表4 微生物计数方法适用性试验结果(n=3)Tab.4 Results of the suitability test for microbial counting method(n=3)
2.5 控制菌(大肠埃希菌)限度检查方法适用性试验结果
样品(HR)控制菌检查可联用薄膜过滤法(5 张滤膜)和培养基稀释法,过滤速率为50 mL/min,增菌培养基体积为700 mL。详见表5、表6。

表5 控制菌检查方法适用性试验(直接接种法)结果Tab.5 Results of the suitability test for specified microorganism test(direct inoculation)

表6 控制菌检查方法适用性试验(薄膜过滤法)结果Tab.6 Results of the suitability test for specified microorganism test(membrane filtration)
2.6 其他企业微生物限度检查方法适用性试验结果
根据3 批样品(HR)确定的微生物限度检查方法,对另外3 家企业的样品进行关键菌微生物限度检查方法适用性试验,金黄色葡萄球菌的计数采用薄膜过滤法(试验组1,前加菌),过滤速率为50 mL/min,取不同稀释度供试液1 mL进行试验。详见表7。控制菌(大肠埃希菌)检查联用薄膜过滤法(5 张滤膜)和稀释法,过滤速率为50 mL/min,增菌培养基体积为200~1 200 mL。

表7 其他样品微生物限度检查方法适用性试验结果Tab.7 Results of the suitability test of microbial limit test for other samples
3 讨论
抗生素类药物在确定微生物限度检查方法时,为消除抑菌性,常采用薄膜过滤法、添加中和剂、增加稀释液或培养基体积及联用上述方法[7-10]。阿奇霉素干混悬剂具有较强抑菌活性,以常规缓冲液作为稀释液和冲洗液,采用200 mL/ min 过滤速率进行薄膜过滤时,无法消除其对金黄色葡萄球菌的抗菌活性;用直接接种法进行控制菌检验时,在供试液和增菌培养基中加入常用中和剂[11-12],也无法消除其对大肠埃希菌的抑制作用。本研究中通过降低薄膜过滤法的过滤速率,并联用多种方法,降低该药的抑菌性,使其需氧菌和控制菌的限度检查方法适用性试验结果符合药典规定。
阿奇霉素不溶于水、脂溶性高、呈弱碱性、味苦,将其制成干混悬剂,可遮盖苦味使其易于吞咽,且干混悬剂还具有易分装、胃肠道刺激性小、易吸收等优点[13]。分析低速过滤可使微生物限度结果符合要求的原因,可能与该药辅料的溶解有关,如阿奇霉素干混悬剂样品(HR)的辅料为蔗糖、无水磷酸三钠、羟丙基纤维素、合成生物聚合胶、香精,低速过滤使水溶性辅料溶解时间延长,辅料溶解后,有抑菌作用的阿奇霉素也随冲洗液被冲洗过滤掉;而用相对高的速率冲洗时,不利于水溶性辅料的溶解,未溶解的辅料和抑菌药物仍残留在滤膜上,当滤膜移至培养基,辅料会进一步溶解,暴露出来的阿奇霉素作用于微生物,导致结果不符合要求。
本研究中进行需氧菌计数方法适用性试验时,为得到更高稀释度的试验方法,又采用后加菌的方式进行薄膜过滤试验,虽然后加菌的供试液Ⅲ回收试验结果较前加菌试验高,但3 批样品(HR)回收比并未全部达到0.5,因此依据前后加菌试验的结果,确定以前加菌的方式进行需氧菌的薄膜过滤试验。采用薄膜过滤法进行控制菌检验时,将混匀的10 mL供试液Ⅰ直接加至1 个滤杯或平分加入2 个滤杯中进行过滤时,样品的颗粒会堵塞滤膜;当将供试液分成5 份,每份2 mL,分别加至5 个滤杯中进行过滤时,滤膜未堵塞,但因加入药量较计数试验时多,最大过滤速率也相应降低(由计数试验的200 mL/ min 降至150 mL/ min)。因此,将供试液分于多张滤膜过滤,使每张滤膜上的样品量减少;用低速(50 mL/min)分别对其进行冲洗,进一步降低每张滤膜上的抑菌成分;并将滤膜置增加的培养基中,即联用多种方法去除样品对大肠埃希菌的抑菌性。
薄膜过滤法是用冲洗液将滤膜上残留的药物冲洗过滤掉,减少或消除滤膜上抗菌药物及其抑菌性。药典对薄膜过滤法的滤膜、冲洗量等因素均作了明确规定[7],但对过滤速率并未要求。近年来,随着抗生素微生物限度检查方法研究的深入,薄膜过滤法的应用也在不断发展,包括发明双滤膜过滤法防止滤膜堵塞[14]及通过增加滤膜数量的方式增加冲洗量[15],但对薄膜过滤速率的研究较少。本研究中通过对阿奇霉素干混悬剂需氧菌、控制菌限度检查方法的研究,证明薄膜过滤法的冲洗液流速影响微生物的计数回收结果和控制菌的检出,低流速在不影响试验菌回收的情况下,增加了药物中水溶性成分的溶解时间,使其与抑菌药物相继被冲洗掉,且流速越低对药物抑菌性的消除作用越强。故本研究结果为完善薄膜过滤试验条件、增加去除抗菌药物的方法及相关研究提供了依据和新思路。

