GnRH-a配合来曲唑治疗对OHSS患者的价值分析
赵 丽 康幼雯 李雅丹
许昌中医院妇产科,河南省许昌市 461000
卵巢过度刺激综合征(Ovarian hyperstimulation syndrome,OHSS)为辅助生殖技术(ART)最具潜在风险的并发症,随着不孕症患病率不断上升,促排卵药物及ART广泛应用,OHSS发生风险也在逐渐增加[1-2]。相关研究结果表明,性激素、抗缪勒管激素(AMH)及血管内皮生长因子(VGEF)水平在OHSS的发生、发展中起着重要作用[3]。且有研究指出,AMH是预测OHSS的危险因素[4]。因此,对OHSS危险因素尽早采取防护措施至关重要。来曲唑可调节机体雌激素水平,纠正体内雌孕激素失衡,在改善卵巢功能方面表现突出,但单一用药机制较为单一,整体疗效未达临床预期[5]。促性腺激素释放激素激动剂(GnRH-a)是近年来临床上预防OHSS的重大突破,其可通过抑制生殖激素释放,促使雌、孕激素水平下降,进而达到临床治疗目的。本文旨在探讨GnRH-a联合来曲唑对OHSS患者性激素及VGEF、AMH水平的影响。报道如下。
1 资料与方法
1.1 一般资料 本研究经我院伦理委员会审核批准,以我院2019年7月—2021年11月收治的108例OHSS患者为观察对象,根据就诊时间编号,应用电脑随机数字表随机分为两组,各54例。对照组年龄23~42(31.45±2.46)岁;体质量指数(BMI)18.4~26.9(22.28±1.23)kg/m2;不孕年限1~6(3.03±0.52)年;取卵数14~30(21.78±2.75)个;获卵数9~16(13.21±1.24)个。观察组年龄22~42(30.14±2.67);BMI 18.6~26.7(22.54±1.31)kg/m2;不孕年限2~6(2.88±0.40)年;取卵数15~31(22.18±3.11)个;获卵数8~16(12.91±1.20)个。两组一般资料比较差异无统计学意义(P>0.05)。
1.2 选择标准 (1)纳入标准:符合《辅助生殖技术并发症诊断及处理共识》[6]中OHSS的诊断标准;均为不孕症患者;>3个月无激素类药物应用史;年龄22~42岁女性;患者及家属签署知情同意书。(2)排除标准:先天性卵巢发育异常;对本研究药物存在过敏史;肝肾功能不全者;合并自身免疫疾病者;依从性差,中途未完成退出者;治疗过程中出现内分泌异常者。(3)剔除标准:发生挺严重并发症者;不按规定服用药物;不宜继续接受实验者。
1.3 治疗方法 对照组予以来曲唑(Novartis Pharma Schweiz AG,批准文号H20140149)治疗,口服,剂量5mg/次,1次/d。观察组予以来曲唑+GnRH-a(Ipsen Pharma,批准文号H20140298)治疗,来曲唑用法用量与对照组一致。月经第3 天皮下注射0.25mg GnRH-a,1次/d。两组均治疗7d。
1.4 观察指标 (1)对比两组OHSS发生情况。OHSS评定标准为重度:肾功能衰竭、晕厥、凝血异常、呼吸困难、经彩色多普勒超声诊断仪检查(大为医疗江苏有限公司,型号DW-T5)腹腔大量腹水;中度:腹泻不止、卵巢增大、超声检查可见少量腹水、腹痛;轻度:腹胀、呕吐、恶心、乏力、卵巢增大直径为5~12cm。(2)治疗前后(月经第3 天)分别抽取两组肘静脉血5ml,2 500r/min,离心10min,离心取上清液,置于低温环境待检。雌二醇(E2)、AMH、促卵泡激素(FSH)、促黄体生成素(LH)以全自动化学发光分析仪(青岛聚创环保集团有限公司,型号BDFIA-8600)测定;VEGF以酶联免疫吸附法测定。(3)治疗前后两组经超声检测血流指数(FI)、卵巢3D体积(OV)、卵巢间质动脉峰值流速(PSV)、血管血流指数(VFI),取两侧卵巢数据平均值。(4)统计治疗过程中两组出现的血栓生成、腹痛及潮热等不良反应。

2 结果
2.1 OHSS发生率 治疗后,观察组轻度OHSS发生率高于对照组,中度OHSS发生率低于对照组(P<0.05),而两组重度OHSS发生率比较差异无统计学意义(P>0.05)。见表1。

表1 两组OHSS发生率比较[n(%)]
2.2 性激素 治疗后,两组LH、FSH、E2水平均较治疗前下降,且观察组低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组LH、FSH、E2水平比较
2.3 血清VGEF、AMH水平 治疗后,两组VGEF、AMH水平均较治疗前下降,且观察组低于对照组(P<0.05)。见表3。

表3 两组血清VGEF、AMH水平比较
2.4 超声定量指标 治疗后,两组FI、VFI、OV及PSV速度均较治疗前下降,且观察组低于对照组(P<0.05)。见表4。

表4 两组FI、VFI、OV、PSV比较
2.5 不良反应 治疗过程中,两组不良反应发生率比较差异无统计学意义(χ2=0.911,P=0.339>0.05)。见表5。
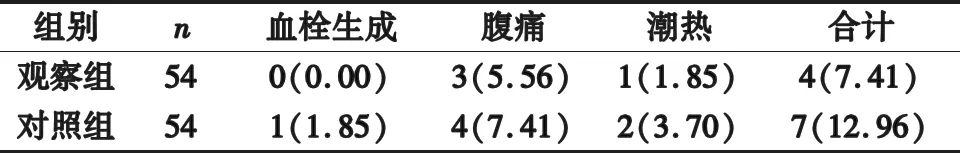
表5 两组不良反应比较[n(%)]
3 讨论
OHSS是一种严重的医源性并发症,属于自限性疾病,以卵巢体积增大、E2水平过高及多卵泡发育为临床特征,现代医学认为,OHSS发生与患者身体条件、基础激素水平及药物剂量等因素密切相关,若未及时给予有效干预,体液转移至第3腔隙,易并发血管栓塞、肾功能衰竭等,严重威胁患者生命安全[7-8]。因此在辅助生殖的同时,减少OHSS是目前研究的方向。
来曲唑属于芳香化酶抑制剂,可通过减少对下丘脑—垂体的负反馈,加快促性腺激素表达,进而促进卵泡发育[9]。周冬梅等[10]研究表明,来曲唑联合GnRH-a治疗OHSS效果确切,可显著降低E2水平,降低OHSS中度发生率。本文结果发现,观察组轻度OHSS发生率高于对照组,中度OHSS发生率、LH、FSH、E2低于对照组(P<0.05),提示两者联合治疗OHSS疗效确切,能调节机体性激素水平,与上述研究结果一致。分析认为:GnRH-a通过与其受体相结合,抑制促性腺激素分泌,进而降低LH、FSH水平,影响黄体发育,降低体内E2水平,减少OHSS发生风险。当前研究认为,VGEF、AMH水平紊乱为OHSS发展的主要病因,VGEF水平升高导致血管通透性增加,加快血管蛋白液体外渗至第3间隙,导致出现血液浓缩、腹水及血栓生成等一系列症状,且有研究指出,VGEF与机体E2水平呈正相关[11]。AMH是评估卵巢储备功能的重要指标,其水平升高可导致卵巢反应性降低,与体内雄激素水平成正比。经来曲唑、GnRH-a联合治疗后,发现两组VGEF、AMH水平均较治疗前下降,且观察组低于对照组(P<0.05)。王瑾学者[12]指出,每天服用来曲唑可显著降低VGEF水平,且下降趋势平稳。GnRH-a通过抑制下丘脑—垂体—卵巢轴功能,降低体内VGEF水平,还可通过阻碍细胞增殖,抑制VGEF分泌。
既往研究证实,超声定量指标可通过功能、血流及结构等多方面评估卵巢状态,从根本上避免OHSS发生[13]。FI、VFI、PSV可直接反映患者卵巢血供状态,卵巢血供与卵巢功能紧密相关,可促进卵巢细胞生长,可用于评估卵巢在外部刺激下的反应性。黄映琴等[14]研究指出,OHSS发生后卵巢血流丰富,卵巢高储备功能,致使卵巢呈高反应性。OV与获卵数呈正相关,是目前临床反映卵巢功能状态的最有意义指标。本文数据显示,治疗后两组FI、VFI、OV及PSV速度均较治疗前下降,且观察组改善程度优于对照组(P<0.05),提示两者联合可调节卵巢血流供应,缩小卵巢体积。原因分析为,GnRH-a通过抑制雌激素释放,可缩小子宫,减少出血量,进而改善卵巢基质血流,促进卵巢功能恢复,有效避免OHSS发生。
综上所述,来曲唑联合GnRH-a治疗OHSS可调节患者性激素水平,抑制VGEF、AMH释放,改善卵巢功能,降低OHSS发生率。

