肠道菌群代谢产物三甲胺N-氧化物在对骨质疏松症骨髓间充质干细胞功能的影响及与骨质疏松症损害中的作用关系
陈智伟 孙艳 代丹娇 张华清
(南方科技大学医院内分泌科,广东 深圳 518000)
骨质疏松症(OP)是以骨密度降低、骨微结构破坏、脆性增加和骨折风险为特征的一种全身性疾病[1]。其具有潜在的破坏性后果和较高的累积骨折发生率,对公共卫生造成重大的挑战。与年龄相关的OP中,干细胞调节失衡可能是引起疾病发生的一项关键机制之一[2]。骨髓间充质干细胞(BMSCs)是一种广泛存在于骨髓腔中的干细胞,具有向多种类型的骨细胞分化并分泌多种调节骨代谢物质的多功能细胞的潜能[3]。诸多研究[4-5]表明,在机体病理状态下,BMSCs的功能发生了变化失调,导致骨代谢失衡,最终导致OP的发生。研究[6]报道,肠道微生物区系通过调节免疫系统(如破骨细胞发生)、肠道钙吸收、神经递质(如5-羟色胺)释放等来调节骨量。因此,明确肠道微生物具体调节机制有助于寻找新的生物标志物,掌握其与骨量紊乱的关系。三甲胺-N-氧化物(TMAO)是一种肠道微生物依赖的膳食胆碱代谢产物,已被证明与心血管风险呈正相关[7]。最近的一项研究[8]发现,TMAO与年龄相关性OP密切相关。然而,关于TMAO如何影响骨代谢以及潜在的分子机制的研究较少。本研究旨在探讨TMAO对BMSCs功能的影响,以明确TMAO在OP发生发展中的作用。
1 资料与方法
1.1一般资料 选取2018年1月至2020年1月在我院住院期间行骨密度检查的老年OP患者20例。纳入标准[9]:股骨颈骨密度T评分<-2.5SD;年龄<70岁;自愿参与本项研究;无其他基础疾病。排除标准[10]:年龄≥70岁;存在其他基础疾病。将20例OP患者纳入研究组,选取相同年龄层的20例健康志愿者为对照组。所有病人均签署知情同意书。本研究经医院伦理委员会审批(LCYJ2021083)。
1.2方法
1.2.1材料 TMAO(货号317594,Sigma-Aldrich,Burlington,MA,USA)、胎牛血清(FBS)(货号12483020,Thermo Fisher Scientific,Waltham,MA,USA)、α-改良Eagle培养基(α-MEM)(货号SH302265.01,Hyclone,Logan,Utah,USA)、成脂分化培养基(货号RASMX-90031,Cyagen,Guangzhou,China)、成骨分化培养基(货号RASMX-90021,Cyagen,Guangzhou,China)、活性氧(ROS)检测试剂盒(货号KGT010-1,KeyGen Biotech,南京,中国)、人氧化三甲胺(TMAO)ELISA试剂盒(货号JL47698,江莱生物,北京,中国)。肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6的酶联免疫吸附试验(ELISA)试剂盒购自CUSABIO生物技术公司(中国武汉)。抗活化B细胞核因子κB轻链增强子(NF-κB)-p65(Cat#ab16502)的抗体购自Abcam(Cambridge,MA,USA)。抗过氧化物酶体增殖物激活受体y(PPARγ)(目录号AF6284)和runt相关转录因子2(RUNX2)(目录号AF0313)的抗体获自Affinity Biosciences(中国江苏)。
1.2.2BMSCs的原代培养及特性研究 分离和扩增大鼠BMSCs的分离和培养。采用颈椎脱位法处死的6周龄大鼠,将其浸泡在75%的乙醇5~10 min,使用无菌手术器械,仔细分离完整的大鼠胫骨和股骨。骨髓细胞在1.073 g/mL Percoll密度梯度中冲洗和离心。从界面收集富集的细胞,用在加添加10%胎牛血清和、1%青霉素-链霉素-新霉素的α-MEM培养液的培养瓶中培养。培养72 h后,丢弃未贴壁细胞,用磷酸盐缓冲盐水洗涤贴壁细胞两次。每隔3 d加入和更换新鲜的完整培养液,第3~5代细胞用于后续实验。
1.2.3细胞增殖试验 用不同剂量(0、50、100、200、400、600 μMmol/L)的TMAO三甲氧胺处理BV2细胞,观察三甲氧胺对细胞活力的量效关系。用CCK8溶液在五个不同的时间段法评估细胞活力。使用微型平板阅读器检测450 nm处的吸光度,以便计算每个值并编绘制增殖曲线。
1.2.4活性氧测定 使用活性氧检测试剂盒检测细胞内活性氧的积累。将骨髓间充质干细胞用不同浓度的氧化三甲胺处理48 h后,收集细胞,用无血清细胞培养液洗涤两次,再用二氯二氢荧光素二乙酸酯在37℃避光中孵育30 min。在用无血清细胞培养液洗涤3次以完全去除任何未进入细胞的DCFH-DA后,用FACSCantoTM II流式细胞仪检测活性氧水平。
1.2.5成脂和成骨分化 将BMSCs接种于12孔板中,用含10-7mmol地塞米松、10 mmol β-甘油磷酸酯和50 μ mmol抗坏血酸-2-磷酸的成骨诱导培养基或成脂诱导培养基(含10-6mmol地塞米松、0.2m mmol吲哚美辛、0.1m mmol胰岛素、1m mmol 3-异丁基-1-甲基黄嘌呤)处理。在第14天,通过茜素红S或油红O染色来评估分化能力。为了形成钙沉积,细胞用磷酸盐缓冲盐水洗涤,并用70%乙醇固定15 min。细胞用0.5%茜素红S(pH=4.1)室温放置10 min,蒸馏水清洗3次。橙红色染色显示钙沉积的位置和强度。光镜下观察细胞内钙沉积情况。脂肪滴形成用磷酸盐缓冲盐水洗涤,10%甲醛固定30 min。在磷酸盐缓冲盐水中洗涤两次后,细胞在新鲜稀释的油红O溶液中染色1 h。然后,去除污渍,用磷酸盐缓冲盐水洗涤细胞两次。用倒置显微镜观察油红O染色的细胞图像。
1.2.6细胞培养上清液中促炎症细胞因子浓度的检测 将骨髓间充质干细胞分别加或不加TMAO处理12、24、48 h,收集细胞培养上清液。促炎细胞因子(IL-1、β、IL-6、TNF-α)用ELISA试剂盒检测。
1.2.7Western印迹分析 细胞刺激48 h后,采用放射免疫沉淀试验提取不同组蛋白,采用二喹啉甲酸蛋白检测试剂盒测定蛋白浓度。在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳上分离总蛋白,并转移至聚偏二氟乙烯膜中。然后将膜在含有5%脱脂奶粉的三缓冲盐水中封闭1 h,之后与抗PPARγ(1:500)、C/EBP-α(1:1 000)、RUNX2(1:1 000)、OPN(1:1 000)、NF-κB(1:1 000)和GAPDH(1:2 000)的一抗在4 ℃孵育过夜。然后用TBST洗涤膜,用二抗孵育1 h。使用Pierce ECL Western Blotting底物检测抗体反应条带。使用Image J软件分析条带强度的定量。
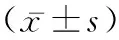
2 结 果
2.1OP患者血清TMAO水平和正常人比较 TMAO浓度与骨密度呈显著负相关(R2=-0.518,P=0.019)(见图1A)。与正常组比较,骨质疏松症组TMAO浓度明显升高(P=0.007<0.01)(见图1B)。
2.2TMAO对BMSCs增殖的影响 通过检测OP患者血液样本中TMAO水平的变化,我们选择了合适的TMAO浓度进行后续研究。在细胞增殖实验中,结果表明,50和100 μM浓度的TMAO对细胞活力无明显影响,而200~600 μM浓度的TMAO则以时间和剂量依赖的方式显著抑制细胞的生长(见图2)。
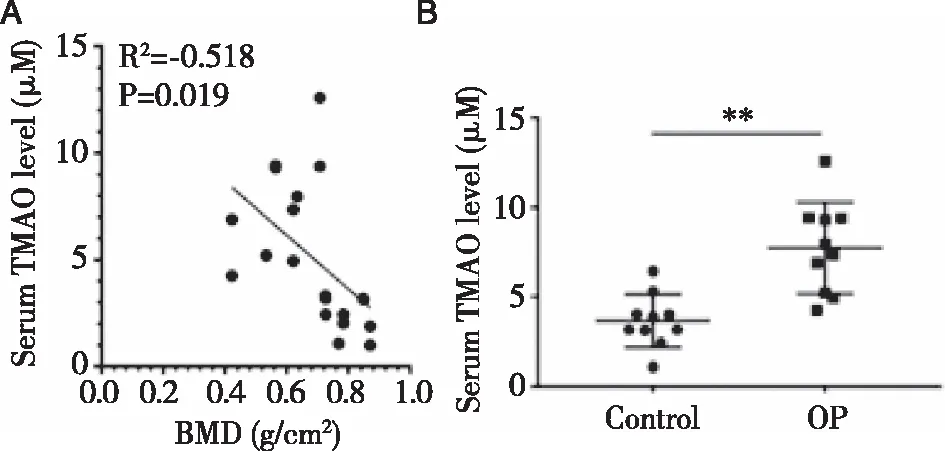
注:A.OP患者和正常人血清TMAO水平与骨密度相关性;B.采用ELISA法检测OP患者和正常人血清TMAO水平。图1 OP患者血清TMAO水平变化
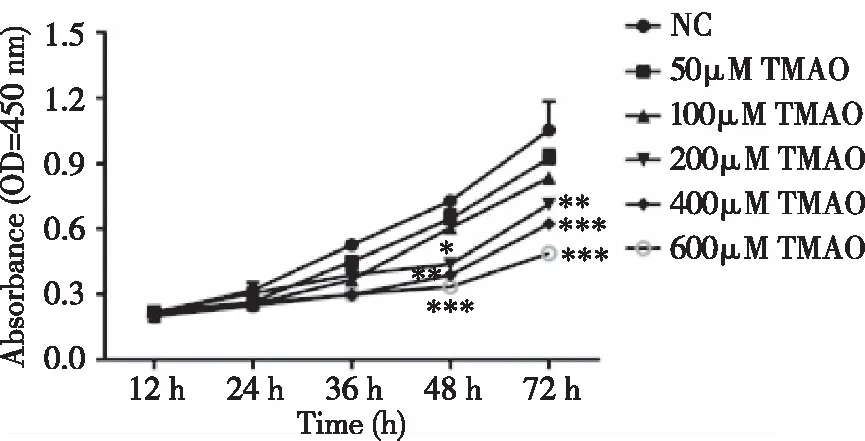
图2 不同TMAO浓度对BMSCs增殖的影响
2.3TMAO对BMSCs释放活性氧和促炎细胞因子水平的影响 TMAO处理后BMSCs中活性氧的形成增加,尤其是当TMAO浓度在200~600 μM范围内时(图3A、B)。根据这些结果,在后续的实验中选择了TMAO的浓度为200 μM。为阐明TMAO对BMSCs促炎细胞因子水平的影响,采用ELISA试剂盒检测细胞培养上清液中TMAO对BMSCs促炎细胞因子水平的影响。结果表明,与对照组比较,研究组IL-1β(P<0.001)、TNF-α(P<0.001)和IL-6(P<0.001)水平明显升高(图3C、D、E)。
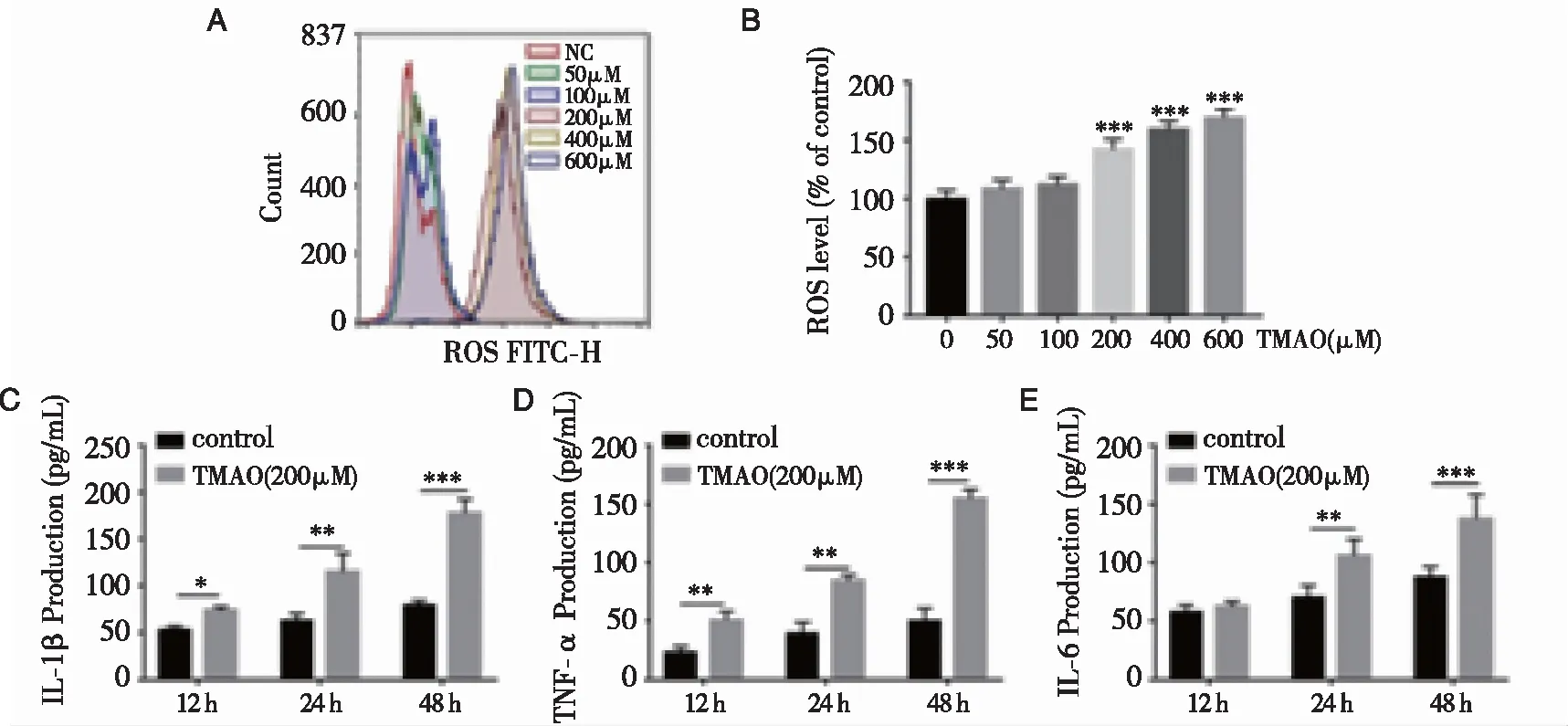
注:(A)用流式细胞仪检测细胞内活性氧(ROS)水平;(B)用平均荧光百分率表示ROS水平的变化;(C、D、E)用ELISA法测定促炎细胞因子(IL-1β、TNF-α和IL-6)水平。图3 TMAO对BMSCs活性氧释放和促炎细胞因子水平的影响
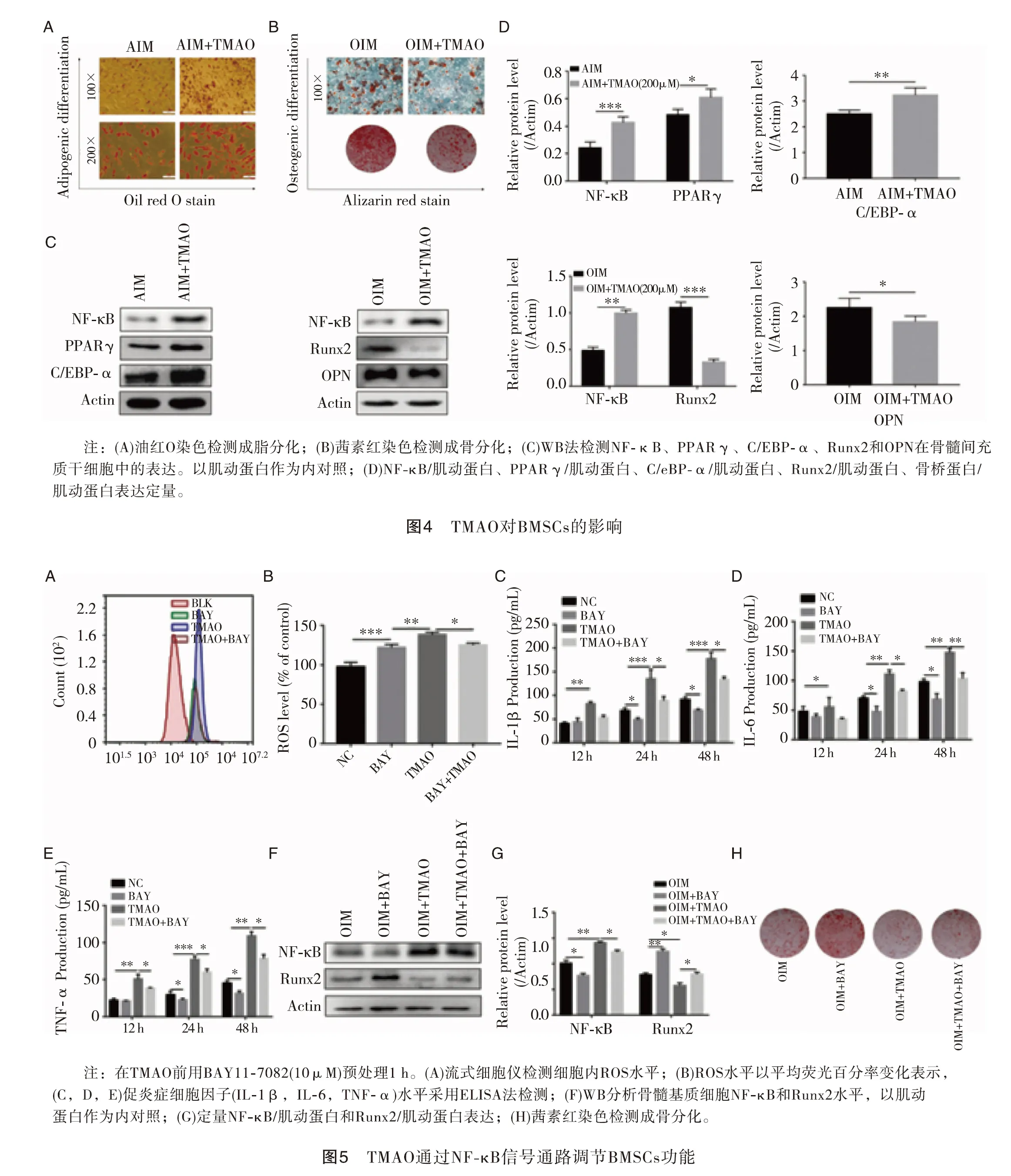
2.4TMAO对BMSCs的影响 为了阐明TMAO对BMSCs成脂分化和成骨分化的影响,我们在成脂诱导培养基和成骨诱导培养基中分别加入和不加TMAO处理BMSCs、油红O染色观察脂肪滴形成情况、茜素红染色观察钙沉积情况,结果表明,TMAO处理的细胞比对照细胞产生更多的脂肪滴,同时矿化结节减少(图4A,B放大倍数见图)。通过Western印迹分析进一步检测相应的成骨(Runx2和OPN)或成脂(PPAR、γ和C/EBP-α)标志物的表达,结果表明,TMAO可上调PPARγ和C/EBp-α蛋白的表达,降低Runx2和OPN蛋白的表达(图4C,D),提示TMAO对BMSCs成脂分化有促进作用,但对成骨分化有抑制作用。
2.5TMAO通过NF-κB信号通路调节BMSCs功能 NF-κB信号通路已被证明在骨代谢的调节中起着关键作用。我们检测NF-κB蛋白水平,以确定NF-κB信号通路是否参与了三甲氧胺诱导的BMSCs分化功能。结果表明:无论是单次注射还是单次注射TMAO,BMSCs中NF-κB蛋白的表达水平均在氧化三甲胺存在的情况下升高(图4C,D)。为确定NF-κB活性是否参与TMAO调节的BMSCs功能,我们应用NF-κB抑制剂BAY 11-7082阻断NF-κB的活性,如图5A和B所示,与TMAO处理组相比,BAY 11-7082处理组的活性氧水平显著降低。同样,ELISA结果显示,BAY11-7082预处理可显著降低TMAO诱导的促炎细胞因子(IL-1β、IL-6和TNF-α)水平(图5C、D、E)。此外,经TMAO处理的BMSCs进入OIM后,Bay11-7082处理组的Runx2蛋白表达和矿化结节明显增加(图5F,G)。以上结果表明NF-κB活性在氧化三甲胺处理BMSCs的细胞功能中起着至关重要的作用(图5H)。
3 讨 论
OP的特征是骨量和/或骨质的减少导致骨骼脆性增强。骨强度不能在体内直接测量,但骨密度与骨强度高度相关。因此,骨密度值经常被用作预测骨折风险的关键临床指标。在本研究中,TMAO水平与骨密度值呈显著负相关,OP患者血清TMAO水平高于对照组,提示TMAO在OP的发生发展中起重要作用。
最近的研究[11-13]表明,肠道微生物可能是骨生理学的关键调节因素。肠道微生物区系可以通过细菌修饰或通过它们的代谢物的作用来激活包括骨髓在内的各种组织中的炎症反应。TMAO是一种肠道微生物依赖的膳食胆碱代谢产物,已被证明与OP相关。在本研究中,BMSCs经三甲氧胺处理后,细胞增殖明显下降,而促炎细胞因子(IL-1β、TNF-α和IL-6)水平明显升高。此外,TMAO处理的BMSCs内活性氧的产生呈剂量依赖性增加。提示TMAO对BMSCs功能的影响可能是通过激活炎症反应实现的。目前,OP被广泛认为是由BMSCs代谢异常引起的疾病。许多证据表明[14-15],OP的BMSCs在内在信号上存在缺陷,导致功能改变,导致成骨分化能力低下,有利于增加脂肪生成。本研究发现TMAO对BMSCs成脂分化有诱导和促进作用,但对BMSCs成骨分化有抑制作用。成脂分化标志蛋白PPARγ和C/EBp-α表达上调,成骨分化蛋白Runx2和OPN表达下调。这些结果证实了TMAO通过调节BMSCs的分化参与了OP的发生发展。
NF-κB是炎症和骨重建过程的主要调节者。NF-κB活性的增加伴随着骨吸收的增强和骨形成能力的降低[15]。本研究显示TMAO处理后NF-κB p65表达增加。为确定NF-κB的调节是否与TMAO介导的BMSCs功能有关,用NF-κB的特异性抑制剂BAY 11-7082预处理细胞2 h,然后用TMAO处理。结果表明,NF-κB抑制剂BAY11-7082能显著降低BMSCs促炎细胞因子(IL-1β、α和IL-6)的产生和活性氧的释放,与TMAO治疗组相比(P<0.05)。此外,Bay11-7082可显著逆转Runx2(P<0.05)和钙结节的表达。然而,这项研究有几个局限性。首先,样本量相对较小,需要更大的样本量才能扩大研究范围。其次,尽管本研究证实TMAO通过NFκB信号通路调节骨BMSCs的功能(包括细胞增殖、细胞分化和炎症反应),但也可能涉及其他信号通路(如自噬信号通路),这需要进一步的验证。最后,TMAO对BMSCs成骨分化的抑制作用还有待体内实验进一步验证。
综上所述,TMAO水平与骨密度值呈显著负相关。TMAO通过上调NF-κB信号通路抑制BMSCs增殖,增加促炎性细胞因子的产生和活性氧的释放,抑制成骨分化,促进成脂分化,可能导致骨代谢失衡,加重骨丢失,进而导致OP的发生。(图4、图5见封三)。