Ti3C2Tx MXene 抗蛋白质吸附的分子模拟
陈 莉,朱袁锋
(1.天津工业大学 材料科学与工程学院,天津 300387;2.天津工业大学 省部共建分离膜与膜过程国家重点实验室,天津 300387)
MXene 是一类由2 层或多层过渡金属原子(M 原子)和碳/氮原子(X 原子)组成的二维层状材料。其中,M 原子堆积在蜂窝状的二维晶格中,X 原子插层在邻近的M 原子层之间。Ti3C2TxMXene 是一种典型的MXene 材料,通过Ti3AlC2MAX 前驱体在氢氟酸中选择性刻蚀掉Al 原子层制成[1-3]。Ti3C2TxMXene 作为一种新兴的二维材料,由于具有高比表面积、容易功能化、尺寸可控等特点[4-7],在气体分离[8]、海水淡化[9]、有机溶剂纳滤[10]、生物[11]等领域取得了很大的进展。
蛋白质吸附会引起血小板粘附,进而引发血栓,导致严重的后果。目前传统的抗蛋白吸附材料主要聚焦于聚乙二醇和两性离子材料,但是聚乙二醇的不稳定性和两性离子材料表面的亲/疏水组分不相容决定了它们并不是最优选。因此,研究Ti3C2TxMXene 作为抗蛋白吸附材料的可行性及其抗蛋白质吸附机理,不论在临床应用方面还是在抗蛋白吸附理论体系方面,均有较高价值。
传统的实验表征方法难以精确阐述材料抗蛋白质吸附的机制[12-13]。本文以分子动力学模拟[14]为手段构建了多个抗蛋白吸附模型,研究多种蛋白质在Ti3C2TxMXene 纳米片表面的构象变化,探究Ti3C2TxMXene对蛋白质结构的影响,由此最大限度地发掘Ti3C2Tx中MXene 在生物领域的潜能。
1 实验部分
1.1 原料与设备
原料及试剂:聚偏氟乙烯粉末(PVDF),工业品(6015),比利时Solvay 公司产品;N,N-二甲基甲酰胺(DMF)、聚乙二醇(PEG,6 000),均为分析纯,天津市科密欧化学试剂有限公司产品;氟化锂,分析纯,天津市希恩思生化科技有限公司产品;浓盐酸,分析纯,天津市永飞化学试剂有限公司产品;Ti3AlC2,325 目,纯度98%,北京福斯曼科技有限公司产品。
设备:DZF-6020 型真空烘箱,上海申贤恒温设备公司产品;WE-2 型数显水浴恒温振荡器,中国欧诺仪器仪表有限公司产品;HJ-3 型磁力搅拌器,金坛市友联仪器公司产品;KQ-100E 型超声波清洗器,昆山市超声仪器有限公司产品;SHZ-D(Ⅲ)型循环水真空泵,上海邦西仪器科技有限公司产品;ALPHA1-2 型冷冻干燥机,德国Christ 公司产品;TU-1901 型紫外-可见光分光光度计,北京普析仪器有限公司产品。
1.2 蛋白吸附模型的构建
本文采用GROMACS 4.6.7 软件[15-16]构建蛋白吸附模型。将蛋白质分子(溶菌酶、β2微球蛋白(β2-MG)、牛血清蛋白(BSA)和人血清蛋白(HSA))放置在Ti3C2TxMXene 表面后,再往模拟体系中填充水分子和对应的相反电荷离子以确保整个体系的电中性,并在3 个方向施加周期性边界条件(PBC),以研究蛋白质分子在Ti3C2TxMXene 表面的构象变化。Ti3C2TxMXene 采用通用力场[17],并由密度泛函理论得到每个原子的电荷,蛋白质的力场数据取自GROMACS 的全原子力场。
模型构建完成后,首先进行1 000 步的能量最小化,采用steep 算法,步长为5 fs。完成后,进行100 ns宏观正则系综(NVT)的模拟,温度由Verscal 恒温器保持,短程和长程相互作用的截断距离均为0.8 nm,每进行10 步就更新一次[18]。原子之间的静电相互作用由Particle-Mesh Ewald(PME)算法计算[19]。考虑现实中Ti3C2TxMXene 是坚硬的固体,所以在模拟环境中Ti3C2TxMXene 被冻结住。在NVT 模拟的最后90 ns 进行数据收集与分析。
1.3 膜的制备
(1)PVDF 膜的制备:先将14 g 聚偏氟乙烯(PVDF)粉末、10 g 聚乙二醇(PEG,6 000)倒进三口圆底烧瓶中,再将76 g N,N-二甲基甲酰胺(DMF)溶液倒入该三口圆底烧瓶中,在60 ℃下密封搅拌8 h,然后将其放入60 ℃的真空烘箱内,进行真空静置脱泡。脱泡完成后,将铸膜液快速而均匀地倾倒在干净的玻璃板上,使用200 μm 的刮刀推动铸膜液移动,待上述过程完成后将玻璃板迅速且平坦地浸入去离子水中,使其成膜。将制备的PVDF 膜转移到装有去离子水的盆中浸泡。将纯PVDF 膜记为MP膜。
(2)Ti3C2O2MXene 的制备:将1 g LiF 粉末分批缓慢加入到装有20 mL 9 mol/L HCl 溶液的离心管里,并搅拌3~5 min 后得到刻蚀液;再将1 g Ti3AlC2分批缓慢地添加到上述溶液里,在35°C 密封条件下搅拌24 h;搅拌完成后,用去离子水洗涤所得产物,在3 500 r/min下离心数次,直到上清液的pH 值大于6,并且获得粘土状沉淀物;最后将沉淀物分散在去离子水中,超声处理4 h 使Ti3C2O2MXene 分层。将获得的产物进行冻干,用于膜的制备[20]。
(3)Ti3C2O2MXene/PVDF 膜的制备:将24 mg Ti3C2O2MXene 溶入30 mL 去离子水,经过10 min 的超声后,通过真空辅助抽滤的方法将Ti3C2O2MXene 转移到PVDF 膜上,记为MM1。重复上述操作n 次可得到多层复合膜,记为MMn。
1.4 蛋白质的吸附实验
将BSA 作为吸附目标,通过蛋白的静态吸附实验分析Ti3C2O2MXene 的抗污染能力。将制备好的膜剪成1.5 cm×1.5 cm 的小方片,将其正面向上放置于0.04 g/L BSA 溶液中,设定吸附温度25 ℃,转速60 r/min,吸附时间24 h,以确保膜和蛋白质之间达到饱和吸附状态。通过对BSA 溶液进行紫外分光光度计测量,得到吸附前后BSA 的浓度变化,从而计算吸附量。
2 结果与讨论
2.1 Ti3C2O2 MXene 的静态吸附实验分析
图1 所示为Ti3C2O2MXene 的BSA 吸附量。

图1 BSA 的吸附量Fig.1 Adsorption capacity of BSA
由图1 可知,纯PVDF 膜对BSA 的吸附量为65 μg/cm2,而沉积了一层Ti3C2O2MXene 的PVDF 膜表面对BSA 的吸附量较纯PVDF 膜有所下降(45 μg/cm2),这表明Ti3C2O2MXene 有抗蛋白吸附的能力。随着沉积的Ti3C2O2MXene 量增加,BSA 的吸附量逐渐下降。这是由于纯PVDF 膜表面较为疏水,会导致蛋白质的大量吸附[21]。由于传统的实验方法无法解释Ti3C2O2MXene 的抗蛋白吸附机理,因而需要借助分子模拟的手段进行深入探究。
2.2 均方根位移和均方根波动分析
图2 为4 种蛋白质在5 种Ti3C2TxMXene 表面的均方根位移(RMSD)数值。

图2 蛋白质在Ti3C2Tx MXene 表面的均方根位移Fig.2 RMSD of proteins on surface of Ti3C2Tx MXenes
由图2 可知,4 种蛋白质的均方根位移(0.13、0.16、0.27 和0.35 nm)与质量(β2-MG 为11 kDa、溶菌酶为14 kDa、BSA 为66 kDa 和HSA 为67 kDa)成正比。位移越大,形变越大。在Ti3C2O2MXene 表面的蛋白质均方根位移值大于在Ti3C2(COOH)2MXene、Ti3C2(OH)2MXene 表面的蛋白质均方根位移值,说明材料亲水性越好,蛋白质的结构变化越小。Ti3C2(COOH)(OH)3MXene 表面的蛋白质均方根位移与Ti3C2O2MXene 表面的蛋白质均方根位移相当,可能是由于羟基和羧基之间的竞争效应导致亲水性下降,蛋白质的结构变化变大。总的来看,蛋白质在水中的均方根位移与在Ti3C2TxMXene 表面的均方根位移相比变化不大,表明Ti3C2TxMXene 对蛋白质的结构影响很小。
图3 为4 种蛋白质在5 种Ti3C2TxMXene 表面的均方根波动(RMSF)数值。

图3 蛋白质在Ti3C2Tx MXene 表面的均方根波动值Fig.3 RMSF of proteins on surface of Ti3C2Tx MXenes
由图3 可知,均方根波动越小,原子的自由程度越小,说明Ti3C2TxMXene 亲水性越好,蛋白质结构受到的影响越小。此外,蛋白质中的原子在Ti3C2TxMXene 表面的波动幅度和其在水溶液中的波动幅度近似相等,原因是Ti3C2TxMXene 改变了蛋白质周围的水化层结构,从而减小了蛋白质的骨架结构变化[22]。
2.3 回旋半径和偶极矩分析
回旋半径是蛋白质结构密实度的表征,通常用来定量地反映蛋白质的整体尺寸变化。图4 为4 种蛋白质在5 种Ti3C2TxMXene 表面的回旋半径数值。
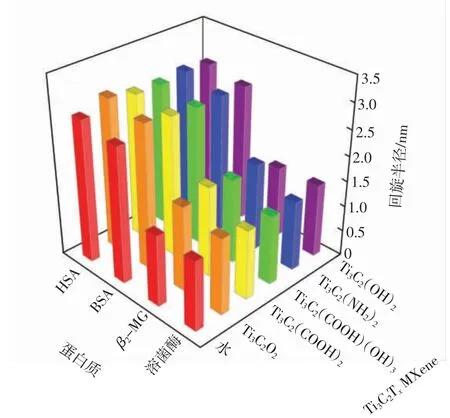
图4 蛋白质在Ti3C2Tx MXene 表面的回旋半径Fig.4 Radius of gyration of four proteins on surface of Ti3C2Tx MXene
由图4 可知,与水环境中的蛋白质回旋半径相比,Ti3C2TxMXene 表面的蛋白质回旋半径均略微增加0.1 nm 左右,而蛋白质的骨架结构基本保持不变(即均方根位移值没有发生较大的变化),表明蛋白质回旋半径的轻微改变并不影响蛋白质整体结构的完整性。
偶极矩可以作为表征了解蛋白质构象变化的标准。图5 为4 种蛋白质在5 种Ti3C2TxMXene 表面和水中的偶极矩数值。

图5 蛋白质在Ti3C2Tx MXene 表面的偶极矩Fig.5 Dipoles moment of proteins on surface of Ti3C2Tx MXenes
结合图5 和图3 可以看出,在Ti3C2TxMXene 表面的蛋白质偶极矩比在水溶液中的蛋白质偶极矩略大,原因之一在于Ti3C2TxMXene 的电荷与氨基酸之间的静电相互作用,使蛋白质内部的偶极矩变大。因此,在Ti3C2TxMXene 表面的蛋白质优势取向更明显。
2.4 Ti3C2Tx MXene 的抗蛋白质吸附机理
选取Ti3C2O2MXene 和BSA 作为典型体系,研究Ti3C2O2MXene 的抗蛋白质吸附机理。图6 所示为BSA和Ti3C2TxMXene 之间的质心距离随时间变化的情况。

图6 模拟过程中BSA 与Ti3C2O2 MXene 的质心距离Fig.6 Centroid distance between BSA and Ti3C2O2MXene during simulation
由图6 可以看出,Ti3C2O2MXene 与BSA 的距离一直维持在3.5 nm 左右。由于蛋白质本身结构的稳定性和BSA 与Ti3C2O2MXene 之间的静电相互作用,导致它们之间的相互作用微弱。
图7 为Ti3C2O2MXene 表面的水化层图。为探究水和Ti3C2O2MXene 间的关系,将水分子和Ti3C2O2MXene放置于同一模拟空间。

图7 Ti3C2O2MXene 表面的水化层Fig.7 Hydration layer on Ti3C2O2MXene surface
由图7 可知,在Ti3C2O2MXene 表面形成了水层,原因是良好亲水性使得Ti3C2O2MXene 在水中有较大的载留面积和灵活的水分子调动能力,最终在表面形成了紧密的水层,阻止了蛋白质的靠近。此外,形成的水化层还弱化了Ti3C2O2MXene 与蛋白质的静电作用,导致其对蛋白质吸附能力的下降。由此可知,分子动力学模拟直观地解析了原子水平上的细节,即Ti3C2O2MXene 通过水化层的空间位阻效应减少了对蛋白质的吸附。
3 结论
采用分子动力学模拟的方法以蛋白质在水相里的动力学行为作为参考系,研究了Ti3C2O2、Ti3C2(COOH)(OH)3、Ti3C2(NH2)2、Ti3C2(COOH)2和Ti3C2(OH)2MXene 对水中的β2微球蛋白、人血清蛋白、牛血清蛋白和溶菌酶4 种蛋白质构象的影响。研究结果表明:
(1)蛋白质在Ti3C2TxMXene 的表面能保留天然构象。其中,Ti3C2(OH)2MXene 和Ti3C2(COOH)2MXene因其优异的亲水性,对蛋白质结构的影响最小。
(2)Ti3C2TxMXene 具有显著的抗蛋白吸附特性。
(3)分子动力学模拟为抗蛋白吸附实验的结果提供了最根本的解释,即Ti3C2TxMXene 会吸引水分子在表面形成水化层,从而阻止蛋白质接近其表面,减少了吸附量。

