老年非小细胞性肺癌胸腔镜解剖性肺切除术远期预后及危险因素分析
陈红星 董明都 徐玉生 马冬春
研究表明,2020年全球肺癌的新发病率占所有新发癌症患者病例数第2位,而肺癌新增死亡病例在所有癌症死亡病例数中占据首位[1]。非小细胞性肺癌(non-small cell lung cancer,NSCLC)是原发性肺癌中最为常见的类型,约占85%[2]。手术治疗仍然是早期肺癌的首选治疗方案[3-4],胸腔镜解剖性肺叶切除术加系统性淋巴结清扫已成早期肺癌诊治的标准术式,当前有研究表明解剖性肺段切除术对于选择良好的早期NSCLC患者的预后与肺叶切除术相当[5]。但部分研究认为肺段切除术的局部复发率可能高出肺叶切除术近一倍[6]。本研究通过研究胸腔镜下肺段切除术和肺叶切除术对比老年NSCLC患者的3年总体生存率和无进展生存期,旨在探讨影响胸腔镜下解剖性肺切除术预后的危险因素,为手术方式选择提供参考。
资料与方法
一、一般资料
回顾性收集安徽省庐江县人民医院2015年1月至2019年6月间行胸腔镜下解剖性肺切除手术治疗的150例NSCLC患者临床资料,其中男性72例,女性78例。年龄60~81岁,平均(68.5±7.3)岁。分期标准为国际抗癌联盟第8版TNM分期标准[7],最终诊断结果依据2015年WHO肺癌病理分型标准[8]。纳入标准:①年龄≥60岁;②首次发现、首次治疗的单发肺结节;③肿瘤直径<4cm;④手术切缘距离≥2cm;⑤无局部及远处转移。排除标准:①术前行放、化疗等新辅助治疗者;②合并有心、肝、肾等其他器官严重疾病患者;③多原发灶者;④临床资料不完善者。
本研究所有病例均签署知情同意书,本研究经院伦理委员会批准通过(20210511)。
二、手术方法
所有患者入院后均完善相关检查,主要包括胸腹部CT平扫+增强,头颅MRI、腹部彩超、放射性核素骨扫描等了解原发病灶情况以及是否出现肝脏、脑部、肾上腺等部位转移。同时术前行支气管血管CT三维重建,模拟手术路径,明确需要切除的段支气管及其动、静脉等切除范围。肺叶组和肺段组均行单孔胸腔镜切除术。
1 肺叶切除术 患者健侧卧位于手术床,行气管插管及静脉吸入复合全身麻醉。 切口位于患侧腋中线或腋前线第4肋间隙或第5肋间隙,长约4.0 cm,逐层进胸,充分止血后放置切口保护套。根据术前定位的结节位置进行评估,对于结节位于肺叶外周并且缺乏术前病理学依据的患者,先行肺楔形切除术并行术中冰冻快速病理,病理结果提示为肺癌时则行胸腔镜下肺叶切除术+纵隔淋巴结清扫术。术中依次游离肺动脉、肺静脉及支气管,并依次进行离断。肺裂发育不佳者使用一次性切口闭合器沿着肺裂进行裁剪。患肺离体后清扫相关淋巴结。
2 肺段切除术 体位、麻醉同肺叶切除术。切口位于患侧腋中线或腋前线第4肋间隙或第5肋间隙,长约3.0 cm,切口放置保护套。首先依据术前CT三维重建的解剖结构依次离断靶区的段动脉、静脉和支气管。随后使用改良“膨胀萎陷法”将段间交界显示清晰,然后将内侧交界分离清晰,最后沿着外侧段间交界进行精准的裁剪与缝合[9-10]。两种手术方式均行淋巴结清扫术。
三、随访与观察
术后3个月开始门诊、住院或者电话随访,术后2年内每3个月随访一次,2年后每6个月随访一次,随访的内容主要包括血液肿瘤指标和胸部CT平扫,当出现可能阳性结果时进行规范性全身检查进行评估。生存时间定义为自患者术后开始至患者死亡或终止随访的时间。无进展生存时间定义为自患者术后开始至出现局部复发或者远处转移的时间。局部复发定义为同类型肿瘤出现在既往同一肺叶或者同侧胸腔不同肺叶内。远处转移定义为同一类型的肿瘤出现在对侧胸腔或者肺外其他器官中。肿瘤类型由病理及免疫组化确定。
四、统计学处理
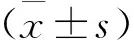
结 果
一、总体生存率和无进展生存率
所有患者均顺利完成手术及随访过程,肺段切除组随访时间为39.0(35.5,41.3)个月,肺叶切除组随访时间为38.5(36.0,42.4)个月。肺段切除组的总生存期和无进展生存期分别为(37.5±8.7)个月和(28.4±7.6)个月,而肺叶切除组总生存期和无进展生存期分别为(39.0±8.5)个月和(35.4±7.0)个月。
Kaplan-Meier曲线显示肺段切除组患者3年生存率为93.5%(95%CI:87.3%~99.8%),肺叶切除组的3年生存率为95.5%(95%CI:91.0%~99.9%),经Log-rank检验显示两组患者3年生存率差异无统计学意义(P=0.608)(见图1)。而两组患者无进展生存时间的差异有统计学意义(P=0.045)(见图2)。

图1 两组患者的总体生存曲线

图2 两组患者的无进展生存曲线
二、影响无进展生存期的单因素分析
随访过程中肺段切除组18例患者出现局部复发或远处转移,发生率为29.03%;而肺叶切除组5例患者出现局部复发或远处转移,发生率为5.68%。比较相关因素在无进展患者和复发/转移两组患者中的差异(见表1)。

表1 两组患者一般临床特征比较[(n(%)]
三、影响无进展生存期的多因素分析
应用Cox比例风险回归模型对单因素分析有意义的自变量(年龄、肿瘤大小、切除淋巴结数量、淋巴结阳性、手术方式)进行多因素分析,变量赋值方法(见表2)。 Cox回归模型采用基于偏最大似然估计的向前法对肺癌胸腔镜解剖性切除无进展生存期的影响因素进行多变量分析,将影响无进展生存期的单因素分析中差异有显著意义的因素(P<0.05)纳入分析,结果显示年龄>75岁、肿瘤>2 cm、切除淋巴结数量少是影响无进展生存期的独立危险因素,相较于肺段切除,肺叶切除可延长无进展生存期(见表3)。

表2 影响肺癌胸腔镜切除术无进展生存期相关因素的赋值

表3 影响肺癌胸腔镜切除的无进展生存期Cox回归分析
讨 论
随着胸腔镜技术地普及推广,胸腔镜下肺叶切除术已成为早期肺癌尤其是Ⅰ期NSCLC的标准术式,但对于一些年龄较大、肺功能储备较差的患者而言,肺叶切除术仍存在一定的争议[11]。肺段切除术和肺叶切除术同属于解剖性切除,目前研究认为对于一些病灶较小的肺部肿瘤,两者临床治疗效果基本相同[12]。本研究结果显示肺段切除术和肺叶切除术的3年总体生存率无显著差异(P=0.608),而无进展生存期方面,肺叶切除术明显优于肺段切除术(P=0.045)。本研究结果与汤井双等[13]研究报道有所区别,该研究认为对于早期肺癌而言,肺段切除术和肺叶切除术术后3年总体生存率以及无进展生存时间均无显著差异。进一步分析原因,考虑到可能与病例选择有关,上述文献报道的研究病例均为肿瘤直径≤2 cm的患者,本研究中部分患者肿瘤直径在2~4 cm之间,较大瘤体直径可能增加了肺段切除术中肿瘤切除与淋巴清扫的难度,从而导致患者肺段切除术后无进展生存时间短于肺叶切除术。
本研究还通过Cox比例风险回归分析得出年龄>75岁、肿瘤直径>2 cm以及切除淋巴结数量≤3个是影响早期NSCLC患者解剖性切除术后无进展生存时间的独立危险因素。年龄较大的患者通常对手术的耐受性较差,尤其是肺段切除术需要的手术时间更长[12],增加手术的操作难度。Stiles等[14]通过对SEER数据库进行大样本的回顾性分析,发现对于年龄≥66岁的患者而言,行肺段切除术后的NSCLC患者的肿瘤特异性死亡和全因死亡率明显高于肺叶切除术患者。肿瘤直径同样影响着NSCLC患者的预后,通常认为对于较小的肿瘤,肺段切除术和肺叶切除术均有着较好的无进展生存时间。Moon等[15]研究显示,当肿瘤直径≤2 cm时,两种手术方式的无进展生存时间无显著差异(P>0.05),而Ijsseldijk等[16]的一项荟萃分析同样表明,对于T1aN0M0期NSCLC患者,两种手术方式的无进展生存时间是无差异的。而一项基于SEER数据库的成人NASCL患者术后资料研究分析,显示当瘤体直径在3~4cm时,肺叶切除术有着更好的无进展生存时间[17]。切除淋巴结数量较少同样是影响无进展生存期的独立危险因素,与Yendamuri等[18]研究结果相同,其原因可能是因为当区域淋巴结切除的较少,可能导致潜在的阳性淋巴结未能切除,而这些未切除的阳性淋巴结则导致肺癌的局部复发或远处转移,进而使得无进展生存时间缩短。
本研究尚有一定的局限性,除了作为单中心回顾性研究固有的样本量小、选择性偏倚等缺点外,重要的一点就是未能探讨病灶位置对手术方式选择的影响,进而影响到患者的预后。目前,美国国家综合癌症网络(NCCN)指南和欧洲胸外科医师学会(ESTS)指南[19]认为病灶位于肺部较深位置时,行肺段切除术可能会涉及更多的解剖单元,很难获得充分的切缘,选择肺段切除术的指征之一就是病灶位于肺实质外周三分之一区域。因此,胸外科医师应充分利用CT三维重建技术[20]甚至联合3D模型打印技术[21]术前对肺部肿瘤进行精准定位,评估其与邻近组织的关系,从而指导手术方式选择。
总之,肺段切除术和肺叶切除术对早期NSCLC均有着较好的预后,但肺叶切除术的无进展生存时间明显优于肺段切除术,而年龄、肿瘤大小以及切除的淋巴结数量均能独立影响早期NSCLC患者解剖性切除术后的无进展生存时间。

