基于生物信息学分析肾透明细胞癌中植物同源结构域指蛋白6的表达及临床意义△
于建宇,方爱钟,郑义,于春娜,彭怡琛,林艺,汪晓敏#,李文斌,#
1首都医科大学附属北京天坛医院神经肿瘤综合治疗病区,北京 100071
2首都医科大学健康医疗大数据国家研究院,北京 100069
肾细胞癌是全球常见的恶性肿瘤之一,其中最常见的亚型是肾透明细胞癌(renal clear cell carcinoma,KIRC),占所有肾细胞癌类型的70%~80%[1-2],是一种恶性程度相对较低、发展缓慢的肿瘤。手术是KIRC 的主要治疗手段,但大多数情况下,即使进行了早期手术治疗,仍有30%转移的可能[3-6]。KIRC 已被证明与免疫微环境[7]、广泛的肿瘤特异性遗传和表观遗传学改变有关[8],这些改变可导致许多肿瘤相关基因表达水平的改变。因此,迫切需要对KIRC 的敏感基因进行研究,以寻找有效的治疗靶点及预后的分子标志物,进而有助于早期诊断,并为KIRC 早期干预提供依据。
植物同源结构域指蛋白6(plant homeodomain finger protein 6,PHF6)定位于人染色体Xq26.3,是一种核仁、核糖体RNA 启动子相关蛋白,该蛋白具有2 个植物同源结构域[9],定位于细胞核中,并在脊椎动物中高度保守[10]。PHF6 表达异常与肿瘤发生发展相关,研究表明,PHF6编码核仁和染色质相关的白血病抑制因子,其表达缺失会导致染色质可及性及核小体定位的局灶性变化[11],PHF6 表达缺失极大地损害了G2期细胞检查点的恢复[12]。随着基因研究的不断深入,PHF6 在血液病中的作用,特别是对血液肿瘤的抑制作用也逐渐受到关注[13],并取得了一定的成果。但目前临床对KIRC 与PHF6 间的关系知之甚少。
本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中KIRC 患者的临床特征及RNA-seq 高通量测序信息,分析PHF6在KIRC 中的表达及与患者预后的关系,从而分析PHF6表达与KIRC 间的关系,并通过免疫组化法进一步验证PHF6的表达与肿瘤相关基因间的关系,现报道如下。
1 资料与方法
1.1 数据来源及处理
从TCGA 数据库(https://www.cancer.gov/ccg/research/genome-sequencing/tcga)下载535 例KIRC组织及72 例正常肾组织的数据及患者的病历资料;从基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库(https://commonfund.nih.gov/gtex)下载28 例正常肾组织的数据及患者的病历资料。由于部分数据有缺失,共统计到535 例KIRC患者的部分临床特征、100 例正常肾组织和535 例KIRC 组织的RNA-seq 数据、535 例KIRC 患者的总生存期(overall survival,OS)、532 例KIRC 患者的无进展生存期(progression-free survival,PFS)、530例KIRC 患者的疾病特异性生存期(disease-specific survival,DSS)资料。此外,自上海超芯生物科技有限公司购买KIRC 组织及癌旁组织共150 个微阵列的石蜡切片,由于部分矩阵的病历资料缺失,共统计到146 个微阵列的年龄和性别、148 个微阵列的组织学分级和临床分期的资料。
首先比较TCGA 数据库下载的72 例正常肾组织与535 例KIRC 组织中的PHF6表达情况;再加上GTEx 数据库下载的28 例正常肾组织,比较100例正常肾组织与535 例KIRC 组织中PHF6的表达情况,并比较不同临床特征KIRC 患者KIRC 组织中PHF6的表达情况。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评估PHF6表达对KIRC 的诊断价值。依据PHF6表达水平的中位数,将TCGA 数据库中535 例KIRC 患者分为PHF6高表达组和PHF6低表达组,采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验,比较两组患者的OS、PFS、DSS。
1.2 基因本位(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析
为探究PHF6调节KIRC 的可能的分子机制,依据PHF6表达水平的中位数,将TCGA 数据库中535 例KIRC 患者分为PHF6高表达组和PHF6低表达组,利用R 语言的“Limma”包对两组患者的所有基因进行差异分析,并将|Log Fold Change|>1 作为共同差异基因。采用DAVID 在线数据库(https://david.ncifcrf.gov)对上述共同差异基因进行GO 分析,并将共同差异基因中PHF6高表达组的基因提取出来进行KEGG 通路富集分析,通过R 语言的“ggplot2”包进行可视化。
1.3 免疫组化法验证组织微阵列中相关蛋白与PHF6 表达的相关性
选取KEGG 通路富集分析中的相关基因进行相关性分析,免疫组化法验证组织微阵列中相关蛋白与PHF6 表达的相关性。选取上海超芯生物科技有限公司购买的75 例KIRC 组织及癌旁组织(共150 个矩阵),经二甲苯及梯度乙醇脱水,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤3次,在微波炉内用柠檬酸盐修复15 min,冷却至室温后,TBST 洗涤3 次,免疫组化笔圈出组织,过氧化物酶封闭15 min。滴加稀释后的山羊血清一抗,4 ℃孵育过夜,室温复温30 min,胰蛋白酶标记的羊抗鼠/兔免疫球蛋白G(immunoglobulin G,IgG)聚合酶孵育1 h,二氨基联苯胺(diaminobenzidine,DAB)显色15 min,苏木素复染15 min,1%酸性乙醇分化液分化2 s,返蓝2 min 后,梯度乙醇及二甲苯复水,封片,镜检。
判定标准:依据染色强度进行评分,无着色计1 分,浅黄色染色计2 分,黄色或深黄色染色计3分,细胞呈较深黄色且没有背景着色计4 分,细胞呈深黄色且没有背景着色计5 分;依据阳性细胞所占比例评分,<5%计1 分,5%~24%计2 分,25%~49%计3 分,50%~75%计4 分,>75%计5 分。将染色强度评分和阳性细胞所占比例评分相乘,1~4 分为阴性,5~8 分为弱阳性,9~12 分为阳性,13~25 分为强阳性;其中1~8 分为低表达,9~25 分为高表达。
1.4 统计学方法
使用R 语言和SPSS 16.0 对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验。采用Kaplan-Meier 法评估PHF6高表达组与PHF6低表达组KIRC 患者的生存差异,组间比较采用Log-rank 检验;绘制ROC 曲线,计算AUC,评估PHF6表达对KIRC 的诊断价值。采用R 语言中的cor 函数计算相关系数r,验证组织微阵列中相关蛋白与PHF6 表达的相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 正常肾组织和KIRC 组织中PHF6 表达情况的比较
TCGA 数据库中,正常肾组织中PHF6的相对表达量为(2.434±0.051),明显高于KIRC 组织的(2.011±0.018),差异有统计学意义(t=8.215,P<0.01)。TCGA 和GTEx 数据库中,正常肾组织中PHF6的相对表达量为(2.352±0.482),明显高于KIRC 组织的(2.011±0.018),差异有统计学意义(t=7.417,P<0.01)。
2.2 TCGA 数据库中不同临床特征KIRC 患者KIRC 组织中PHF6 表达情况的比较
TCGA 数据库中,不同年龄、性别KIRC 患者KIRC 组织中PHF6表达情况比较,差异均无统计学意义(P>0.05)。不同临床分期、组织学分级、肿瘤状态KIRC 患者KIRC 组织中PHF6表达情况比较,差异均有统计学意义(P<0.05),其中术后无新发肿瘤患者的PHF6高表达率高于术后新发肿瘤患者,且随临床分期、组织学分级升高,PHF6高表达率逐渐降低。(表1)
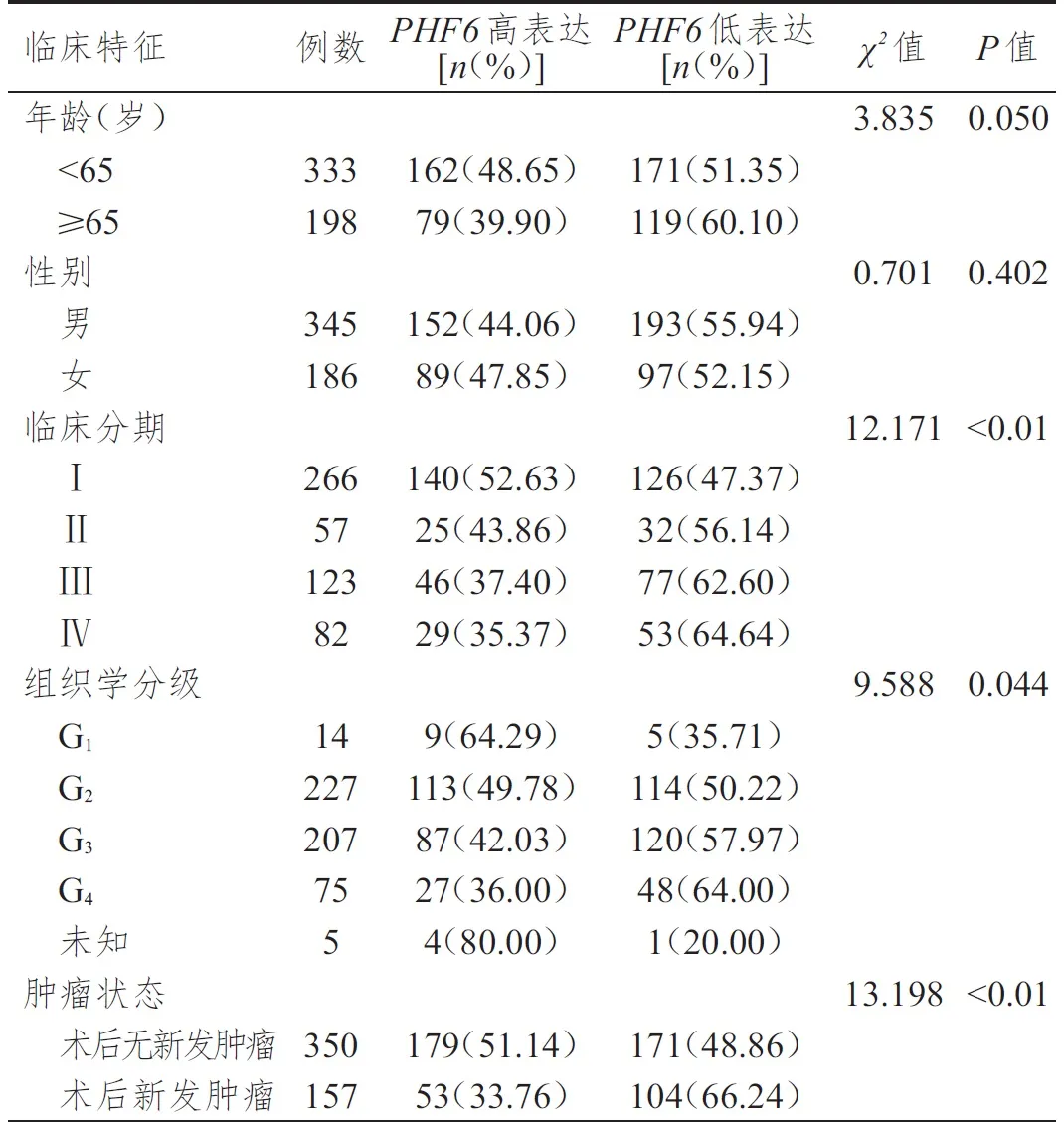
表1 TCGA 数据库中不同临床特征KIRC 患者KIRC 组织中PHF6 表达情况的比较
2.3 组织微阵列中不同临床特征KIRC 患者KIRC组织中PHF6 表达情况的比较
组织微阵列中,不同年龄、性别、组织学分级情况KIRC 患者KIRC 组织中PHF6 表达情况比较,差异均无统计学意义(P>0.05)。不同临床分期KIRC 患者KIRC 组织中PHF6 表达情况比较,差异有统计学意义(P<0.05)。(表2)
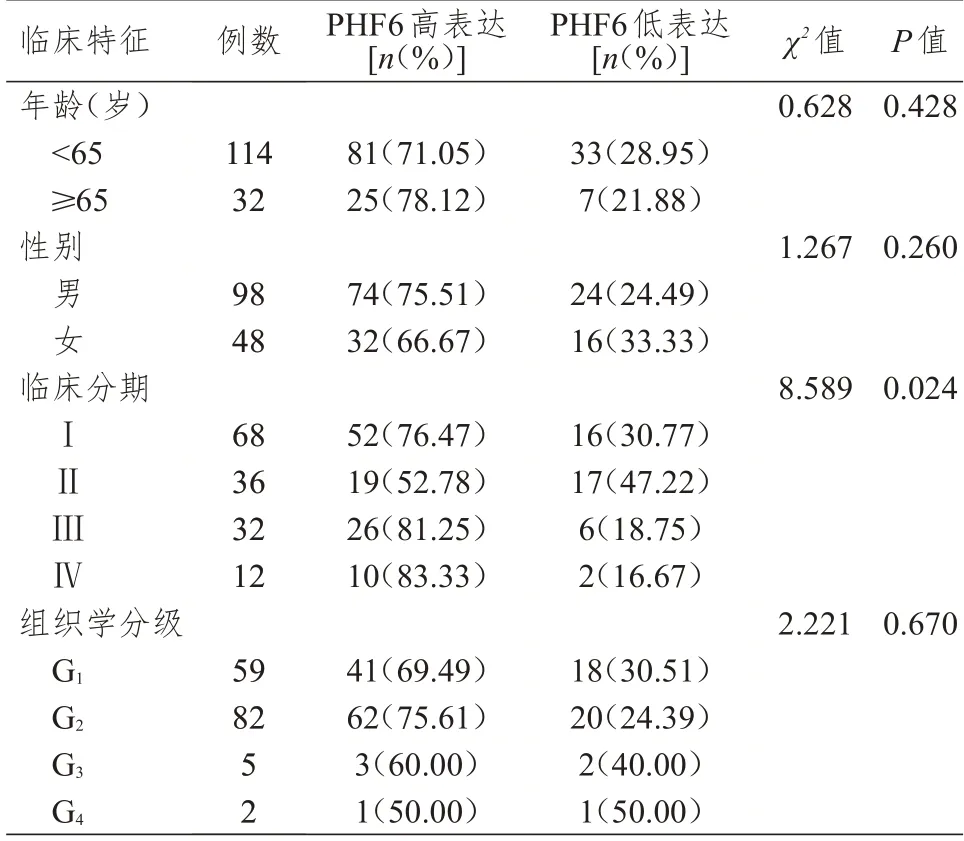
表2 组织微阵列中不同临床特征KIRC 患者KIRC 组织中PHF6 表达情况的比较
2.4 PHF6 表达水平对KIRC 的诊断价值
ROC 曲线显示,KIRC 组织中PHF6表达水平诊断KIRC 的AUC 为0.730(95%CI:0.672~0.782),灵敏度为77.80%,特异度为58.90%。(图1)
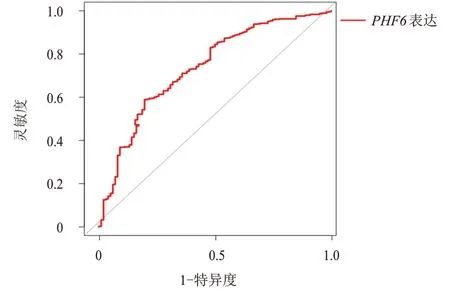
图1 PHF6表达诊断KIRC的ROC曲线
2.5 预后情况的比较
依据PHF6表达水平的中位数,将TCGA 数据库中KIRC 患者分为PHF6高表达组和PHF6低表达组,Kaplan-Meier 法评估不同PHF6表达情况KIRC 患者生存情况的差异,结果显示,PHF6高表达组患者的中位OS、PFS、DSS 均长于PHF6低表达组,差异均有统计学意义(P<0.05)。(图2~图4)
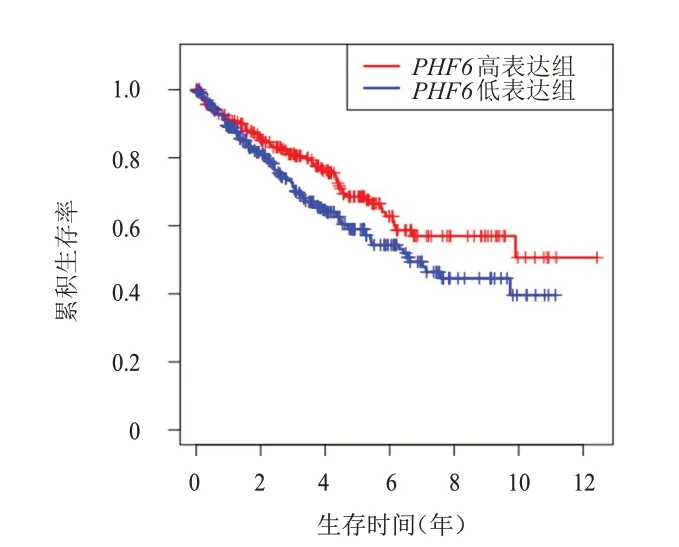
图2 PHF6高表达组(n=268)与PHF6低表达组(n=267)KIRC患者的OS曲线
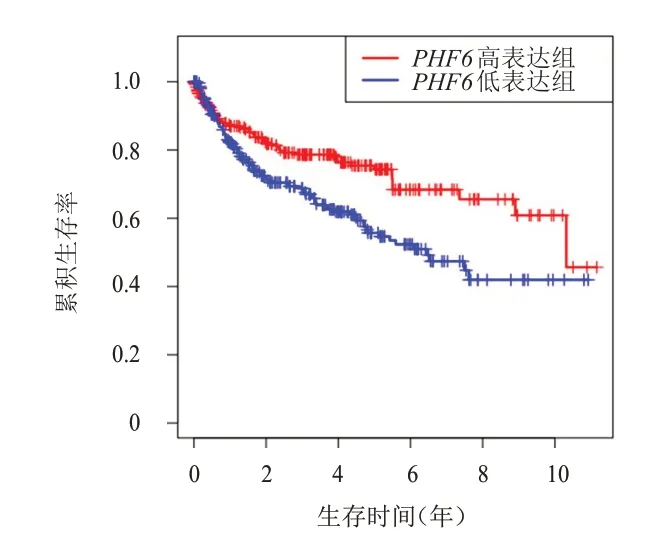
图3 PHF6高表达组(n=266)和PHF6低表达组(n=266)KIRC患者的PFS曲线
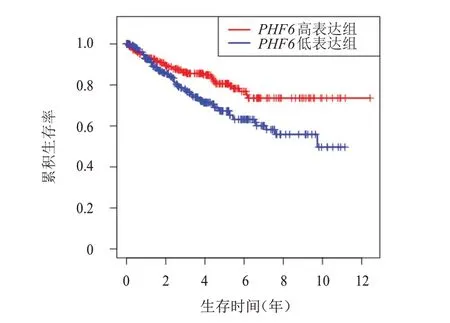
图4 PHF6高表达组(n=265)和PHF6低表达组(n=265)KIRC患者的DSS曲线
2.6 GO 分析和KEGG 通路富集分析
为研究PHF6参与KIRC 发生发展的可能分子机制,对TCGA 数据库中PHF6高表达组和PHF6低表达组KIRC 患者的基因进行分析,结果共筛选出750 个差异基因,其中300 个相对PHF6表达上调,450 个相对PHF6表达下调。GO 分析结果显示,差异基因的生物过程主要集中于体液免疫应答、补体激活和B 细胞介导的免疫上,细胞成分主要集中于免疫球蛋白复合物、含胶原蛋白的细胞外基质、细胞的顶端部分和血液微粒上,分子功能主要集中于抗原结合、糖胺聚糖结合和硫化合物结合上。将共同差异基因中PHF6高表达组的基因提取出来进行KEGG 通路富集分析,结果显示,PHF6高表达的KEGG 通路主要集中于胆固醇代谢、白细胞介素-17 信号通路和类固醇激素生物合成中,表明PHF6可能通过生物代谢与合成、炎症反应影响免疫调节与应答,调节KIRC 的发展进程。(图5、图6)
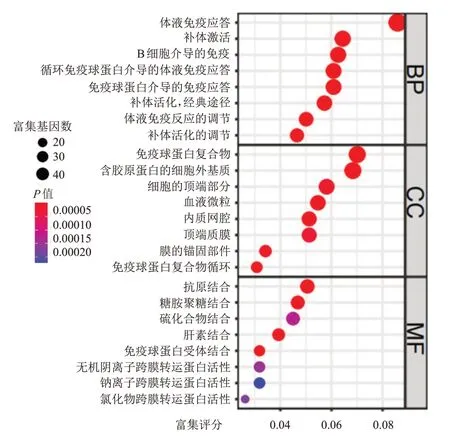
图5 差异基因的GO分析
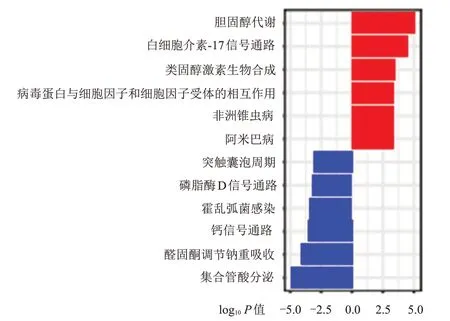
图6 差异基因的KEGG富集分析
2.7 免疫组化法验证组织微阵列中相关蛋白与PHF6 表达的相关性
选取KEGG 免疫相关的信号通路中参与KIRC发生发展的基因,探讨其与PHF6表达的相关性,从而进一步推断PHF6在KIRC 中的作用。参与肿瘤调节的基因如肌醇1,4,5-三磷酸2 型受体(inositol 1,4,5-triphosphate receptor type 2,ITPR2)(是促进细胞衰老、减少细胞增殖的基因)、磷脂酶A2组ⅣA(phospholipase A2 group ⅣA,PLA2G4A)(是介导溶酶体损伤的基因)、前列腺素F 受体(prostaglandin F receptor,PTGFR)(是抗血管生成的基因)、核糖体蛋白S6 激酶A6(ribosomal protein S6 kinase A6,RSK4)(是抑癌基因),均与PHF6的表达呈正相关(r=0.52、0.34、0.50、0.42,P<0.01)。表明PHF6与ITPR2、PLA2G4A、PTGFR、RSK4 在KIRC 中的作用相似,可以抑制KIRC 细胞的生长。
通过免疫组化法验证组织微阵列中RSK4 与PHF6 表达的相关性,由2 名研究者独立对染色后的组织微阵列中PHF6 蛋白和RSK4 蛋白的阳性细胞所占比例和染色强度进行综合评分,结果显示,RSK4 蛋白的表达与PHF6 蛋白的表达呈正相关(r=0.557,P<0.01),表明PHF6 蛋白可能通过调节RSK4 蛋白的表达抑制KIRC 细胞的生长。(图7)
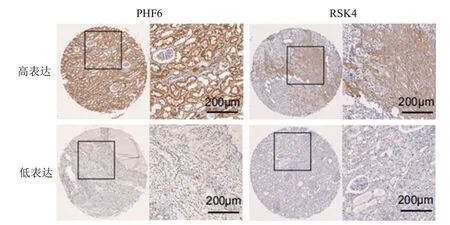
图7 组织微阵列中KIRC患者KIRC组织中PHF6与RSK4的表达情况(免疫组化染色,×10)
3 讨论
PHF6的表达水平对KIRC 患者的预后有重要意义。近年来,随着生物信息学技术的飞速发展,通过大数据分析某些或某类基因在疾病中的作用,可以为疾病的发生发展、治疗和预后评估等提供新思路。KIRC 与免疫微环境、肿瘤特异性遗传和表观遗传学改变有关,这些改变均可导致多个肿瘤相关基因表达水平的改变。目前,虽然已经开发了新的诊断手段提高KIRC 的诊断率,但由于KIRC 起病隐匿、肿瘤标志物较少,KIRC 患者的早期诊断效率仍较差[7];因此,为寻找新的早期诊断和预后评估的生物标志物,本研究对TCGA 数据库中KIRC 患者的病历资料和RNA-seq 数据进行了分析。
本研究首先分析了TCGA 数据库中KIRC 患者的临床特征,结果显示,PHF6表达水平与KIRC 患者的临床分期、组织学分级、肿瘤状态有关;且与正常肾组织相比,PHF6在KIRC 组织中表达下调。然后本研究绘制ROC 曲线推断PHF6表达水平对KIRC 的诊断效能,结果显示,PHF6表达水平诊断KIRC 的AUC 为0.730(95%CI:0.672~0.782),灵敏度为77.80%,特异度为58.90%。Kaplan-Meier分析发现,PHF6高表达组患者的中位OS、PFS、DSS 均长于PHF6低表达组患者,提示PHF6的表达水平可能对KIRC 患者的预后有指示作用。
目前,临床对PHF6 如何参与KIRC 的发生发展过程仍知之甚少,为进一步研究PHF6在KIRC中的生物学功能,本研究依据PHF6 表达水平的中位数,对PHF6高表达组和PHF6低表达组KIRC 患者的差异基因进行GO 分析,结果显示,PHF6表达与体液免疫应答、B 细胞受体信号通路、抗原结合和补体激活有关,提示PHF6基因主要富集在免疫相关通路上,且可能对免疫相关通路存在促进作用;将共同差异基因中PHF6高表达组的基因提取出来进行KEGG 富集分析显示,PHF6高表达的KEGG 通路主要集中于胆固醇代谢、白细胞介素-17 信号通路和类固醇激素生物合成中,表明PHF6可能通过生物代谢与合成、炎症反应影响免疫调节与应答,调节KIRC 的发展进程。有研究证实,T细胞的衰竭是导致KIRC 组织免疫抑制的关键因素,且与患者的不良预后有关[8]。既往研究证实,ITPR2对衰老和凋亡的触发有重要贡献[14];PLA2G4A的下调减弱了肿瘤细胞的上皮-间充质转化过程,抑制了肿瘤细胞的生长和转移[15-16];PTGFR甲基化改变可以将转录调控重新定位到肿瘤组织,从而抑制肿瘤进展[17];RSK4与多种肿瘤患者的生存期有关[18-19]。本研究选取上述基因与PHF6的表达水平进行相关性分析,并通过免疫组化方法验证组织微阵列中RSK4 的表达与PHF6 表达的关系,结果发现,TPR2、PLA2G4A、PTGFR和RSK4均与PHF6的表达水平呈正相关,且RSK4 蛋白的表达与PHF6 蛋白的表达呈正相关。
综上所述,与正常肾组织相比,PHF6 在KIRC组织中表达下调,PHF6 高表达KIRC 患者的预后较好,RSK4 的表达与PHF6的表达呈正相关。可以根据PHF6的表达水平,对KIRC 患者进行干预,有必要将其作为KIRC 的候选生物标志物。

