山樱花品种间花色差异的代谢组学研究
叶琦

摘 要:山樱花是世界著名的观花类植物,花色是其最重要的观赏特征。为探究影响山樱花品种间花色差异的代谢通路及关键代谢产物变化,该文利用LC-MS/MS技术对白色、绿色和粉色的山樱花品种进行花青素靶向代谢组学比较分析。结果表明:(1)共检测到42种花青素物质,主要包含矮牵牛素、飞燕草素、黄酮类化合物、锦葵色素、芍药花素、矢车菊素、天竺葵素和原花青素8种物质。(2)差异代谢花青素25种,包括11种下调、14种上调,其中有7种花青素在粉色花瓣中显著富集。(3)KEGG通路注释发现差异代谢物在花青素生物合成通路中显著富集,结合聚类结果发现矮牵牛素-3-O-葡萄糖苷是山樱花品种间花色差异产生的关键代谢物。该研究揭示了山樱花花色差异的代谢机理,为后续山樱花花色分子调控机制研究提供了一定的理论依据,也为新品种花色改良和选育提供了一定的科学参考。
关键词: 山樱花, 花色, 代谢组, 花青素, 代谢通路
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2023)04-0732-09
Abstract:Prunus serrulata is a famous ornamental plant worldwide. Flower color is the most prominent trait of cherry. In order to analyze the different pathways and key metabolite change in flower color among P. serrulata cultivars, we conducted a comparative analysis of anthocyanin metabolomics among white, green, and pinkP. serrulata cultivars using LC-MS/MS. The results were as follows: (1) A total of 42 anthocyanins were detected, mainly including petunidin, delphinidin, flavonoids, malvidin, peonidin, cyanidin, pelargonidin, and procyanidins. (2) A total of 25 anthocyanins were identified as differential metabolites, including 11 down-regulated and 14 up-regulated ones, in which seven anthocyanins with higher abundance in the pink flower. (3) KEGG pathway annotation showed that the differential metabolites were significantly enriched in the anthocyanin biosynthesis pathway; the results of clustering showed that petunidin-3-O-glucoside was the key metabolite for flower color differences ofP. serrulata cultivars. This study provides important insights into the metabolic mechanism offlower color differences in P. serrulata and a reference for novel color cultivars and variety breeding.
Key words: Prunus serrulata, flowering color, metabolome, anthocyanins, metabolic pathway
花色对植物具有重要的生物学意义,是园林景观中衡量树种价值的重要观赏性状,也是自然进化过程中有适应意义的表型(戴思兰和洪艳,2016)。李想等(2019)對植物花色成因分析后发现植物色素种类和含量是影响花色的主要因素。植物色素主要分为类黄酮、类胡萝卜素和生物碱三大类。其中,花青素(anthocyanin)属于类黄酮(flavonoids)化合物,是一类重要的植物次级代谢物,具有强抗氧化性和其他促进健康的功能(He & Giusti, 2010),是木本植物呈色多样性的重要原因。花青素主要分为7大类,包括芍药色素、矢车菊色素、飞燕草素、芍药色素、矮牵牛素和锦葵色素等。樱桃(Prunus pseudocerasus)(Guo et al., 2018)、玫瑰(Rosa rugosa)(Sheng et al., 2018)和血红杜鹃(Rhododendron sanguineum)(Ye et al., 2021)等物种的花色均被证实与花青素有关。Fiehn(2002)通过代谢物的动态变化趋势来明确代谢物与生理变化之间的对应关系。其中,靶向代谢组学基于已知的标准品检测,检测数据准确且可靠性高,被广泛应用于植物花色及花青素相关研究中(Yi et al., 2021)。Yue等(2019)通过代谢组学研究长筒石蒜花不同生长发育阶段花色形成的调控网络。Jiao等(2020)应用代谢组学来阐明烟草中粉花突变体的具体形成机制。近年来,有关花瓣的呈色机制一直是生物学研究的热点,植物色素种类和含量是颜色多样化的重要因素(Fu et al., 2021; Lu et al., 2021)。
山樱花(Prunus serrulata)是樱属植物在中国分布最广泛的种,在华中、华东、华北、华西和东北辽宁均有分布,朝鲜半岛和日本也有记录(Iwatsuki, 2001; Li & Bruce, 2003; 王贤荣,2014)。该物种对不同的地热条件适应性强,花朵为单瓣的白色或淡粉色(刘志雄等,2010)。山樱花各部分性状变化较大,花色变异丰富,是许多观赏类樱花品种杂交培育的亲本,也是非常重要的观花类种质资源(Yi et al., 2020)。Ma等(2009)以山樱花作为良好的亲本,开发和选育了多种天然和人工杂交品种,其种下栽培品种据统计中国共有45个(Yi et al., 2020)。目前,关于山樱花的研究主要集中在系统分类(Cho & Kim, 2019; Zhu et al., 2019)、亲缘地理(伊贤贵,2018)以及离体组织培养(李蒙,2013)等方面。花色是樱花的重要观赏性状,而关于山樱花品种花色变异相关的代谢途径及调控机制尚未见有人报道。
山樱花种系下的品种‘普贤象(Prunus serrulata ‘Albo-rosea)、‘郁金(P. serrulata ‘Grandiflora)和‘永源寺(P. serrulata ‘Eigeng)虽均为重瓣品种,但花色差异较大。朱淑霞(2020)通过SSR指纹图谱分析,证明3个品种在分子水平上有较近的亲缘关系。本文以粉花品种‘普贤象和绿花品种‘郁金为研究对象,以白花品种‘永源寺为对照,通过靶向代谢组学探究不同花色的差异呈色物质,拟探讨以下科学问题:(1)不同花色的山樱花品种主要包含的花青素类代谢物;(2)通过对品种间差异显著的代谢物及差异代谢通路进行筛选,分析品种间花色差异产生的可能原因。本研究结果可为后期樱花品种花色分子调控的相关研究提供一定的理论支持。
1 材料与方法
1.1 材料
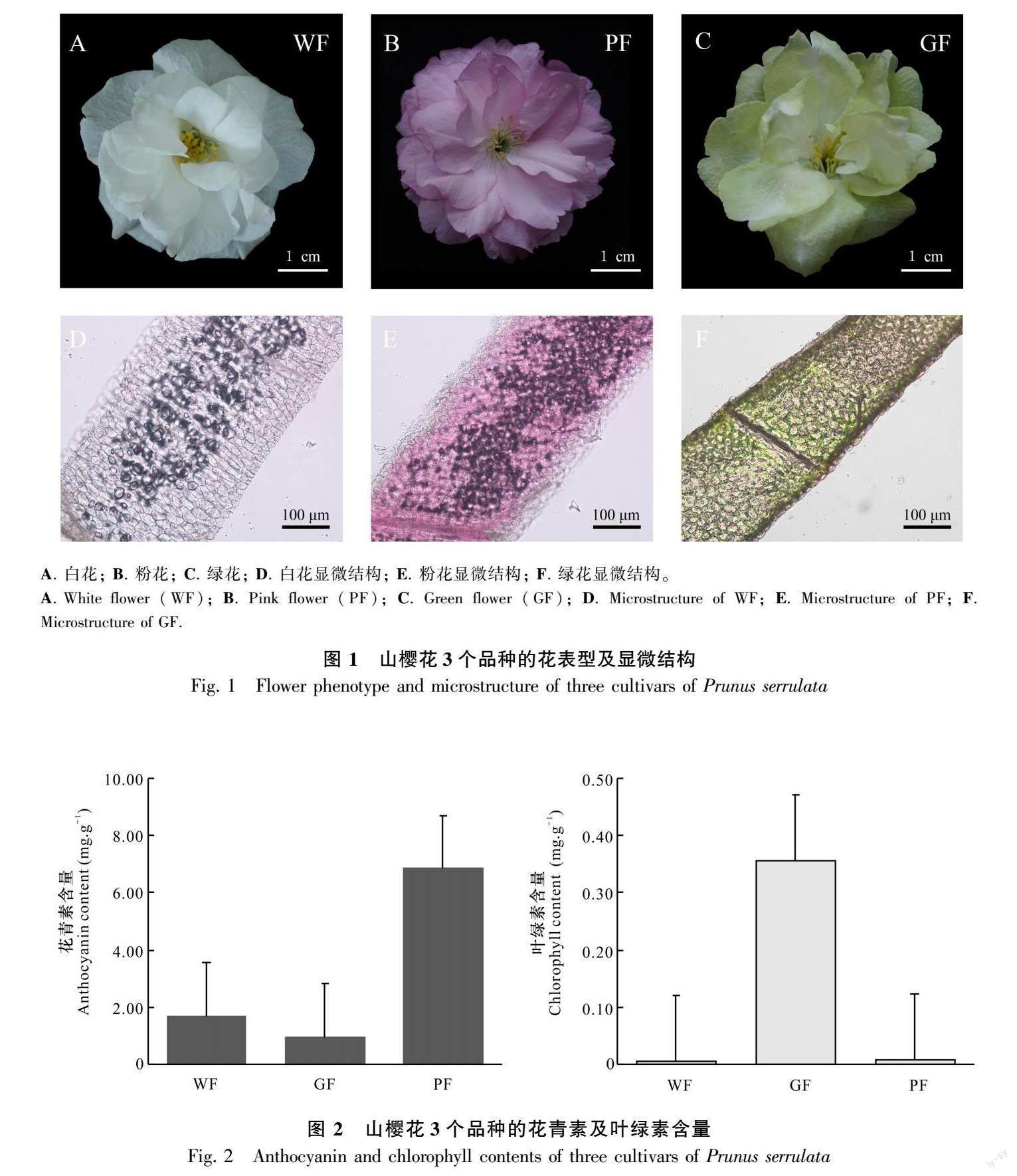
样品选定为白色樱花‘永源寺(Prunus serrulata ‘Eigeng, white flower, WF)、绿色樱花‘郁金(P. serrulata ‘Grandiflora, green flower, GF)和粉色樱花‘普贤象(P. serrulata ‘Albo-rosea, pink flower, PF)。花瓣材料采自安徽省全椒县龙山樱花园资源圃(118°02′82″ E、32°04′7741″ N)。参照李玉阔(2020)的方法取样,选择生长势一致,无病害管理统一的樱花树3棵(每个品种各1棵),在2021年3月采集盛花期的花瓣样品(图1)。样品采集时从树体东、西、南、北4个方位各采集5 g花瓣样品后混匀,每个品种采集3个生物学重复用于代谢组学测序分析。取样后将花瓣样品装入锡箔纸中并在液氮中处理30 min,随后放置于-80 ℃的冰箱保存,用于后续靶向代谢组学分析。
1.2 花瓣表型及生理指标分析
参考向秋虹(2019)的方法并略做修改,取3个品种的花瓣进行徒手切片观察。用单刀片切取花被片基部薄片置于超纯水中,夹取薄片放置于载玻片上制备成临时装片,在光学显微镜下观察花瓣表皮细胞色素分布情况。
叶绿素提取参考Li等(2021)的方法并略做修改,称取0.1 g鲜样,放入15 mL的95%乙醇中,黑暗避光条件下浸提过夜,直至材料全部退绿,得到叶绿素提取液。使用可见分光光度计测定提取液在663 nm和645 nm的波长下的吸光值。叶绿素含量计算公式:
叶绿素含量(mg·g-1)=Ca+Cb;Ca=13.95×A665-6.88×A649;Cb=24.96×A649-7.32×A665。
花青素提取参考Li等(2021)的方法并略作修改,称取0.1 g样品,加入600 μL的1% HCl-甲醇溶液(1%HCl,m/V)在4 ℃中提取2 h。之后加入400 μL蒸馏水和氯仿,12 000 g离心10 min,取上清液,测定A530和A657的吸光值。
花青素含量(mg·g-1)= C×提取总量/样品鲜重×1 000,式中C=A530-0.24×A657。
1.3 样品制备及代谢物提取
基于超高效液相色谱-串联质谱系统(UPLC-MS/MS)进行靶向代谢组学的研究。样品真空冷冻干燥,研磨成粉末(30 Hz, 1.5 min),-80 ℃保存。取50 mg粉末称重,用0.5 mL甲醇/水/盐酸(500∶500∶1,V/V/V)提取。随后将提取液涡旋5 min,超声5 min,在4 ℃下12 000 g离心3 min。在相同条件下重復上述步骤再次提取残渣。收集上清液,经微孔膜过滤器(0.22 μm,Anpel)过滤样品,后续使用LC-MS/MS(SCIEX,QTRAP 6500+)进行分析。混合标准溶液作为质控样本,每隔10个检测分析插入1个质控样本用于检测仪器稳定性。
1.4 靶向花青素代谢组测定
花青素提取基于Ferrars等(2014)的方法。数据采集仪器包括使用超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(tandem mass spectrometry,MS/MS)。液相条件:(1)ACQUITY BEH C18 1.7 μm,2.1 mm×100 mm的色谱柱;(2)流动A相为超纯水(0.1%甲酸);流动B相为甲醇(0.1%甲酸);(3)洗脱梯度设定为0~6 min 5% B相,6~12 min增至50%,12~14 min增至95%,保持2 min,14 min降至5%,平衡2 min;(4)流速0.35 mL每分钟;柱温40 ℃;进样量2 μL。质谱条件:电喷雾离子源(electrospray ionization,ESI)温度550 °C,正离子模式下质谱电压5 500 V,气帘气(curtain gas,CUR)35 psi。在Q-Trap 6500+中,每个离子对是根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测。
1.5 数据分析
基于标准品构建的MWDB(metware database)数据库,对质谱检测得到的数据进行定性分析。相对定量分析利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析,每个色谱峰的峰面积(area)代表对应物质的相对含量,代入线性方程和计算公式,采用MultiQuant 3.0.3软件,最终得到所有样本中待测物的定性定量分析结果。使用R(https://www.r-project.org/),对不同样本间代谢物的积累模式进行聚类分析(HCA)及主成分分析(PCA)。计算差异倍数值(fold_change)及P值,选取P值≤0.5的代谢物为差异代谢物,并将差异代谢物映射到KEGG数据库中进一步富集用于后续分析。计算公式:
代谢物含量(μg·g-1)= c×V/1 000 000/m。
式中:c为样本中积分峰面积代入标准曲线得到的浓度值(ng·mL-1);V为提取时所用溶液的体积(μL);m为称取的样本质量(g)。
2 结果与分析
2.1 花瓣表型及生理指标分析
永源寺、普贤象和郁金样品盛花期花瓣形态如图1所示,均为重瓣品种,花朵完全开展且表观色彩差异较大。通过20倍光学显微镜观察花瓣上表皮的显微结构,白色花瓣上表皮无明显色素沉积(图1:D);而粉色花瓣上表皮细胞呈现粉紫色(图1:E),可能是花青素的色素沉淀;绿色花瓣上表皮呈现绿色(图1:F)。进一步测定品种叶绿素含量后发现,郁金中的叶绿素含量远高于其他两个品种(图2), 郁金呈现绿色的主要原因是叶绿素沉积。这表明花青素在植物花色中起到关键性作用,结合已有的表型和生理指标,选定花青素进行下一步的靶向代谢组学检测。
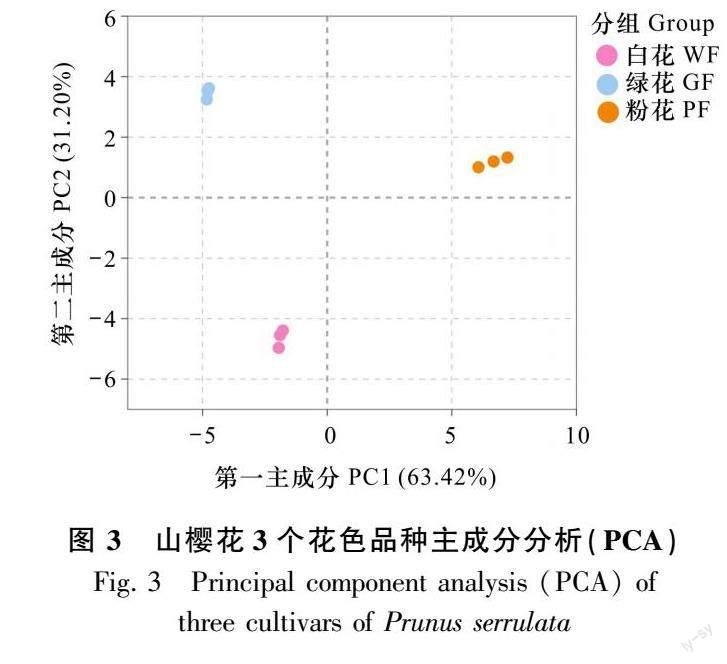
2.2 主成分分析 (principal component analysis,PCA)
图3结果表明,组间代谢物分离趋势明显且组内生物重复性好,与表型结果一致,可用于后续差异代谢物的分析。其中,在第一主成分(PC1)上,PF与其余两组发生明显分离,表明粉红色品种存在显著的差异代谢物。同时,在第二主成分(PC2)上,WF发生明显分离,表明WF与其他两组代谢表达谱差异大,可以作为对照组进行后续差异表达分析。
2.3 代谢物分析
为检测不同品种中花青素的变化规律,通过UPLC-MS平台靶向测定样品中的花青素,每组进行3次生物学重复,并对其进行定性定量分析。共检测到42种花青素化合物,其中包括7种矮牵牛素(petunidin)、6種飞燕草素(delphinidin)、6种黄酮类化合物(flavonoid)、1种锦葵色素(malvidin)、4种芍药花素(peonidin)、8种矢车菊素(cyanidin)、7种天竺葵素(pelargonidin)和3种原花青素(procyanidins)。对代谢物进行聚类(图4),显示出样品组内生物学重复性较好,表达趋势一致。组间整体分为3簇,其中簇1在PF中的表达量最高,簇2在GF中表达量最高,色块分布有显著差异,表明样品存在显著差异。
2.4 差异代谢物分析
基于P值≤0.5筛选差异花青素代谢物(different anthocyanin metabolites, DAMs),差异倍数(fold_change)表示样品间代谢物表达量的比值。WF和PF间存在25种DAMs(11种上调/14种下调),WF和GF间存在19种DAMs(8种上调/11种下调),GF和PF共有差异代谢物25种(11种上调/14种下调)。组间两两比较后,筛选出11种共有的DAMs(图5:A),分别是矢车菊素-3,5-O-二葡萄糖苷(cyanidin-3,5-O-diglucoside)、矢车菊素-3-O-阿拉伯糖苷(cyanidin-3-O-arabinoside)、矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside)、矢车菊素-3-O-芸香糖苷(cyanidin-3-O-rutinoside)、矢车菊素-3-O-桑布双糖苷(cyanidin-3-O-sambubioside)、矢车菊素-3-O-木糖苷(cyanidin-3-O-xyloside)、天竺葵素-3-O-芸香糖苷(pelargonidin-3-O-rutinoside)、芍药花素-3-O-葡萄糖苷(peonidin-3-O-glucoside)、飞燕草素-3-O-半乳糖苷(delphi-nidin-3-O-galactoside)、飞燕草素-3-O-槐糖苷(delp-hinidin-3-O-sophoroside)和柚皮素(naringenin)。
结合具体样品的分组情况比较各组中代谢物定量信息发生的差异倍数变化,选取前20种代谢物绘制差异代谢条形图,由图5:B可知,在WF和PF的差异比较中,最显著上调的代谢物是天竺葵素-3-O-葡萄糖苷(pelargonidin-3-O-glucoside);在WF和GF的差异比较中,显著上调的代谢物为矮牵牛素-3-O-葡萄糖苷(petunidin-3-O-glucoside),两组的最显著下调的代谢物均为柚皮素(naringenin);在PF和GF的比较组中,显著上调的代谢物是矢车菊素-3-O-桑布双糖苷,显著下调的代谢物是矮牵牛素-3-O-葡萄糖苷,该代谢物在PF中显著上调,可能是花瓣呈现粉红色的重要差异代谢物。
2.5 代谢通路分析
利用KEGG 数据库对差异代谢物进行注释并展示。将筛选出的差异代谢物进一步映射到数据库中并绘制通路图(图6)。42种DAMs被注释到7个代谢通路上,分别是花青素生物合成(anthocyanin biosynthesis)、异类黄酮生物合成(isoflavonoid biosynthesis)、类黄酮生物合成(flavonoid biosynthesis)、黄酮和黄酮醇生物合成(flavone and flavonol biosynthesis)、次级代谢产物的生物合成(biosynthesis of secondary metabolites)、生物代谢(metabolic pathways)、苯丙烷生物合成(biosynthesis of phenylpropanoids)等通路。WF和PF组间有14种差异代谢物在花青素生物合成通路中显著富集(占比77.78%),WF/GF和PF/GF各有11种和13种DAMs在花青素生物合成通路中显著富集(占比91.6%和76.47%),从图6可以看出花青素类物质在粉花和绿花中合成显著上调,进一步证明了花青素在樱花花色的合成和积累中的重要作用。
3 讨论与结论
花青素含量差异对植物色泽有直接影响,本研究基于代谢组学技术,对山樱花不同品种花瓣中的花青素类物质进行了定性定量分析。研究表明,矢车菊素及其衍生物广泛作用于植物红色花瓣中(Khoo et al., 2017),Liu等(2016)对香雪兰花瓣中的花色苷进行测定后发现,红色系品种中的主要化合物为矢车菊素;同时杜鹃花属内30种不同花色的代谢物研究也表明,红色品种中矢车菊素的含量最高(Du et al., 2016)。本研究针对3个山樱花品种共检测到42种花青素类物质,其中WF、GF、PF分别检测出35、40、34种代谢物,在WF和GF中,均检测到了矢车菊素、天竺葵素和矮牵牛素等7大类花青素物质,PF中,未检测锦葵色素。在PF中,矢车菊素-3-O-芸香糖苷含量最高;在GF中,矮牵牛素-3-(6-O-p-对香豆酰)-葡萄糖苷 [petunidin-3-O-(6-O-p-coumaroyl)-glucoside]含量最高;而在粉色樱花品种中,矢车菊素含量最高,与前人在其他物种中的研究结果一致,表明矢车菊素在粉色花瓣呈色中起到重要作用。
为进一步探究山樱花不同花色形成的差异代谢物,本研究通过P值筛选得到11种关键差异代谢物,包含6种矢车菊素类物质,2种飞燕草类物质,1种天竺葵素和芍药色素;矢车菊类物质进一步通过甲基化形成了其衍生物矮牵牛素,矮牵牛素-3-O-葡萄糖苷更是在粉色花瓣中显著上调,可能是呈色的关键代谢物。Wang等(2021)在红花花色代谢机制的研究和Li等(2020)关于兰花花瓣呈色差异的研究中均发现该类色素在差异花色品种中显著上调,而紫花苜蓿白花品种的矮牵牛素呈现显著性下调的趋势(潘新怡,2021),证明该类色素在花色素合成过程中是一个重要的代谢分支,也证实本研究的代谢组学结果有一定的合理性。通过转录组学测序发现,植物中的PAL、CHS和CHI等相关结构基因的表达量会随着植物花色变化产生差异。其中,花青苷合成酶基因(ANS)是花青素合成途径下游的关键酶基因,虽然目前该基因在海棠(Malus spectabilis)(田佶等,2010)、草莓(Fragaria ananassa)(Almeida et al., 2007)和桃(Prunus persica)(Ye et al., 2017)等植物中成功分离,并證实其表达量高低是影响植物花色的重要因素,但尚未在山樱花品种中得到验证。不同物种间的色素调控机制和结构基因具有特异性,并且通路间存在相互影响及竞争关系,为探明山樱花品种的花青素类物质和下游结构基因之间的关联性,本研究后续仍需在分子层面进一步探索。
研究表明,花青素合成通路对植物花色的形成有重要作用,分析编码花青素合成的结构基因和转录因子是当下的研究热点(吴雪霞等,2018)。本研究基于KEGG注释共富集到7条关键代谢通路,其中花青素生物合成通路、类黄酮合成通路和次级代谢产物合成通路3条代谢通路相对富集。其中,大量代谢物显著富集在青素生物合成通路中,表明该通路可能在山樱花花色的调控中发挥重要作用。在此以前,李玉阔(2020)同样发现在软枣猕猴桃由绿转红的生物过程中,类黄酮生物合成通路变化差异最为显著,花青素类代谢物含量也在红色成熟果实中显著提升;针对山茶花不同花色品种进行色素种类及含量的测定后同样发现,花青素生物合成途径相关的矢车菊素和矮牵牛素的含量在红色品种中显著增加(Fu et al., 2021);赵君等(2021)发现,向日葵的紫色茎干矢车菊素含量远高于白色品种,本研究结论均和上述结论相一致,认为花青素合成途径在组织呈色中扮演了关键角色,同时该结论也和植物表型及生理研究结果相吻合。本研究初步探索了花青素在樱花花色中的代谢差异,在代谢层面进行了一些初步探索,而未对其他典型色素例如类黄酮进行测定,尚不明确影响樱花花色的具体分子机制,在之后的研究中需要进一步联合多组学联合研究樱花花色呈色机制。
本研究利用生理生化及靶向代谢组学技术检测山樱花花瓣进行代谢组分析,共检测到了42种花青素物质,其中鉴定出11种共有差异代谢物并在KEGG数据中注释,阐明了不同代谢物在花色变化中的表达趋势,全面解析了不同花色樱花品种形成的内在代调控机制,为后期樱花花色的分子层面调控提供了参考,并对樱花新品种选育提供了一定的理论基础。
参考文献:
ALMEIDA JRM, DAMICO E, PREUSS A, et al., 2007. Characterization of major enzymes and genes involved in flavonoid and proanthocyanidin biosynthesis during fruit development in strawberry (Fragaria × ananassa) [J]. Arch Biochem Biophys, 465(1): 61-71.
CHO MS, KIM SC, 2019. Multiple lines of evidence for independent origin of wild and cultivated flowering cherry (Prunus yedoensis) [J]. Front Plant Sci, 10:1555.
DAI SL, HONG Y, 2016. Molecular breeding for flower colors modification on ornamental plants based on the mechanism of anthocyanins biosynthesis and coloration [J]. Sci Agric Sin, 49(3): 529-542.[戴思兰, 洪艳, 2016. 基于花青素苷合成和呈色机理的观赏植物花色改良分子育种 [J]. 中国农业科学, 49(3): 529-542.]
DU H, LAI L, WANG F, et al., 2016. Characterization of flower colouration in 30 Rhododendron species via anthocyanin and flavonol identification and quantitative traits [J]. Plant Biol, 20(1): 121-129.
FIEHN O, 2002. Metabolomics-the link between genotypes and phenotypes [J]. Plant Mol Biol, 48(1-2): 155-171.
FU MY, YANG X, ZHENG JR, et al., 2021. Unraveling the regulatory mechanism of color diversity in Camellia japonica petals by integrative transcriptome and metabolome analysis [J]. Front Plant Sci, 12: 685136.
FERRARS RMD, CZANK C, SAHA S, et al., 2014. Methods for isolating, identifying, and quantifying anthocyanin metabolites in clinical samples [J]. Analyt Chem, 86(20): 10052-10058.
GUO X, WANG YT, ZHAI ZF, et al., 2018. Transcriptomic analysis of light-dependent anthocyanin accumulation in bicolored cherry fruits [J]. Plant Physiol Biochem, 130: 663-677.
HE J, GIUSTI MM, 2010. Anthocyanins: natural colorants with health-promoting properties [J]. Ann Rev Food Sci Technol, 1: 163-187.
IWATSUKI KBDE. 2001. Flora of Japan [M]. Beijing: Science Press.
JIAO FC, ZHAO L, WU XF, et al., 2020. Metabolome and transcriptome analyses of the molecular mechanisms of flower color mutation in tobacco [J]. BMC Genom, 21(1): 611.
KHOO HE, AZLAN A, TANG ST, et al., 2017. Anthocyanidins and anthocyanins: colored pigments as food, pharmaceutical ingredients, and the potential health benefits [J]. Food Nutr Res, 61(1): 1361779.
LI BJ, ZHENG BQ, WANG JY, et al., 2020. New insight into the molecular mechanism of colour differentiation among floral segments in orchids [J]. Comm Biol, 3(1): 1-13.
LI C, BRUCE B, 2003. Cerasus in flora of China [M]. Beijing: Science Press.
LI X, DUAN JJ, LUO XN, et al., 2019. Formation mechanism of different tree peony flower colors by anatomy and biochemistry [J]. J NE For Univ, 47(3): 38-43.[李想, 段晶晶, 羅小宁, 等, 2019. 依据理化性质分析牡丹花色形成的影响因素 [J]. 东北林业大学学报, 47(3): 38-43.]
LI X, LI Y, ZHAO MH, et al., 2021. Molecular and metabolic insights into anthocyanin biosynthesis for leaf color change in chokecherry (Padus virginiana) [J]. Int J Mol Sci, 22(19): 10697.
LI YK, 2020. Molecular mechanism of anthocyanin biosynthesis and regulation in Actinidia arguta [D]. Wuhan: Huazhong Agricultural University: 35-38.[李玉阔, 2020. 软枣猕猴桃果实花色苷合成与调控的分子机制[D]. 武汉: 华中农业大学: 35-38.]
LIU L, ZHANG LY, WANG SL, et al., 2016. Analysis of anthocyanins and flavonols in petals of 10 Rhododendron species from the Sygera Mountains in Southeast Tibet [J]. Plant Physiol Biochem, 104: 250-256.
LU JJ, ZHANG Q, LANG LX, et al., 2021. Integrated metabolome and transcriptome analysis of the anthocyanin biosynthetic pathway in relation to color mutation in miniature roses [J]. BMC Plant Biol, 21(1): 257.
LI M, 2013. Ecological characteristics and tissue culture of the high altitude population of Cerasus serrulata [D]. Nanjing: Nanjing Forestry University.[李蒙, 2013. 山樱花高海拔居群生态学特征及组织培养[D]. 南京: 南京林业大学.]
LIU ZX, MA XT, CHENG PJ, et al., 2010. Development of stamens and carpels in single and double flowers of Cerasus serrulata [J]. J Beijing For Univ, 32 (4): 86-91.[刘志雄, 马小婷, 程朋军, 等, 2010. 单瓣与重瓣樱花雌雄蕊发育的比较研究 [J]. 北京林业大学学报, 32(4): 86-91.]
MA HM, OLSEN R, POOLER M,et al., 2009. Evaluation of flowering cherry species, hybrids, and cultivars using simple sequence repeat markers [J]. J Am Soc Hortic Sci, 134(4): 435-444.
PAN XY, 2021. Identification of flower color synthesis related genes in alfalfa based on multi-omics [D]. Beijing: Chinese Academy of Agricultural Sciences.[潘新怡, 2021. 基于组学的紫花苜蓿花色相关基因的挖掘与鉴定[D]. 北京: 中国农业科学院.]
SHENG LX, XIA W, ZANG S, et al., 2018. Transcriptome-sequencing analyses reveal putative genes related to flower color variation in Chinese Rosa rugosa [J]. Acta Physiol Plant, 40: 62.
TIAN J, SHEN HX, ZHANG J, et al., 2010. Cloning of McANS gene in Malus crabapple and expression analysis in different cultivars [J]. Acta Hortic Sin, 37(6): 939-948.[田佶, 沈紅香, 张杰, 等, 2010. 苹果属观赏海棠McANS基因克隆与不同叶色品种间表达差异分析 [J]. 园艺学报, 37(6): 939-948.]
WANG R, REN CX, DONG S, et al., 2021. Integrated metabolomics and transcriptome analysis of flavonoid biosynthesis in safflower (Carthamus tinctorius L.) with different colors [J]. Front Plant Sci, 12:712038.
WANG XR, 2014. An illustrated monograph of cherry cultivars in China [M]. Beijing: Science Press.[王贤荣, 2014. 中国樱花品种图志 [M]. 北京: 科学出版社.]
WU XX, ZHANG AD, ZHU ZW, et al., 2018. Research on plants anthocyanin biosynthesis metabolic pathway and its regulator factors [J]. Acta Agric Shanghai, 34(4): 127-132.[吴雪霞, 张爱东, 朱宗文等, 2018. 植物花青素生物合成代谢途径及调控因子研究 [J]. 上海农业学报, 34(4): 127-132.]
XIANG QH, 2019. Transcriptome analysis of different floral colors in Xanthoceras sorbifolium and its phylogenetic analysis [D]. Beijing: Beijing Forestry University.[向秋虹, 2019. 文冠果(Xanthoceras sorbifolium)不同花色转录组测序分析与系统发育研究[D]. 北京: 北京林业大学.]
YE JB, XU F, WANG GY, et al., 2017. Molecular cloning and characterization of an anthocyanidin synthase gene in Prunus persica (L.) Batsch [J]. Not Bot Hortic Agrob, 45(1): 28-35.
YE LJ, MLLER M, LUO YH, et al., 2021. Differential expressions of anthocyanin synthesis genes underlie flower color divergence in a sympatric Rhododendron sanguineum complex [J]. BMC Plant Biol, 21(1): 204.
YI DB, ZHANG HN, LAI B, et al., 2021. Integrative analysis of the coloring mechanism of red longan pericarp through metabolome and transcriptome analyses [J]. J Agric Food Chem, 69(6): 1806-1815.
YI XG, YU XQ, CHEN J, et al., 2020. The genome of Chinese flowering cherry (Cerasus serrulata) provides new insights into Cerasus species [J]. Hortic Res, 7(1): 165.
YI XG, 2018. The variation and phylogeography of Cerasus serrulata Mill. populations [D]. Nanjing: Nanjing Forestry University.[伊賢贵, 2018. 山樱花种群变异及亲缘地理学研究[D]. 南京: 南京林业大学.]
YUE YZ, LIU JW, SHI TT, et al., 2019. Integrating transcriptomic and GC-MS metabolomic analysis to characterize color and aroma formation during tepal development in Lycoris longituba [J]. Plants (Basel), 8(3): 53.
ZHANG Z, TIAN CP, ZHANG Y, et al., 2020. Transcriptomic and metabolomic analysis provides insights into anthocyanin and procyanidin accumulation in pear [J]. BMC Plant Biol, 20(1): 129.
ZHAO J, XU JW, LIU JG, et al., 2021. Target metabolomic analysis of material composition using a pair of near isogenic lines with different floral colors in sunflower [J]. J Nanjing Agric Univ, 44(3): 437-446.[赵君, 徐剑文, 刘剑光, 等, 2021. 观赏向日葵不同花色物质组成的靶标代谢组学分析 [J]. 南京农业大学学报, 44(3): 437-446.]
ZHU H, YI XG, LI YF, et al., 2019. Phylogeography and population genetic structure of flowering cherry species Cerasus dielsiana in subtropical China [J]. Syst Biodivers, 17(6): 622-633.
ZHU SX, 2020. Fingerprinting of Cerasus cultivars based on morphology and SSR molecular markers [D]. Nanjing: Nanjing Forestry University.[朱淑霞, 2020. 基于形态学和SSR分子标记的樱属品种指纹图谱构建[D]. 南京: 南京林业大学.]
(责任编辑 李 莉 王登惠)

