GA3对NaCl胁迫下‘泡桐1201’幼苗生理代谢及离子吸收的影响
朱秀红 杨会焕 于宏 韩钰 任方方 茹广欣
摘 要:为探究赤霉素(GA3)对NaCl胁迫下‘泡桐1201幼苗生长的缓解效应及生理机制,该研究以‘泡桐1201幼苗为材料,设置不同的NaCl、GA3浓度,测定分析GA3缓解NaCl胁迫下泡桐幼苗的生理指标、光合指标及离子转运能力。结果表明:(1)150 mmol·L-1NaCl胁迫下泡桐幼苗的生长量显著下降(P<0.05),下降量超过50%;适宜浓度的外源GA3显著提高泡桐幼苗的株高、根长及生物量,400 mg·L-1的GA3处理干重较A0增加69.71%。(2)随着GA3浓度的增加,3种抗氧化酶(SOD、POD、CAT)活性显著提高,MDA含量显著降低,叶绿素含量、气体交换参数(Pn、Tr、Ci、Gs) 均增大,光合效率提高,各离子含量(K+、Ca2+、Mg2+)均呈先上升后下降的趋势;400 mg·L-1的GA3处理组叶片及根系中的Na+含量比A0分别降低了23.59%和11.92%。(3)相关性分析及PCA分析显示,各项指标之间存在相关性,不同浓度GA3处理幼苗的差异明显,当GA3浓度为400 mg·L-1时缓解效果最佳。综上认为,叶面喷施GA3能增强盐胁迫下‘泡桐1201幼苗的抗氧化能力,缓解因盐胁迫导致活性氧过多而引起的膜脂过氧化反应,促进植株光合作用和生物量的积累,减少植物对Na+的吸收促进营养离子的积累,以添加400 mg·L-1GA3更能提高‘泡桐1201幼苗的抗性。該研究结果为深入了解泡桐耐盐机理提供理论基础,也为泡桐在盐渍地开发利用提供科学依据。
关键词: ‘泡桐1201, NaCl胁迫, 赤霉素, 离子吸收, PCA分析
中图分类号:Q945.12
文献标识码:A
文章编号:1000-3142(2023)04-0688-11
Abstract:To explore the alleviation effect and physiological mechanism of gibberellin (GA3) on the growth of ‘Paulownia 1201 seedlings under NaCl stress, this study took ‘Paulownia 1201 seedlings as materials, different NaCl and GA3 concentrations were set to determine and analyze the physiological indexes, photosynthetic indexes and ion transport capacity of ‘Paulownia 1201 seedlings under NaCl stress alleviated by GA3. The results were as follows: (1) Under 150 mmol·L-1 NaCl stress, the growth of ‘Paulownia 1201 seedlings decreased significantly (P<0.05), which was more than 50%. The appropriate concentration of exogenous GA3 significantly increased the plant height, root length and biomass of ‘Paulownia 1201 seedling. The dry weight of 400 mg·L-1 GA3 treatment increased by 69.71% compared with A0. (2) With the increase of GA3 concentration, the activities of three antioxidant enzymes (SOD, POD, CAT) increased significantly; content of MDA decreased significantly; chlorophyll content and gas exchange parameters (Pn, Tr, Ci, Gs) were increased, and the photosynthetic efficiency increased; the contents of each ion (K+, Ca2+, Mg2+) increased first and then decreased. The Na+ contents in leaves and roots of 400 mg·L-1 GA3 treatment group decreased by 23.59% and 11.92% compared with A0. (3) Correlation analysis and PCA analysis showed that there was a correlation between each index, seedlings which treated with different concentrations of GA3had obvious differences, and the best alleviating effect was found when the concentration of GA3was 400 mg·L-1. In summary, foliar spraying GA3 can enhance the antioxidant capacity of ‘Paulownia 1201 seedlings under salt stress, alleviate the membrane lipid peroxidation reaction caused by the increase of reactive oxygen species under salt stress, promote the accumulation of photosynthesis and biomass of plants, reduce the absorption of Na+ by plants, promote the accumulation of nutrient ions, adding 400 mg·L-1 GA3can improve the resistance of ‘Paulownia 1201 seedlings best. This study provides a basis for further understanding of Paulownia salt tolerance mechanism identification, and also provides a scientific reference for the development and utilization of Paulownia in saline land.
Key words: ‘Paulownia 1201, NaCl stress, gibberellin, ion uptake, PCA analysis
在农林业的生产和生态环境保护中,土壤盐渍化问题日益严峻,全球已超过3.97亿hm2的土地受到土壤盐分的影响(张相锋等,2018)。盐胁迫环境会影响植物的正常生长,引起由植物体活性氧积累过量造成的氧化损伤,抑制植物的光合作用、离子吸收等生理过程,致使植物代谢紊乱甚至死亡(Shiraku et al., 2022; Balusamy et al., 2022)。更甚者,我国盐渍化土壤及次生盐渍化土壤面积仍在扩大(Li et al., 2022),预计到2050年,全球50%的耕地都会受到土壤盐渍化的影响(Nan et al., 2022)。因此,解决如何有效控制和利用好盐渍化土地的问题迫在眉睫(韦云飞等,2022)。
泡桐(Paulownia fortunei)是玄参科泡桐属落叶乔木,材质优良、用途广泛、适应性强,在耐盐碱方面有一定的优势,是我国重要的速生树种(朱秀红等,2021),在盐渍地开发利用中应用前景广阔。王孟筱等(2019)研究表明泡桐种子在盐浓度为5%时发芽率最高,耐盐能力最强。Wang等(2017)通过分析盐胁迫下二倍体泡桐和四倍体泡桐的差异表达基因,发现盐胁迫对二者均有一定影响,四倍体比二倍体更具耐盐性。Zhao等(2019)通过研究也得到类似结论。选育耐盐泡桐、提高泡桐耐盐性是降低盐渍地利用难度的方法之一,尽管泡桐耐盐性的研究已取得一些进展,但对外源物质提高泡桐耐盐性的研究鲜有报道,仍需加大力度。
赤霉素(GA3)是一种重要的植物促生长激素,参与调控植物种子萌发、根茎生长、花和果实发育等多个生理过程(王小菁等,2017)。近年来,添加外源物质来增强植物抗性已成为抗逆研究中的重要研究手段。有研究表明,适宜浓度的外源GA3能促进盐胁迫下植物的生长,通过调节渗透物质的积累以及水通道蛋白的表达提高水分利用效率,改善细胞质膜组分稳定,减少胞内Na+积累且促进植株对营养离子的吸收,增强植物耐盐性(Liu et al., 2017; Sarkaria & Chinna, 2021)。Guo等(2022)研究指出赤霉素可打破盐胁迫下豌豆种子非深层生理休眠,增加胚芽鞘和冠下节间伸长。高添樂等(2019)通过研究得出添加适宜浓度的GA3可调节玉米体内抗氧化相关酶活性,减少ROS的积累,同时通过缓解盐胁迫对光合器官的损伤,促进其光合色素的积累。尚娜等(2017)研究表明,160 mg·L-1的GA3预处理可维持番茄较高的干物质量,提升其果实品质。李宏归等(2022)研究发现,外源GA3通过提高娜塔栎幼苗叶绿素含量及光合速率,促进植物的光合作用进而减弱Na+对植株的负作用。迄今为止,基于外源GA3作用于泡桐盐胁迫的生理机制研究较少。为了进一步探讨外源GA3调控盐胁迫来增强植物耐受性,本研究以‘泡桐1201幼苗为对象,分析不同浓度的GA3对泡桐幼苗生理生化及营养离子吸收的影响,同时利用相关性分析及PCA分析对各项指标进行综合分析,主要探究:(1)不同浓度的GA3对盐胁迫下泡桐生长及生理代谢能力的影响;(2)外源GA3调控盐胁迫下植物离子吸收与耐受性的关系;(3)适宜盐胁迫下泡桐生长的GA3施用量。本研究为深入了解泡桐耐盐机理提供理论基础,也为利用植物改良盐渍土提供备选树种和科学依据。
1 材料与方法
1.1 试验材料
试验于2021年10月3日至2022年1月4日在河南农业大学林木遗传育种实验室进行。供试材料为河南农业大学科教园区(113°5′ E、34°86′ N)当年结实的‘泡桐1201种子,NaCl、GA3为分析纯,购于国药集团。挑选籽粒饱满、大小一致的泡桐种子,在1%NaClO溶液中浸泡30 s左右,用蒸馏水冲洗4~5次后放入培养皿中萌发,培养室的光照周期为8 h黑暗/16 h光照,光强为10 000 lx,昼夜温度23 ℃/18 ℃,相对湿度(50±10)%。7 d后选择发芽情况一致的种子移入1/2 Hoagland营养液水培容器中进行温室培养,营养液pH为6.5±0.5。每隔3 d更换一次营养液,15 d后换成Hoagland全营养液。幼苗转移至黑色玻璃瓶培养,用定植棉固定,培养至4叶期,即可开始试验处理。
1.2 试验设计
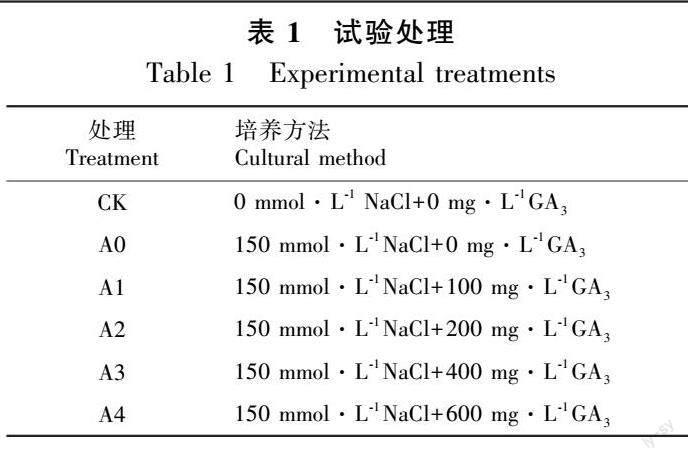
1.2.1 NaCl胁迫下泡桐幼苗生长试验 选择生长良好、长势一致的泡桐幼苗进行NaCl胁迫处理。NaCl胁迫设置 0、50、100、150、200 mmol·L-1共5个浓度梯度,每个浓度设置5棵幼苗作为重复。持续处理15 d后,测定幼苗的形态指标及生物量指标。
1.2.2 GA3缓解泡桐幼苗NaCl胁迫试验 根据前期泡桐盐胁迫试验结果,150 mmol·L-1NaCl可显著抑制泡桐幼苗的生长,但其仍可存活。因此,本研究选取150 mmol·L-1NaCl作为盐胁迫处理。挑选长势一致的泡桐幼苗设置6个处理,每个处理设置5个重复,均匀喷施不同浓度GA3溶液(0、100、200、400、600 mg·L-1)于叶片正反面,每隔5 d喷一次。采用喷施蒸馏水作为对照(CK),如表1所示,持续处理15 d后,进行各项指标测定。
1.3 测定指标与方法
1.3.1 生长指标和生理指标的测定 持续处理15 d后取样,用蒸馏水冲洗根部2~4次,用滤纸吸干幼苗表面水分,用直尺测定第一对叶最长和最宽的绝对长度以及幼苗的株高和根长。用分析天平称其鲜重后放入烘箱中,105 ℃下杀青30 min,75 ℃下烘干至恒重,测定其干重。
分别取植株的新鲜叶片、根系0.1 g,测定各项生理指标。氮蓝四唑(NBT)法测定SOD活性(Yin et al., 2019),愈创木酚法测定POD活性(Yin et al., 2019),双氧水法测定CAT活性(Yin et al., 2019),硫代巴比妥酸法测定MDA含量(张嘉雯等,2020),丙酮浸提法测定叶绿素含量(Yin et al., 2019)。处理15 d后测定光合参数,每个处理随机选取3株,在8:00—11:00使用便携式光合仪(Li-6400XT型)测定叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),大气CO2浓度(Ca)为400 μmol·mol-1,并计算出水分利用效率(water use efficiency, WUE) (WUE=Pn/Tr)和气孔限制值(limiting value of stomata,Ls) (Ls=1-Ci/Ca)。
1.3.2 离子含量测定 参照李岚涛等(2020)的方法,收集植株叶片和根部,并用去离子水冲洗干净,105 ℃下杀青30 min,75 ℃下烘干至恒重,粉碎研磨后,过30目筛后精确称取0.1 g,HNO3-HCl消解,用FAAS-M6原子吸收仪测定Na+、K+、Ca2+、Mg2+的含量。
1.4 数据分析
采用Excel 2019软件对原始数据进行整理与分析;采用SPSS 25.0软件进行单因素(one-way ANOVA)方差分析;采用Origin 2021软件进行相关性分析绘图,用Canoco 5软件进行主成分分析(principal component analysis, PCA)绘图。
2 结果与分析
2.1 NaCl胁迫下泡桐幼苗的生长情况
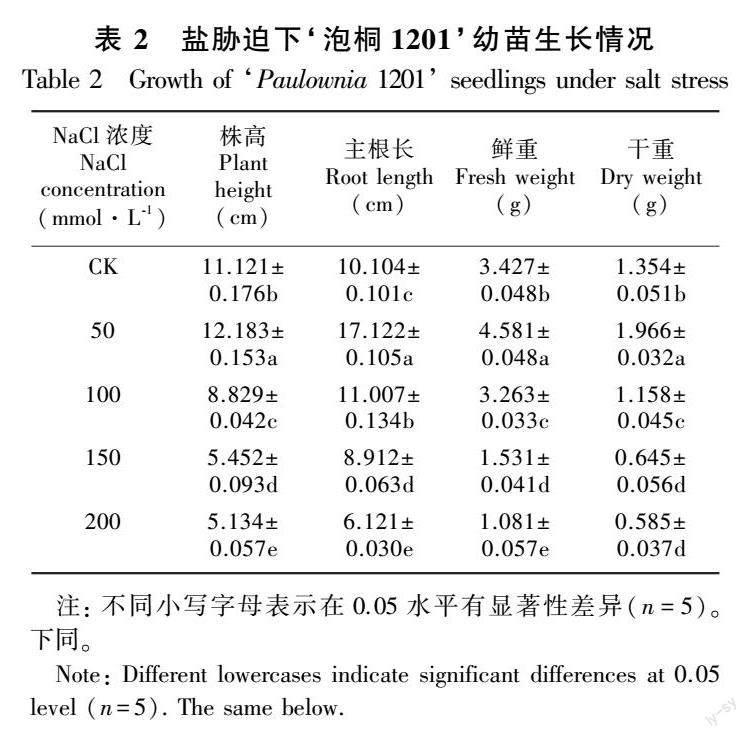
植物形态指标的变化直观反映出受胁迫的程度,不同浓度的NaCl对泡桐的生长影响总体表现为低促高抑(表2)。50 mmol·L-1NaCl处理下幼苗的主根长、鲜重和干重均达到最大值,与CK差异显著(P<0.05)。100、150、200 mmol·L-1 NaCl处理与CK相比,幼苗株高分别降低了20.61%、50.97%、53.84%,鲜重分别降低了4.79%、55.33%、68.46%,干重分别降低了14.48%、52.36%、56.79%。综上所述,当NaCl浓度为150 mmol·L-1时,幼苗的主根长显著降低且株高、鲜重、干重的降幅均超过50%,故将此浓度视为半致死浓度,选择该浓度为后期幼苗盐胁迫浓度。
2.2 外源GA3对NaCl胁迫下泡桐幼苗生理指标的影响
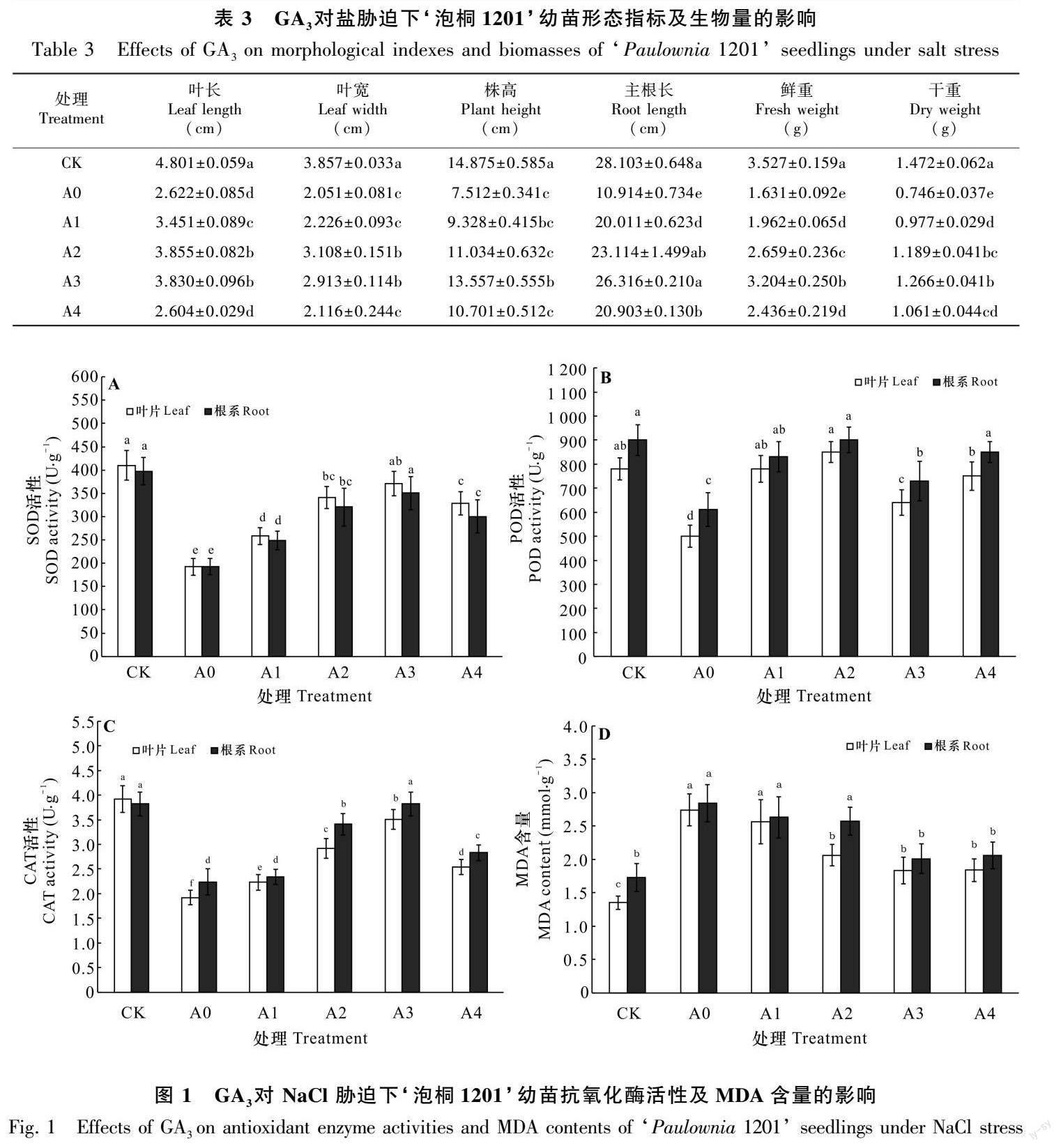
2.2.1 形态指标及生物量 NaCl胁迫下泡桐的生长量受抑显著(P<0.05),外源GA3处理能有效缓解NaCl对植株生长的抑制,缓解效应随GA3浓度的增大呈先升后降的趋势(表3)。与CK相比,A0处理下泡桐幼苗的各项指标显著降低,主根长受抑最明显,较CK降低了61.16%。与A0相比,A1-A4处理下干重分别增加了30.96%、59.38%、69.71%、42.23%,其中在A3處理增幅最大,株高、主根长和鲜重的变化趋势与干重基本保持一致,可以看出当GA3浓度较高时,对植株生长量的促进作用减弱。叶长、叶宽在A2处理增幅最大,分别较A0增加了47.03%和51.54%。推测GA3可能通过提高叶片的光合速率使光合产物增多,进而促进泡桐幼苗的干物质积累,提高幼苗抗盐性。
2.2.2 抗氧化酶活性及MDA含量 NaCl胁迫下泡桐抗氧化能力减弱,外源GA3减轻了NaCl对泡桐酶促系统的损伤(图1:A,B,C)。与CK相比,A0处理显著降低了泡桐幼苗叶片及根系中SOD、POD、CAT的活性(P<0.05)。与A0相比,A1-A4处理下3种抗氧化酶的活性均得到提升。A3处理下,叶片及根系的SOD、CAT均达最大值,SOD分别较A0增加了92.69%和82.10%,CAT分别较A0增加了82.81%和70.54%;A2处理下POD达最大值,叶片及根系POD分别较A0增加了69.99%和47.52%。叶片POD、CAT活性大于根系,而SOD活性则与之相反。在植物生长过程中,由于根系最先接触到盐分,因此根系受到高盐毒害大于叶片,喷施GA3显著缓解NaCl胁迫对泡桐幼苗抗氧化酶活性的抑制效应,维持植株体内氧自由基产生和清除动态平衡。
MDA能反映逆境下植物膜系统的受损程度。由图1:D可知,A0处理下泡桐幼苗叶片及根系MDA含量较CK显著增加(P<0.05),分别增加了102.96%和64.16%。A1-A4处理下,MDA含量随喷施GA3浓度不断提高而降低。A3处理下叶片MDA降幅最大,较A0下降了33.21%;根部MDA含量大于叶片。这说明外施GA3使泡桐体内的脂质过氧化产物MDA含量减少,减轻盐胁迫对细胞膜的损伤,从而提高泡桐幼苗的耐盐性。
2.2.3 叶片光合色素含量 叶片色素含量与植株的光合速率以及营养状况密切相关。如图2所示,A0处理下泡桐幼苗叶片的叶绿素a(Chla)、叶绿素b(Chlb)、叶绿素(a+b) [Chl(a+b)]、叶绿素(a/b) [Chl(a/b)]和类胡萝卜素(carotenoid, Caro)均显著低于CK(P<0.05),这说明高盐胁迫促使植物体内叶片色素降解,抑制植物体叶绿素的生成。在A1-A4处理下,随着GA3浓度的升高,Chla、Chl(a+b)、Chl(a/b)、Caro质量分数均呈先升后降的趋势,在A3处理下达到最高值,分别比A0增加了112.50%、90.83%、44.00%、56.00%,表明适宜浓度的GA3处理促进叶片色素在泡桐幼苗体内的积累, 使泡桐叶绿素维持在较高水平,为植株提供更多的养分支撑,改善光合性能;Chlb各组间变化差异较小,但各组处理均略大于A0,说明低浓度的GA3促进泡桐叶片Chlb的生成,高浓度的GA3可能对植株产生胁迫,进而影响Chlb的含量。
2.2.4 光合气体参数 光合气体参数可以反映植物叶片光合作用的过程变化。由表4可知,A0处理下,泡桐幼苗Pn、Tr、Ci、Gs、WUE分别较CK下降了33.91%、32.99%、40.96%、62.50%、1.34%,Ls显著提高300.00%(P<0.05),说明Na+对泡桐光
合作用的抑制主要是气孔限制型。经不同浓度GA3
处理后,A1-A4处理下除Ls外,各指标均呈先增大后减小的趋势,Pn、Ci、Gs、WUE在A3处理时达到最大值,分别较A0增加了60.93%、63.40%、133.33%、14.92%;Ls呈先降低后升高的趋势,在A3处理时降到最低值,与A0相比降低了69.17%。这说明喷施GA3显著降低盐害对泡桐光合作用的破坏,A3的缓解效果最好。
2.3 外源GA3对NaCl胁迫下泡桐幼苗离子吸收能力的影响
不同处理下泡桐幼苗的叶片、根系各离子(Na+、K+、Ca2+、Mg2+)含量差异显著(P<0.05)。由表5可知,与CK相比,A0泡桐幼苗叶片和根系组织的Na+含量均显著升高,K+、Ca2+和Mg2+ 显著下降,说明Na+在植株体内大量累积导致根系对营养离子的吸收减少。喷施GA3后,Na+含量随着GA3浓度的增大先降低后升高,A3处理中叶片和根系中的Na+达到最低值,与A0相比分别降低了23.59%和11.92%;K+、Ca2+和Mg2+含量随着GA3浓度的升高呈先升高后下降的趋势,叶片中K+和Ca2+的含量积累高于根系,说明GA3减少了Na+在泡桐中的积累和向地上部的运输,促进了叶片对K+和Ca2+的吸收。叶片和根系K+/Na+、Ca2+ /Na+、Mg2+ /Na+的比值在受到NaCl胁迫时均显著下降,随着GA3喷施浓度的升高,各比值先升高后降低,在A3处理达到最大值,说明GA3的参与降低了植株对Na+的吸收,改善了K+/Na+的动态平衡。
2.4 泡桐幼苗叶片各指标的相关性分析
不同处理下泡桐幼苗叶片各生理指标之间的相关性分析结果(图3)表明,泡桐叶片SOD与CAT、Tr、Ci、Gs,CAT与Chl(a+b)、Pn、Ci、Gs,Pn与Gs、K+/Na+,Mg2+/Na+与Gs呈极显著正相关(P<0.01);Chl(a+b)与SOD、Gs,Tr与POD、CAT,Mg2+/Na+与SOD、CAT、Ci呈显著正相关(P<0.05);MDA与Tr、Mg2+/Na+呈显著负相关(P<0.05),并与SOD、CAT、Chl(a+b)、Pn、Ci、K+/Na+达极显著负相关水平(P<0.01)。这说明施加GA3对泡桐幼苗生理特性的影响是多方面的,单独一个指标并不能很好地评价外源激素盐胁迫的缓解效应,只有综合多个指标才能更加全面客观地评价。
2.5 泡桐幼苗生长环境因子与生理指标的主成分分析
进一步将施加不同浓度的GA3对NaCl胁迫下泡桐幼苗的影响进行主成分(PCA)分析,结果如图4所示,主成分1(PC1)和主成分2(PC2)的贡献率分别是83.55%和10.97%,两者累计贡献率为94.52% (94.52%>80%)。PC1与Ls呈高度正相关,与Pn、Ci、WUE、根部SOD、根长呈高度负相关;PC2与Chl(a/b)呈高度正相关,与根部MDA呈高度负相关。因此,可以用这两个主成分来反映不同浓度GA3处理对泡桐幼苗的各生理指标的综合效果。并且,不同浓度处理分布的差异较大,A1、A2和A3主要分布在第二、第三象限,说明此浓度GA3的施加对NaCl胁迫下的泡桐幼苗缓解效果较好。A4主要分布在第一象限,说明此浓度GA3的施加对泡桐缓解的作用较差。Ls与Pn、根部POD、根长,叶片和根部的MDA与Chl(a/b) 、叶片Ca2+、根部Mg2+呈极显著负相关,这说明施加GA3有效地提高了泡桐幼苗的生长和抗氧化酶活性,减少了MDA的积累,促进了光合呼吸速率以及对营养离子的吸收,进而缓解盐胁迫对泡桐的毒害作用。此外,图中纵轴值越大,说明泡桐受胁迫的程度越小,GA3的缓解效果越好,反之亦然。因此,A3处理即GA3浓度为400 mg·L-1时的缓解效果最佳,这与前面的研究结果一致。
3 讨论与结论
3.1 NaCl及GA3对泡桐幼苗生理指标的影响
幼苗定植是植物生长的关键期,该进程直接影响幼苗后期的生长发育,植物在盐胁迫环境中会表现出种子发芽率低、幼苗叶片面积变小及根系生长受到抑制等特征(张相锋等,2018)。本研究中,盐胁迫使泡桐幼苗生长受到抑制,幼苗的株高、生物量等生长指标显著降低,当NaCl浓度为150 mmol·L-1时,泡桐的株高、鲜重、干重受抑程度均超过了50%。原因可能是高浓度的Na+使培养液渗透势增高,植物细胞吸水困难导致渗透失衡,植株因根系受损而对营养物质吸收减少、生长速率变慢(张相锋等,2018)。在盐胁迫下,外施GA3可以增强植物吸收营养的能力,进而促进种子萌发和幼苗生长(高添乐等,2019)。本研究结果表明,添加GA3促进了幼苗生长及生物量的累积且效果存在剂量效应。一方面,外源GA3能引发或促进某些基因表达,使植物内部水解酶的合成增加,受损的细胞膜得到修复,促使植物抵抗胁迫(尚娜等,2017);另一方面,外源GA3能影响植株的内源激素含量的变化,如提高内源赤霉素含量, 降低脱落酸含量, 通过调控内源激素含量的变化及比值平衡,从而影响幼苗生长(Guo et al., 2022)。
在植物酶促系统中,SOD、POD、CAT这3种抗氧化酶可以去除逆境负荷下植物产生的活性氧自由基,其活性的高低决定了植物对逆境的承受能力(陈意兰等,2021)。MDA的大小可以反映出植物细胞在逆境胁迫下的受损伤程度,其大量积累会影响膜结构的通透性和流动性,对植物产生一定的影响(任斌等,2022)。本研究结果显示,在高盐胁迫下,3种抗氧化酶活性均受到抑制,MDA含量显著上升,这与蒋雪梅等(2013)、朱金芳等(2015)的研究结果一致。这说明泡桐幼苗抗氧化防御系统遭到了破坏,细胞膜脂过氧化作用增强,细胞膜结构受损,对抗氧化酶活性产生抑制。外源GA3能诱导增强幼苗体内氧自由基清除能力,有效清除过量的活性氧ROS,减轻质膜受氧化损伤程度,从而达到缓解盐胁迫的目的(Zadeh et al., 2015; 马志博等,2020)。本研究中,随着喷施GA3浓度的升高,SOD、POD、CAT的活性均呈先升高后降低的趋势,MDA呈逐渐下降的趋势。GA3浓度为200 mg·L-1时,POD活性达到最大值,说明POD对GA3浓度较为敏感,耐受阈值较低;GA3的浓度为400 mg·L-1时,SOD、CAT的活性最高,MDA含量最低。推测幼苗的抗盐酶促机制是SOD、CAT和MDA起主要作用,或者是SOD、POD、CAT这3种酶不能协调一致地完成酶促反應。
3.2 外源GA3對NaCl胁迫下泡桐幼苗光合作用的影响
叶片光合色素含量可以直接表现出植物光合作用的强弱(张开艳等,2022)。Keawmanee等(2022)指出,盐胁迫会导致植物叶绿体超微结构受到损伤,产生大量的ROS,叶绿体蛋白合成受阻,从而使叶片总叶绿素含量显著降低,施加GA3后叶绿素含量得到明显提升。本研究中,在受到高盐胁迫后泡桐叶片叶绿素a、叶绿素b及类胡萝卜素含量均显著降低,推测是高盐胁迫导致泡桐幼苗叶片色素合成酶活性降低,加速叶绿素分解,叶绿素积累量减少(霍静等,2021)。喷施GA3后,各项色素含量均得到部分提升,而整体水平仍低于CK,可能是GA3通过增强类囊体膜的稳定性来减轻有害离子对叶绿体的破坏,从而促进叶片光合色素的合成(李宏归等,2022),而盐胁迫对植株的损伤不可逆,短期内外源GA3不能使植株达到CK水平。这与上述的研究结果一致,但与尚娜等(2017)研究的GA3缓解盐胁迫下幼苗叶片光合色素含量变化趋势不一致,这可能是由研究材料不同或盐胁迫浓度不同等诸多方面的差异造成的。
外源GA3能在一定程度上提高盐胁迫下甜高粱Pn、Tr、Gs、Ci 等光合气体参数(Nimir et al., 2017)。本研究发现,盐胁迫降低了泡桐幼苗的Pn、Tr、Ci、Gs 和WUE,从而显著提高Ls。推测这是由于高浓度的Na+抑制植株的光合作用所致,光合气体参数的改变可能与叶绿素含量变化密切相关。随着喷施GA3浓度的升高,各指标均呈先增大后减小的趋势,并在400 mg·L-1处理时达到峰值,而Ls值则相反,呈先降低后升高的变化趋势,在400 mg·L-1处理时达到最低值,这与对大果榉(霍静等,2021)、番茄(Keawmanee et al., 2022)的研究结果类似,说明使植物光合速率下降的主要因素可能是Ls,盐胁迫下泡桐幼苗保护机制自动开启,关闭部分气孔减少水分散失,外界CO2向植物细胞内扩散受阻,造成光合作用底物减少,喷施适宜浓度外源GA3可有效缓解盐胁迫造成的气孔限制,叶肉细胞间底物大量积累导致光合作用增强,促进植株生长,提高耐盐性。
3.3 外源GA3对NaCl胁迫下泡桐幼苗离子吸收能力的影响
盐离子是植物正常生长不可缺少的营养元素,但过量会抑制多种细胞质酶的合成,引起渗透胁迫和离子毒害,进而影响植物的离子平衡与生理功能(罗达等,2022)。Na+的积累会抑制植物体对大量元素(K、Ca、Mg等)的摄取,植物往往通过根系选择吸收或排出Na+,或通过Na+区来调节和维持细胞内的离子平衡提高植物对盐的适应性(Albaladejo et al., 2017)。郝汉等(2020)研究发现,盐胁迫使槲树幼苗根系比地上部积累更多的Na+,这与本研究中根系Na+含量大于叶片的结果一致,说明泡桐植株根系对Na+有一定的拦截作用,限制Na+向地上部运输,有效减少叶片Na+的大量积累,这是泡桐对盐胁迫的主动适应。植物体内维持较高的K+/Na+、Ca2+/Na+、Mg2+/Na+比值是其耐盐性较强的一种体现(罗达等,2022)。本研究中外源喷施GA3后,叶片及根系K+/Na+、Ca2+/Na+、Mg2+/Na+的比值均增加且叶片大于根系,这可能是因为大量的Na+被其他元素(K、Ca、Mg 等)高亲和转运蛋白截留并隔离在根系中,促进了K+、Ca2+、Mg2+的释放,从而降低地上部植物细胞内Na+含量来提高植物的抗盐能力。这说明喷施GA3可以促进泡桐幼苗对K+、Ca2+、Mg2+的选择运输,从而改善各器官之间的离子平衡,满足植物养分需要,这是植物抗盐害胁迫的一种机制。此外,在酸枣(马志博等,2020)、甜高粱(Nimir et al., 2017)、菠菜(Gong et al., 2022)等植物研究中发现外源激素可以有效缓解离子毒害,这与本研究结果相似。
泡桐幼苗在盐胁迫后,受到的负面影响主要是渗透失衡及离子毒害。根系是先接触到盐分的器官,过量的Na+影响幼苗根系细胞对水分及营养物质的吸收和运输,越来越多的Na+进入到植株叶片中,光合作用减弱,进而导致泡桐生长及干物质积累受到抑制,而外施GA3可以有效缓解盐胁迫对幼苗的抑制。本研究通过对泡桐叶片各指标进行相关性分析,结果显示MDA与SOD、CAT、Chl(a+b)、Pn、Ci、K+/Na+呈极显著负相关(P<0.05),这就意味着MDA含量过高时,可能会使泡桐叶片的抗氧化酶活性减弱,光合作用受到影响,离子平衡被打破,泡桐幼苗的生长发育受到抑制。由于GA3对植物尤其是幼苗期植物的生理作用比较复杂且对植株的影响具有浓度效应,因此本研究通过PCA分析进一步表明,当GA3 浓度400 mg·L-1时缓解效果较好,此时泡桐耐盐能力较强。以上说明GA3主要通过促进干物质积累、叶绿素合成、光合呼吸和渗透平衡等多种方式减弱Na+对植株的不利影响,从而提高泡桐的抗性。
综上所述,150 mmol·L-1的NaCl胁迫会显著抑制泡桐幼苗的生长且生长量降幅超过50%。喷施外源GA3可以提高植物体内抗氧化酶的活性,缓解由盐胁迫导致的活性氧增多而引起的膜脂过氧化反应,通过调节叶片色素含量和光合呼吸气体参数,缓解NaCl对植株光合作用的抑制,光合产物得到累积,泡桐的生物量增大。同时,GA3通过调控植株体内离子运输能力,降低各部位Na+含量,从而缓解NaCl对泡桐的抑制作用。此外,综合各指标相关性及PCA分析可得,400 mg·L-1的GA3缓解效果最佳,该浓度下幼苗干重增加69.71%。本研究初步揭示了泡桐的盐害机制与外源GA3调控盐胁迫的作用机制,为泡桐在盐渍地开发利用提供了依据。
参考文献:
ALBALADEJO I, MECAO V, PLASENCIA F, et al., 2017. Unravelling the strategies used by the wild tomato species Solanum pennellii to confront salt stress: From leaf anatomical adaptations to molecular responses[J]. Environ Exp Bot, 135: 1-12.
BALUSAMY SR, RAHIMI S, SUKWEENADHI J, et al., 2022. Chitosan, chitosan nanoparticles and modified chitosan biomaterials, a potential tool to combat salinity stress in plants [J]. Carbohydr Polym, 284: 119189.
CHEN YL, LI X, ZHAO WZ,et al., 2021. Physiological response ofThuarea involuta under salt stress[J]. Guihaia, 41(2): 225-232.[陈意兰, 李昕, 赵文忠, 等, 2021. 蒭雷草对盐胁迫的生理响应[J]. 广西植物, 41(2): 225-232.]
GAO TL, CHEN DY, LI YF, et al., 2019. Effects of exogenous gibberellin on physiological characteristic of sweet corn seedlings under salt stress[J]. Seed, 38(6): 48-50.[高添樂, 陈丹仪, 李云峰, 等, 2019. 外源赤霉素对盐胁迫下甜玉米幼苗生理性状的影响[J]. 种子, 38(6): 48-50.]
GONG Q, LI ZH, WANG L, et al., 2021. Gibberellic acid application on biomass, oxidative stress response, and photosynthesis in spinach (Spinacia oleracea L.) seedlings under copper stress[J]. Environ Sci Pollut Res Int, 28(38): 53594-53604.
GUO XQ, WU QD, ZHU GL, et al., 2022. Gibberellin increased yield of Sesbania pea grown under saline soils by improving antioxidant enzyme activities and photosynthesis[J]. Agronomy, 12(8): 1855.
HAO H, CAO L, CHEN WN, et al., 2020. Effects of salt stress on the ion balance and physiological-biochemical characteristics of Quercus dentata seedlings[J]. Acta Ecol Sin, 40(19): 6897-6904.[郝汉, 曹磊, 陈伟楠, 等, 2020. 盐胁迫对槲树(Quercus dentata)幼苗离子平衡及其生理生化特性的影响[J]. 生态学报, 40(19): 6897-6904.]
HUO J, BAI JF, QIAO H, et al., 2021. Effects of exogenous treatment on cold resistance of cutting seeding of Zekova sinica[J]. J NW For Univ, 36(4): 131-137.[霍静, 白京凡, 乔虹, 等, 2021. 外源物质处理对大果榉扦插苗抗寒性的影响[J]. 西北林学院学报, 36(4): 131-137.]
JIANG XM, QI WH, XIAO J, et al., 2013. Effects of exogenous proline on physiological and biochemical features of salt-stressed female and male Ginkgo biloba L. seedlings[J]. Acta Physiol Sin,49(6): 579-585.[蒋雪梅, 戚文华, 肖娟, 等, 2013. 盐胁迫下外源脯氨酸对银杏雌雄幼苗生理生化特性的影响[J]. 植物生理学报, 49(6): 579-585.]
KEAWMANEE N, MA G, ZHANG LC, et al., 2022. Exogenous gibberellin induced regreening through the regulation of chlorophyll and carotenoid metabolism in Valencia oranges[J]. Plant Physiol Biochem, 173: 14-24.
LI HF, WANG J, LIU H, et al., 2022. Quantitative analysis of temporal and spatial variations of soil salinization and groundwater depth along the Yellow River saline-alkali land[J]. Sustainability, 14(12): 6967.
LI HG, CHOU LY, LIAO FY, 2022. Effect of GA3 treatment on physiological characteristics of Quercus nuttallii under salt stress[J/OL]. Mol Plant Breed: 1-10[2023-04-13]. https://kns.cnki.net/kcms/detail/46.1068.S.20220415.1647.028.html.[李宏归, 丑琉懿, 廖飞勇, 2022. 赤霉素GA3对盐胁迫下娜塔栎幼苗生理特性的影响[J/OL]. 分子植物育种: 1-10[2023-04-13].https://kns.cnki.net/kcms/detail/46.1068.S.20220415.1647.028.html.]
LI LT, SHEN FM, MA WL, et al., 2020. Response characteristics and quantitative monitoring models analyzed using in situ leaf hyperspectra under different Cd stress conditions[J]. Trans Chin Soc Agric Mach, 51(3): 146-155. [ 李岚涛, 申凤敏, 马文连, 等, 2020. 镉胁迫下菊苣叶片原位高光谱响应特征与定量监测研究[J]. 农业机械学报, 51(3): 146-155.]
LIU J, XUE TT, SHEN YB, 2017. Seed dormancy and germination of Paulownia elongata in response to light, temperature, cold stratification, after-ripening and GA3[J]. Seed Sci Technol, 45(3): 708-713.
LUO D, WU ZB, SHI YJ, et al., 2022. Effects of salt stress on leaf anatomical structure and ion absorption, transportation and distribution of three Pingou hybrid hazelnut seedings[J]. Acta Ecol Sin, 42(5): 1876-1888.[羅达, 吴正保, 史彦江, 等, 2022. 盐胁迫对3种平欧杂种榛幼苗叶片解剖结构及离子吸收、运输与分配的影响[J]. 生态学报, 42(5): 1876-1888.]
MA ZB, CHEN RH, HE AB, et al., 2020. Effects of exogenous salicylic acid on physiological responses and ion absorption of wild jujube (Ziziphus jujuba var. spinosa) seedings under salt stress[J]. J NW For Univ, 35(6): 103-109.[马志博, 陈蕊红, 贺傲兵, 等, 2020. 外源水杨酸对盐胁迫下酸枣幼苗生理特性及离子吸收的影响[J]. 西北林学院学报, 35(6): 103-109.]
NAN LL, GUO QN, CAO SY, et al., 2022. Diversity of bacterium communities in saline-alkali soil in arid regions of Northwest China[J]. BMC Microbiol, 22(1): 11.
NIMIR NEA, ZHOU G, GUO W, et al., 2016. Effect of foliar application of GA3, kinetin, and salicylic acid on ions content, membrane permeability, and photosynthesis under salt stress of sweet sorghum[Sorghum bicolor (L.) Moench][J]. Can J Plant Sci, 97(3): 525-535.
REN B, WANG TY, HUANG QX, et al., 2022. Effect of exogenous nitric oxide on polyphenols and antioxidant activity of walnut seeding leaves[J]. J NW For Univ, 37(2): 115-120.[任斌, 王田雨, 黄倩雪, 等, 2022. 外源NO对核桃幼苗叶多酚及其抗氧化活性的影响[J]. 西北林学院学报, 37(2): 115-120.]
SARKARIA AS, CHINNA GS, 2021. Effect of gibberellic acid and potassium nutrition on yield and potassium uptake of potato[J]. Agric Res J, 58(1): 146-149.
SHANG N, LI JF, WU MC, 2017. Response of tomato seedlings to gibberellin treatment under salt stress[J]. Genomics Appl Biol, 36(7): 2965-2972.[尚娜, 李景富, 吴明臣, 2017. 盐胁迫下番茄幼苗对赤霉素处理的响应[J]. 基因组学与应用生物学, 36(7): 2965-2972.]
SHIRAKU M, MAGWANGA RO, ZHANG YY, et al., 2022. Late embryogenesis abundant gene LEA3 (GhA08G0694) enhances drought and salt stress tolerance in cotton[J]. Int J Biol Macromol, 207: 700-714.
WANG MX, CAO BH, CUI TT, et al., 2019. Effect of seed-collecting period on seed germination and seeding growth of Paulownia under salt stress[J]. Seed, 38(7): 18-23.[王孟筱, 曹帮华, 崔田田, 等, 2019. 采种期对盐胁迫下泡桐种子萌发和幼苗生长的影响[J]. 种子, 38(7): 18-23.]
WANG XJ, XIAO LT, DONG AW, et al., 2017. Research progress in plant science in China in 2016[J]. Act Bot Sin, 52(4): 394-452.[王小菁, 萧浪涛, 董爱武, 等, 2017. 2016年中国植物科学若干领域重要研究进展[J]. 植物学报, 52(4): 394-452.]
WANG Z, ZHAO ZL, FAN GQ, et al., 2019. A comparison of the transcriptomes between diploid and autotetraploid Paulownia fortunei under salt stress[J]. Physiol Mol Biol Plant Int J Funct Plant Biol, 25(1): 1-11.
WEI YF, BAI LJ, SONG XY, et al., 2023. Transcriptome analysis of MYB based on salt stress response in young rice panicles and mining of salt tolerance genes[J].Mol Plant Breed, (2): 360-369.[韦云飞, 白璐嘉, 宋晓叶, 等, 2023. 基于水稻幼穗盐胁迫响应转录组的MYB基因分析及耐盐基因挖掘[J]. 分子植物育种, (2): 360-369.]
YANG B, ZHANG WB, LI XH, et al., 2016. Effects of exogenous GA3 on seed germination and physiological and biochemical indexes of seedling of Radix isatidis under salt stress[J]. Soils, 48(6): 1139-1143.[杨彬, 张文斌, 李翊华, 等, 2016. 外源GA3对盐胁迫下板蓝根种子萌发及幼苗生理生化指标的影响[J]. 土壤, 48(6): 1139-1143.]
YIN JL, JIA JH, LIAN ZY, et al., 2019. Silicon enhances the salt tolerance of cucumber through increasing polyamine accumulation and decreasing oxidative damage[J]. Ecotoxicol Environ Saf, 169: 8-17.
ZADEH SY, RAMIN AA, BANINASAB B, 2015. Effect of gibberellic acid, stratification and salinity on seed germination of Echinacea purpurea cv. Magnus[J]. Herba Pol, 61(3): 13-22.
ZHANG JW, LU SH, ZHAO Z, et al., 2020. Influence of exogenous melatonin on physiological properties of tobacco seedings under low temperature stress[J]. J Agric Sci Technol, 22(9):78-86.[张嘉雯, 卢绍浩, 赵喆, 等, 2022. 外源褪黑素对低温胁迫下烟草幼苗生理指标的影响[J]. 中国农业科技导报, 22(9): 78-86.]
ZHANG KY, WU YY, LI HT, et al., 2022. Effect of inorganic nitrogen supply on the salt-tolerance of Brassica napus plantlets in vitro[J]. Guihaia, 42(3): 422-428.[张开艳, 吴沿友, 李海涛, 等, 2022. 无机氮供应对甘蓝型油菜组培苗盐耐受能力的影响[J]. 广西植物, 42(3): 422-428.]
ZHANG XF, YANG XR, JIAO ZW, 2018. Research progress of salt tolerance evaluation in plants and tolerance evaluation strategy[J]. J Biol, 35(6): 91-94.[张相锋, 杨晓绒, 焦子伟, 2018. 植物耐盐性评价研究进展及评价策略[J]. 生物学杂志, 35(6): 91-94.]
ZHAO ZL, LI YS, LIU HF, et al., 2017. Genome-wide expression analysis of salt-stressed diploid and autotetraploid Paulownia tomentosa[J]. PLoS ONE, 12(10): e0185455.
ZHU JF, LIU JT, LU ZH, et al., 2015. Effects of salt stress on physiological characteristics of Tamarix chinensis Lour. seedlings[J]. Acta Ecol Sin, 35(15): 5140-5146.[朱金方, 劉京涛, 陆兆华, 等, 2015. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报, 35(15): 5140-5146.]
ZHU XH, CHENG HM, JI LY, et al., 2021. Physiological and enrichment characteristics of Paulownia fortunei seedlings under zinc, cadmium and their combined stress[J]. Chin J Biotechnol, 37(7): 2463-2473.[朱秀红, 程红梅, 季柳洋, 等, 2021. 锌、镉及其复合胁迫下白花泡桐幼苗的生理及富集特征[J]. 生物工程学报, 37(7): 2463-2473.]
(责任编辑 蒋巧媛 邓斯丽)

