基于PI3K/Akt 信号通路探讨重楼皂苷Ⅶ对人结直肠癌细胞增殖的影响
侯亚妮,孙中华,刘志勇,褚志杰,白克运
(山东中医药大学,山东 济南 250355; 2.山东中医药大学附属医院,山东 济南 250014)
结直肠癌(CRC)是世界范围内癌症相关死亡的主要原因之一,是最常见的消化道恶性肿瘤,85%以上CRC 由息肉发展为腺瘤再转为腺癌,其发病率和病死率呈逐年上升的趋势[1-3]。 由于前期发病症状不明显,CRC 发现时多已进入中晚期,临床中多采用手术切除,辅以放疗、化疗,但是治疗周期长,不良反应明显,且术后复发率高,严重影响患者生活质量。
近年来中药在癌症治疗中发挥了重要作用。 通过查询2020 年《中国药典》得知,重楼的重要组成成分为重楼皂苷(PP),包含重楼皂苷Ⅰ(PPⅠ)、重楼皂苷Ⅱ(PPⅡ)以及重楼皂苷Ⅶ(PPⅦ)。 PP 有抑制肿瘤细胞增殖和转移、促进细胞凋亡和自噬、抑制新生血管形成、逆转肿瘤多药耐药和调节机体免疫功能等作用[4]。 与经典的细胞毒性药物相比,现代抗癌药物更倾向于针对癌症中作用突出的各种信号通路。磷脂酰肌醇3 激酶/蛋白激酶B(PI3K/Akt)信号通路在肿瘤发生、发展方面起到重要作用,与癌细胞增殖和凋亡、周期调控、血管形成、侵袭、转移密切相关[5]。 网络药理学分析表明,PI3K/Akt 信号通路是PP 抗CRC 的核心通路,具有重要研究价值[6]。 然而,关于PPⅦ是否能够通过调控PI3K/Akt 信号通路抑制CRC 发生发展,尚未见报道。 本研究旨在阐明PPⅦ对CRC 细胞增殖的抑制作用和潜在分子机制,为PP 类药物的研发提供实验依据。
1 材料与方法
1.1 材料与试剂
人结直肠癌细胞HT29 由山东中医药大学附属医院迟莉丽课题组惠赠,人结直肠癌细胞LoVo 购自中国科学院上海生命科学院细胞资源中心,PPⅠ(A0386)、PPⅡ(A0387)、PPⅦ(A0390)购自成都曼斯特生物科技有限公司。RPIM-1640 培养基(CM10040)、Ham’s F-12K 培养基(CM10025)、胰蛋白酶(CC017-500)、青霉素-链霉素(CC004)、磷酸盐缓冲液(PBS)(CC008)均购自中科迈晨科技有限公司,胎牛血清(04-001-1ACS)购自Biological Industries,BeyoClickTM EdU 细胞增殖检测试剂盒(C0088S)、SDS-PAG 凝胶配置试剂盒(P0012A)均购自碧云天生物技术有限公司,BCA 浓度检测试剂盒购自大连美仑生物技术有限公司,抗体蛋白激酶B(Akt,#4685)、磷酸化蛋白激酶B(p-Akt,#4060)、磷脂酰肌醇3 激酶(PI3K,#4257)、磷酸化磷脂酰肌醇3 激酶(p-PI3K,#4228)均购自赛信通生物试剂有限公司,甘油醛3 磷酸脱氢酶(GAPDH)(60004-1-Ig)购自武汉三鹰生物技术有限公司,山羊抗鼠(ZB-2305)、山羊抗兔(ZB-2301)均购自北京中杉金桥科技生物有限公司,增强型化学发光液(WBKLS0500)购自默克密理博实验室设备有限公司。
1.2 方法
1.2.1 细胞培养
在培养基中添加10%胎牛血清(FBS)和1%双抗,配置成完全培养基,HT29 细胞株常规培养于RPMI-1640 培养基中,LoVo 细胞株常规培养于Ham’s F-12K培养基中,细胞置于37 ℃、含5% CO2的细胞培养箱中培养,细胞生长融合至细胞培养皿面积的80%~90%,按照1∶3(HT29)和1∶2(LoVo)的比例胰酶消化传代。 取对数生长期的细胞用于后续实验。
1.2.2 重楼皂苷配置
取1 mg 药物溶解到1 mL DMSO 中,获得终质量浓度为1 mg/mL 的药物母液,存于-20 ℃长期避光保存。 取10 μL 药物母液用每种细胞所需培养基定容至1 mL,获得终质量浓度为100 μg/mL 的药物母液,短期4 ℃避光保存,用前以培养基稀释。
1.2.3 四甲基偶氮唑盐(MTT)比色法检测细胞活力
取对数生长期的HT29 和LoVo 细胞,PBS 冲洗两遍,胰酶消化离心后,加入完全培养基制备成细胞悬液计数。 将细胞接种于96 孔板,调整每孔细胞浓度为8×103个细胞,定容至100 μL,培养过夜后细胞生长融合至细胞培养孔板面积的50%,并加入梯度浓度的PPⅠ、PPⅡ、PPⅦ和顺铂,每种药物设置1 个主孔与4 个复孔,处理48 h,随后每孔加入0.5%的MTT 溶液20 μL,继续培养4 h。 加入DMSO 150 μL,放入酶标仪检测490 nm 处吸光度。 分析并计算药物的最大半抑制浓度值(IC50值)。
1.2.4 克隆形成实验
取对数生长期的HT29 和LoVo 细胞,PBS 冲洗两遍,胰酶消化离心后,加入完全培养基制备成细胞悬液计数。 将细胞以500 个/孔接种到6 孔板,培养24 h 后,设空白组(0 μg/mL)及PPⅦ给药组,给药组加入梯度浓度的PPⅦ(0.375 μg/mL、0.750 μg/mL),置于37 ℃,5% CO2的培养箱中继续培养,每3 d 更换含药的完全培养基1 次,10 d 后终止培养,4%甲醇固定30 min,0.5%结晶紫染色20 min,PBS 冲洗两遍,拍照并计数。 克隆抑制率(%)=[(空白组克隆形成率- 给药组克隆形成率)/空白组克隆形成率]×100%。
1.2.5 EdU 细胞增殖检测(TMB 法)
取对数生长期的HT29 和LoVo 细胞制备成细胞悬液并计数。 将细胞接种于96 孔板,调整细胞浓度为8×103个细胞每孔,定容至100 μL,培养过夜后细胞密度达50%,并加入梯度浓度的PPⅦ(0 μg/mL、3 μg/mL、6 μg/mL)干预48 h 后终止培养,每孔加入2×EdU 工作液100 μL,37 ℃孵育2 h,去除培养基,加入4%甲醇固定15 min,PBS 冲洗3 次,每次5 min,加入100 μL 通透液,孵育15 min,PBS 冲洗2 次,每次5 min,加入内源性过氧化物酶100 μL,孵育20 min,PBS 冲洗3 次,每次2 min,制备Click 反应液,每孔加入50 μL,避光孵育30 min,PBS 冲洗3 次,每次5 min,制备Streptavidin-HRP 工作液,每孔加入20 μL,孵育30 min,PBS 冲洗3 次,每次2 min,加入100 μL TMB 显色液,孵育30 min,放入酶标仪检测450 nm处吸光度(OD)。 细胞增殖率(%)=(对照组OD 值-实验组OD 值)/对照组OD 值。
1.2.6 蛋白质印迹法(Western blotting)检测蛋白表达
取对数生长期的HT29 和LoVo 细胞制备成细胞悬液并计数。 将细胞以8×106个/孔接种于6 孔板,培养24 h 后,加入梯度浓度的PPⅦ(0 μg/mL、3 μg/mL、6 μg/mL)干预48 h 后终止培养,将细胞刮下收集到EP 管中,离心去上清液,仅保留细胞团,按照裂解液∶蛋白酶抑制剂PMSF∶磷酸酶抑制剂=100∶1∶1的比例混匀,配置到EP 管中,冰上裂解30 min。 4 ℃条件下,13 200 r/min 离心15 min,离心半径为6 cm,取上清液,BCA 法检测蛋白浓度,根据结果使用PBS调整蛋白浓度,95 ℃加热5 min 使蛋白变性。 每个泳道上样30 μg 蛋白,80 V 恒压条件下10% SDS-PAGE胶分离蛋白后,260 mA 转膜(PVDF 膜)2 h,用含5%脱脂奶粉的TBST 溶液封闭1 h(磷酸化指标用5%BSA 封闭1 h)。 分别孵育PI3K、p-PI3K、Akt、p-Akt 抗体(1∶1000),4 ℃条件下孵育过夜。 TBST 洗膜3 次,每次10 min。 室温孵育二抗1 h,TBST 洗膜3 次,每次10 min,ECL 发光液显影。
1.3 统计方法
结果采用Graph Pad Prism 8.0 统计软件进行统计分析,数据均以x±s 表示,多组间比较采用单因素方差分析,组间比较采用LSD-t 检验。 取α=0.05为检验水准。
2 实验结果
2.1 重楼皂苷对HT29 和LoVo 细胞活力的影响
重楼皂苷对细胞活力的影响,用MTT 法进行检测。 采用梯度浓度的重楼皂苷和顺铂(阳性对照)分别干预HT29 细胞和LoVo 细胞48 h,MTT 法检测细胞活力。 结果表明,PPⅦ能有效降低HT29 和LoVo 细胞的活力。 见图1。 通过对IC50值分析发现,PPⅦ干预HT29 细胞的IC50值为(6.94±0.52)μg/mL,干预LoVo 细胞的IC50值为(5.75±0.31)μg/mL。低于顺铂干预的HT29 细胞(12.18±1.33)μg/mL 和LoVo 细胞(11.80±1.66)μg/mL,而PPⅠ和PPⅡ对应数值均高于顺铂,见表1。 据此,后续实验选用PPⅦ进行。

图1 重楼皂苷(PP)Ⅰ、PPⅡ、PPⅦ、顺铂对人结直肠癌细胞HT29 和LoVo 活力的影响

表1 重楼皂苷与顺铂对应的IC50 值比较
2.2 PPⅦ抑制HT29 和LoVo 细胞的克隆形成能力
由于克隆实验细胞种植数量较少,设定质量浓度3 μg/mL、6 μg/mL 均无法产生细胞团,故依次减少药物质量浓度直至0.75 μg/mL 可形成细胞团。结果显示,与0 μg/mL 组比较,0.75 μg/mL 组能显著抑制HT29 的克隆形成数目(P<0.01)。 对LoVo 细胞,0.375 μg/mL、0.750 μg/mL 剂量组的PPⅦ可显著抑制其克隆形成数目(P<0.05)。说明随着PPⅦ质量浓度的增加,细胞克隆形成数目减少,对克隆形成的抑制率升高。 见表2。
表2 不同质量浓度重楼皂苷Ⅶ对细胞克隆形成情况影响的比较()
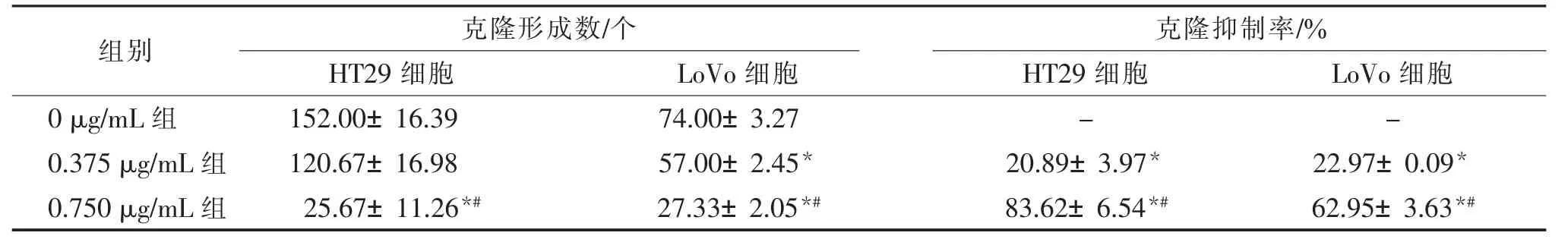
表2 不同质量浓度重楼皂苷Ⅶ对细胞克隆形成情况影响的比较()
注:与0 μg/mL 组比较,*P<0.05;与0.375 μg/mL 组比较,#P<0.05。
组别 克隆形成数/个 克隆抑制率/%HT29 细胞 LoVo 细胞 HT29 细胞 LoVo 细胞0 μg/mL 组 152.00±16.39 74.00±3.27 - -0.375 μg/mL 组 120.67±16.98 57.00±2.45* 20.89±3.97* 22.97±0.09*0.750 μg/mL 组 25.67±11.26*# 27.33±2.05*# 83.62±6.54*# 62.95±3.63*#
2.3 PPⅦ抑制HT-29 和LoVo 细胞的增殖能力
使用BeyoClickTM EdU 细胞增殖检测试剂盒检测PPⅦ对细胞增殖情况的影响,PPⅦ干预HT29细胞的IC50值为(6.94±0.52)μg/mL,干预LoVo 细胞的IC50值为(5.75±0.31)μg/mL,故选择梯度浓度PPⅦ(0 μg/mL、3 μg/mL、6 μg/mL)干预细胞48 h后,检测450 nm 处吸光度。 发现与0 μg/mL 组比较,PPⅦ质量浓度为3 μg/mL、6 μg/mL 组增殖率均降低,差异具有统计学意义(P<0.05)。 与3 μg/mL 组比较,6 μg/mL 组HT29 细胞增殖率降低不明显,差异无统计学意义(P>0.05),LoVo 细胞增殖率降低明显,差异有统计学意义(P<0.05)。 结果说明随着PPⅦ质量浓度增加至IC50值,细胞增殖能力显著减弱。见表3。
表3 不同质量浓度重楼皂苷Ⅶ对细胞增殖影响比较()
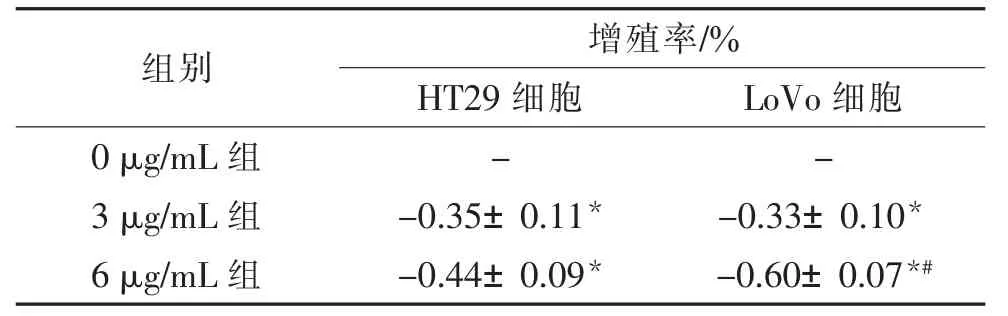
表3 不同质量浓度重楼皂苷Ⅶ对细胞增殖影响比较()
注:与0 μg/mL 组比较,*P<0.05;与3 μg/mL 组比较,#P<0.05。
组别 增殖率/%HT29 细胞 LoVo 细胞0 μg/mL 组 - -3 μg/mL 组 -0.35±0.11* -0.33±0.10*6 μg/mL 组 -0.44±0.09* -0.60±0.07*#
2.4 PPⅦ对HT-29 和LoVo 细胞中PI3K/Akt 信号通路的影响
用梯度浓度的PPⅦ(0 μg/mL、3 μg/mL、6 μg/mL)处理HT29 和LoVo 细胞48 h,PPⅦ可以下调PI3K、Akt 的磷酸化水平。 见表4、表5、图2。

图2 重楼皂苷Ⅶ处理人结直肠癌细胞HT-29 和LoVo 细胞48 h 后PI3K/Akt 信号通路中的蛋白表达
表4 重楼皂苷Ⅶ对HT29 细胞PI3K/Akt 通路相关蛋白表达的影响()
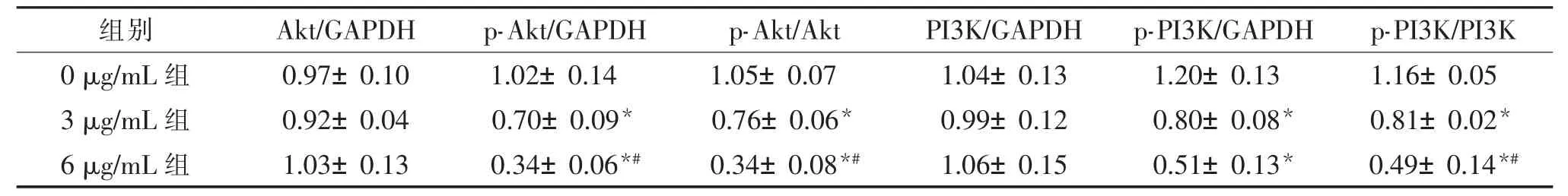
表4 重楼皂苷Ⅶ对HT29 细胞PI3K/Akt 通路相关蛋白表达的影响()
注:GAPDH 为甘油醛3 磷酸脱氢酶,Akt 为蛋白激酶B,p-Akt 为磷酸化蛋白激酶B,PI3K 为磷脂酰肌醇3 激酶,p-PI3K 为磷酸化磷脂酰肌醇3 激酶。与0 μg/mL 组比较,*P<0.05,与3 μg/mL 组比较,#P<0.05。
组别 Akt/GAPDH p-Akt/GAPDH p-Akt/Akt PI3K/GAPDH p-PI3K/GAPDH p-PI3K/PI3K 0 μg/mL 组 0.97±0.10 1.02±0.14 1.05±0.07 1.04±0.13 1.20±0.13 1.16±0.05 3 μg/mL 组 0.92±0.04 0.70±0.09* 0.76±0.06* 0.99±0.12 0.80±0.08* 0.81±0.02*6 μg/mL 组 1.03±0.13 0.34±0.06*# 0.34±0.08*# 1.06±0.15 0.51±0.13* 0.49±0.14*#
表5 重楼皂苷Ⅶ对LoVo 细胞PI3K/Akt 通路相关蛋白表达的影响()
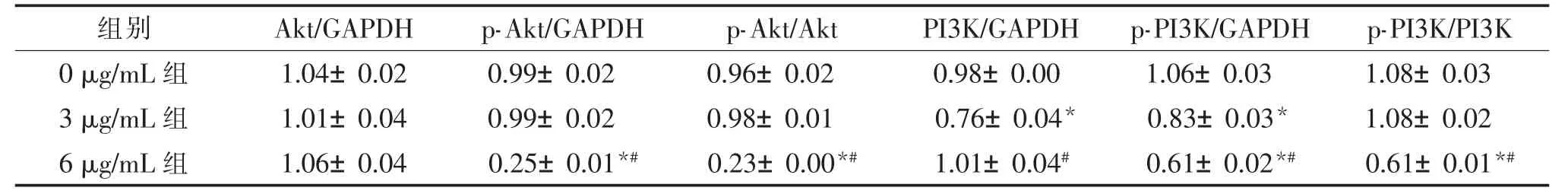
表5 重楼皂苷Ⅶ对LoVo 细胞PI3K/Akt 通路相关蛋白表达的影响()
注:GAPDH 为甘油醛3 磷酸脱氢酶,Akt 为蛋白激酶B,p-Akt 为磷酸化蛋白激酶B,PI3K 为磷脂酰肌醇3 激酶,p-PI3K 为磷酸化磷脂酰肌醇3 激酶。与0 μg/mL 组比较,*P<0.05;与3 μg/mL 组比较,#P<0.05。
组别 Akt/GAPDH p-Akt/GAPDH p-Akt/Akt PI3K/GAPDH p-PI3K/GAPDH p-PI3K/PI3K 0 μg/mL 组 1.04±0.02 0.99±0.02 0.96±0.02 0.98±0.00 1.06±0.03 1.08±0.03 3 μg/mL 组 1.01±0.04 0.99±0.02 0.98±0.01 0.76±0.04* 0.83±0.03* 1.08±0.02 6 μg/mL 组 1.06±0.04 0.25±0.01*# 0.23±0.00*# 1.01±0.04# 0.61±0.02*# 0.61±0.01*#
3 讨论
CRC 是胃肠道中常见的恶性肿瘤,早期症状不明显,随着病情的进展患者逐渐出现便血、排便习惯改变、腹泻、腹泻与便秘交替、腹痛等表现,进展到晚期则会出现贫血、体质量减轻等全身症状。 根据临床表现,可将CRC 归属于中医学积聚、肠澼、肠覃等病证范畴[7]。 CRC 的发生与先天禀赋不足、后天失养有关,慢性肠道疾病可损伤阳气,耗伤气阴,使阴阳失调,主要病机为湿热蕴结、气滞血瘀、正气亏虚等[8]。 但是近年来随着癌毒理论的提出,对肠息肉病因的认识不断深入,魏小曼等[9]认为,脾气亏虚是大肠癌发生发展的内在基础,湿热瘀毒是大肠癌发生发展的重要条件,故治疗中抗癌解毒是关键点。
研究表明,中药及其提取物对肿瘤具有抑制作用,具体体现在抗增殖、促凋亡、抗转移、抗血管生成、调节自噬、逆转多药耐药等方面[10]。 重楼具有清热解毒、消肿止痛、凉肝定惊的功效,药理作用研究发现其具有抗肿瘤、抗病毒、抗炎、止血、镇痛、抑制精子活性、治疗淋巴结结核溃疡等作用[11],重楼软坚汤辅助放化疗可以提高肺癌患者近远期疗效,2 年生存率显著提高[12]。 近年来,国内外研究证明,在治疗恶性肿瘤方面,PP 及其提取物可以抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制细胞侵袭和迁移[13]。张特等[14]研究发现,PPⅠ可以通过直接靶向抑制表皮生长因子受体,以阻断其下游信号通路起到治疗乳腺癌的作用。 张亮等[15]研究发现,PPA 与转录因子家族-1 相互结合可以阻断蛋白磷酸酶2A 癌性抑制因子/蛋白激酶B 信号通路,从而抑制胃癌细胞的增殖并诱导凋亡。 何昊等[16]研究发现,PPⅦ能够抑制人胰腺癌PANC-1 细胞的增殖、迁移和侵袭,并且下调程序性死亡分子配体-1 蛋白表达,参与免疫调节,从而抑制胰腺癌的发展。
CRC 最主要的恶性生物学特征为淋巴转移和远端转移,而去分化、失去黏附约束以及运动性和侵袭性增强,都是肿瘤增加恶性质的标志[17]。 研究发现,PI3K/Akt/mTOR 通路与CRC 的发病、转移、耐药和干细胞相关,该通路是药物治疗的首选靶点[18]。PI3K/Akt 信号通路激活是调节肿瘤细胞增殖和凋亡的经典信号通路之一,该通路与卵巢癌、膀胱癌及CRC 的发展密切相关[19-21]。He 等[22]研究报道,PPⅦ通过下调PI3K、p-PI3K、Akt、p-Akt 的表达阻断PI3K/Akt通路激活,进而抑制人肺癌A549 细胞增殖并诱导细胞凋亡。 因此,通过抑制PI3K/Akt 信号通路的水平治疗癌症可能会成为未来治疗CRC 的发展方向。在本实验中,采用MTT 比色法验证了PPⅦ对CRC细胞增殖的抑制作用,结果表明CRC 细胞HT29 和LoVo 经PPⅦ干预48 h 后,药物浓度越高,肿瘤细胞的活力越差,细胞克隆实验、细胞增殖实验表明,随着药物浓度的增加,细胞的增殖能力逐渐降低,说明PPⅦ可随着剂量增大有效抑制CRC 细胞的恶性生物学行为。
PI3K/Akt 信号通路由磷酸化磷脂酰肌醇3-羟基的脂类激酶活性PI3K 及下游Akt 组成,PI3K 是由p110 和p85 亚基组成的异源二聚体,可被各种生长因子受体和癌基因启动,通过磷酸化Akt 的Ser473和Thr308 位点从而将其激活[23]。 因此,抑制PI3K/AKT 信号通路是多种药物对抗CRC 作用的机制。研究证实,从紫草中分离的脱氧紫草素可以通过下调PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mTOR)通路抑制CRC 的发展,莲房原花青素可能是通过抑制Ras相关C3 肉毒菌毒物底物1(RAC1)/PI3K/AkT 信号通路实现抑制肿瘤恶性生物学行为的作用,紫花前胡素可能通过抑制PI3K/Akt 信号通路的激活影响CRC 细胞的增殖、凋亡及迁移[24-25]。在本研究中我们发现PPⅦ下调人结直肠癌细胞HT29 和LoVo 中PI3K 和Akt 蛋白磷酸化表达水平,结果提示PPⅦ可能通过降低PI3K 和Akt 磷酸化水平抑制PI3K/Akt通路的激活,从而抑制HT29 和LoVo 细胞的增殖并诱导细胞凋亡。
综上所述,PPⅦ对CRC 细胞的增殖具有明显抑制作用,且随着药物浓度的提高抑制作用越发显著,其机制可能与通过下调PI3K、Akt 的磷酸化水平,抑制PI3K/Akt 信号通路有关。 该研究为PPⅦ治疗CRC 提供实验依据和新的思路,并且为天然植物成分进行CRC 的治疗提供了一定的理论依据,下一步将对PPⅦ治疗CRC 的分子机制进行更加深入研究。

