三种肾阴虚证动物模型造模方法比较研究
王志鑫,崔艳艳,宋婷婷,高田田,申 琦,戚语宸,李敏洁,王杰琼
(山东中医药大学,山东 济南 250355)
阴虚是临床上诸多病证的基本病机[1],肾阴虚证指肾阴亏损,失于滋养,虚热内扰,以五心烦热、腰膝酸软、形体消瘦、口干舌燥、眩晕耳鸣等为常见症的证候[2]。 肾阴虚证造模方法多种多样,通过查阅文献发现,目前最常用的造模方法有三种,分别以甲状腺片、甲状腺片联合利血平及肾上腺皮质激素氢化可的松注射液灌胃[3],造模结束后,均能表现肾阴虚证的主要症状,但三种造模方法哪种更加稳定可靠,鲜见研究。 本文通过比较三种模型制备方法,探究肾阴虚证的最佳模型制备方案,旨在为肾阴虚证的研究提供可靠稳定的动物模型。
1 材料
1.1 实验动物
无特定病原体(SPF)级雌性KM 种小鼠40 只,6~8 周龄,体质量(20±2)g;SPF 级雌性SD 大鼠60只,6~8 周龄,体质量(200±20)g。 大鼠、小鼠均购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2016-0011。 动物入室后常规饲养于独立通气笼(IVC)环境中,使用许可证号SYXK(鲁)20170022。 动物自由饮食饮水,12/12 h 光暗照射,室温(22±3)℃,相对湿度为40%~60%。 涉及到动物实验相关的内容和程序都已通过山东中医药大学动物伦理委员会审批(审批号:DWSY201703013)。
1.2 药物和试剂
甲状腺片(上海中华药业有限公司,国药准字H31022151);复方利血平片(亚宝药业集团股份有限公司,国药准字H14023613);氢化可的松注射液(天津金耀药业有限公司,国药准字H12020887);生理盐水(辰欣药业股份有限公司,国药准字H3702 2336);Mouse cAMP ELISA KIT(江苏科晶生物科技有限公司,批号KJ-2757B);Mouse cGMP ELISA KIT(江苏科晶生物科技有限公司,批号KJ-3280B);大鼠环磷酸腺苷(cAMP)试剂盒(南京建成生物工程研究所,批号H164-1-2);大鼠环磷酸鸟苷(cGMP)试剂盒(南京建成生物工程研究所,批号H163-1-2)。
1.3 主要仪器
欧普士MS 红外测温仪(深圳市欧普士电子技术有限公司,型号粤制00000573),高速冷冻离心机[赛默飞世尔科技(中国)有限公司,型号YZB/GER 1841-2014],酶联免疫分析仪(BIOBASE,山东博科干细胞应用研究院有限公司,型号BK-EL10C),基因研究型超纯水机(青岛富勒姆科技有限公司,型号FJY1002-UVF-P)。
2 实验方法
2.1 三种肾阴虚证小鼠模型制备
2.1.1 造模及取材
2.1.1.1 动物造模[4-8]
适应性饲养1 周后,将40 只KM 种小鼠随机分为对照组、甲状腺片组、甲状腺片联合利血平组(联合组)、氢化可的松组4 组,每组10 只。 灌胃给药量为每只0.2 mL·10 g-1,对照组给予等量生理盐水14 d;甲状腺片组给予甲状腺片混悬液160 mg·kg-1,给药14 d;联合组灌胃甲状腺片150 mg·kg-1及利血平1 mg·kg-1混悬液,给药7 d;氢化可的松灌胃组灌胃50 mg·kg-1,给药4 d。
2.1.1.2 取材
4 组小鼠造模结束后摘眼球取血,血清于室温静置0.5 h,离心,分离血清,同时颈椎脱臼处死各组小鼠,取卵巢、子宫、肾上腺,测量脏器指数。
2.1.2 检测指标
2.1.2.1 一般情况观察
观察各组小鼠一般活动情况及其皮毛色泽、进食量、大便形态等。
2.1.2.2 小鼠体质量和体温变化[9-10]
每天上午9∶00 给药前测定小鼠体质量,至造模结束取材前,并计算小鼠体质量变化率,公式为:在给药后半小时内测定小鼠面温、尾温,平行测定3 次,取平均值进行显著性分析。
2.1.2.3 血清cAMP、cGMP 含量检测
采用酶联免疫吸附试验(ELISA)检测血清cAMP、cGMP 含量,按照试剂盒说明书进行测定。
2.1.2.4 小鼠脏器指数检测
颈椎脱臼处死小鼠,剖腹取出子宫、卵巢及肾上腺,生理盐水冲洗表面血渍后,吸水纸吸干残留水分,称定重量,依照下式计算各脏器指数。
脏器指数= 脏器湿重/体质量×100%。
2.1.3 统计学方法
所有数据均采用GraphPad Prism 8.3 进行统计处理,各组计量数据均以表示,采用单因素方差分析,取α=0.05 作为检验水准。
2.2 肾阴虚证大鼠模型验证
根据小鼠模型研究(具体见“实验结果3.1 项下”),发现甲状腺片灌胃及甲状腺片联合利血平灌胃两种造模方法效果比较好。 基于此,进一步验证大鼠肾阴虚模型最佳造模方法,以适应不同实验研究的需求,具体方法如下。
2.2.1 大鼠造模[6,11]
适应性饲养1 周后,将60 只SD 雌性大鼠随机分为对照组、甲状腺片组、联合组3 组,每组20 只。于每日上午8∶30 灌胃,各组分别灌胃纯水、甲状腺片混悬液(160 mg·kg-1)、甲状腺片联合利血平混悬液(150 mg·kg-1+1 mg·kg-1),灌胃体积为1 mL·100 g-1。对照组及甲状腺片组灌胃14 d,联合组灌胃7 d。
2.2.2 指标检测
观察大鼠一般情况、体质量变化、体温变化及血清cAMP、cGMP 含量,检测方法同2.1.2 项下所列内容。
2.2.3 统计学方法
同2.1.3 项下所列方法。
3 实验结果
3.1 三种肾阴虚证小鼠模型比较研究结果
3.1.1 一般情况
对照组小鼠一般状况良好,摄食、饮水正常,毛色光洁,反应灵敏,活动自如,体质量显著增加。 模型组小鼠毛色黄且无光泽,饮食量减少,大便干燥,小便发黄,抓握时反应剧烈,易激惹。
3.1.2 各组小鼠体质量变化率比较
与对照组比较,三种模型制备方法造模完成后,各组小鼠体质量变化率均降低,差异有统计学意义(P<0.05),见表1。
表1 各组小鼠体质量变化率比较(,%)
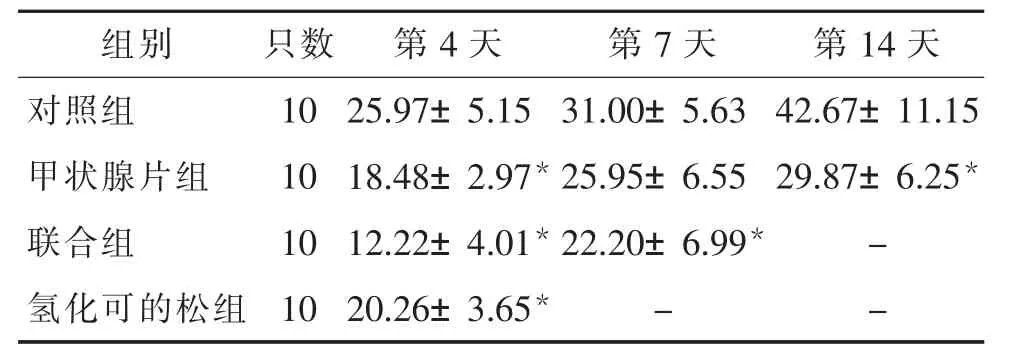
表1 各组小鼠体质量变化率比较(,%)
注:与同时段对照组比较,*P<0.05。
第4 天 第7 天 第14 天对照组 10 25.97±5.15 31.00±5.63 42.67±11.15甲状腺片组 10 18.48±2.97*25.95±6.55 29.87±6.25*联合组 10 12.22±4.01*22.20±6.99* -氢化可的松组 10 20.26±3.65* - -组别 只数
3.1.3 各组小鼠面温变化情况
造模结束后,甲状腺素组小鼠面温较对照组显著升高,差异有统计学意义(P<0.05),其他组小鼠面温与对照组比较,具有升高趋势,但差异无统计学意义。 见图1、表2。

图1 不同造模方法各组小鼠面温与对照组比较
表2 各组小鼠面温变化比较(,℃)

表2 各组小鼠面温变化比较(,℃)
注:与同时段对照组比较,*P<0.05。
组别 只数 第4 天 第7 天 第14 天对照组 10 28.99±0.97 29.20±0.39 29.41±0.31甲状腺片组 10 30.06±0.67* 29.81±0.53* 30.49±0.26*联合组 10 29.23±0.61 29.67±0.34 -氢化可的松组 10 29.56±0.53 - -
3.1.4 各组小鼠尾温变化情况
造模结束后,甲状腺片组小鼠尾温较对照组显著升高,差异有统计学意义(P<0.05),而其他组小鼠尾温有升高趋势,但差异无统计学意义。 见图2、表3。

图2 不同造模方法组小鼠尾温与对照组比较
表3 各组小鼠尾温变化比较(,℃)
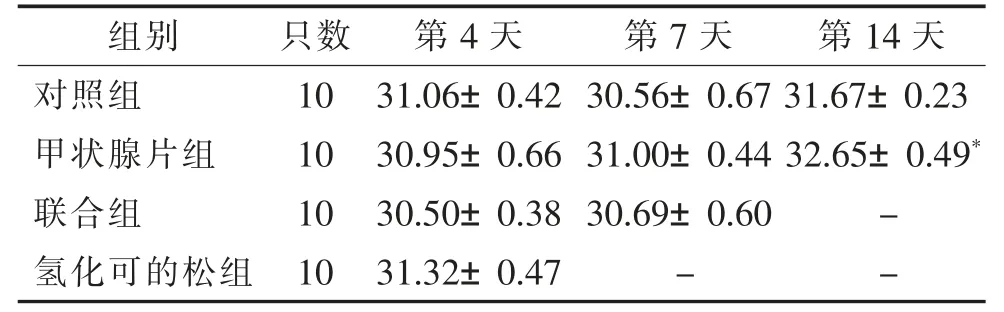
表3 各组小鼠尾温变化比较(,℃)
注:与同时段对照组比较,*P<0.05。
组别 只数 第4 天 第7 天 第14 天对照组 10 31.06±0.42 30.56±0.67 31.67±0.23甲状腺片组 10 30.95±0.66 31.00±0.44 32.65±0.49*联合组 10 30.50±0.38 30.69±0.60 -氢化可的松组 10 31.32±0.47 - -
3.1.5 各组小鼠血清cAMP、cGMP 含量比较
与对照组比较,甲状腺片组小鼠血清cAMP 含量显著升高(P<0.05),符合肾阴虚证临床症状,氢化可的松组小鼠血清cAMP 含量有上升趋势,但差异无统计学意义。 与对照组比较,甲状腺片组小鼠cGMP 含量有上升趋势,但差异无统计学意义,联合组小鼠血清cGMP 含量降低(P<0.05),符合肾阴虚证临床症状。 见表4。
表4 各组小鼠血清cAMP、cGMP 含量比较(,pg/mL)

表4 各组小鼠血清cAMP、cGMP 含量比较(,pg/mL)
注:cAMP 为环磷酸腺苷,cGMP 为环磷酸鸟苷。与对照组比较,*P<0.05。
组别 只数 cAMP cGMP对照组 10 7.016±4.334 1.044±1.040甲状腺片组 10 27.630±16.300* 2.139±0.670联合组 10 4.677±0.870 0.081±0.020*氢化可的松组 10 18.400±15.490 0.205±0.196
3.1.6 各组小鼠脏器指数比较
与对照组比较,甲状腺片组卵巢和肾上腺指数变化差异无统计学意义,但子宫指数降低(P<0.05);联合组小鼠卵巢和肾上腺脏器指数均升高(P<0.05),子宫指数降低(P<0.05);氢化可的松组卵巢指数显著升高(P<0.05),但子宫和肾上腺指数显著降低(P<0.05)。见表5。
表5 各组小鼠卵巢、子宫及肾上腺脏器指数比较(,%)

表5 各组小鼠卵巢、子宫及肾上腺脏器指数比较(,%)
注:与对照组比较,*P<0.05。
组别 只数 卵巢指数 子宫指数 肾上腺指数对照组 10 0.032±0.007 0.456±0.150 0.031±0.004甲状腺片组 10 0.025±0.005 0.249±0.129* 0.037±0.007联合组 10 0.066±0.010* 0.243±0.088* 0.038±0.006*氢化可的松组 10 0.058±0.012* 0.191±0.077* 0.023±0.002*
综合各造模方法下小鼠一般情况及体温(面温、尾温)、血清指标(cAMP、cGMP)、脏器指数等结果,给予小鼠灌服甲状腺片及甲状腺片联合利血平两种方法造模结果较为良好。 所以,将在大鼠上进行这两种造模方法的复测与比较。 结果如下。
3.2 肾阴虚证大鼠模型验证结果
3.2.1 各组大鼠体质量变化率比较
与对照组比较,甲状腺片组及联合组大鼠体质量变化率显著降低,差异有统计学意义(P<0.05)。见表6。
表6 各组大鼠体质量变化率比较(,%)
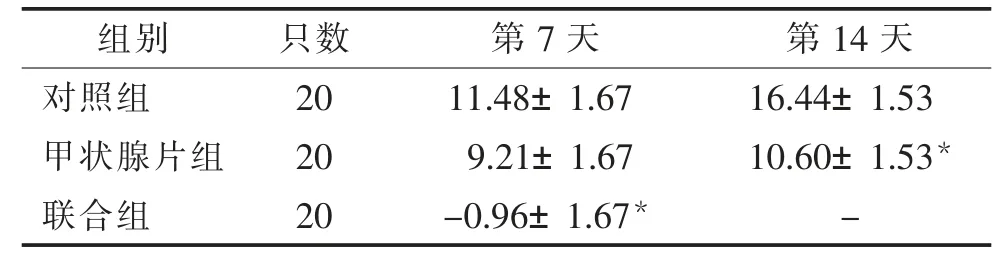
表6 各组大鼠体质量变化率比较(,%)
注:与对照组比较,*P<0.05。
第7 天 第14 天对照组 20 11.48±1.67 16.44±1.53甲状腺片组 20 9.21±1.67 10.60±1.53*联合组 20 -0.96±1.67* -组别 只数
3.2.2 各组大鼠面温、尾温比较
造模第7 天时,与对照组比较,甲状腺片组及联合组大鼠面温、尾温均显著升高,差异有统计学意义(P<0.05)。 造模第14 天时,与对照组比较,甲状腺片组大鼠面温和尾温均显著升高,差异有统计学意义(P<0.05)。 见表7。
表7 各组大鼠面温、尾温比较(s,℃)

表7 各组大鼠面温、尾温比较(s,℃)
注:与同时段对照组比较,*P<0.05。
组别 只数 面部温度 尾部温度第7 天 第14 天 第7 天 第14 天对照组 20 30.99±1.05 31.78±0.36 25.57±1.09 27.32±1.05甲状腺片组 20 32.35±0.40* 33.00±0.33* 26.98±1.02* 30.05±1.17*联合组 20 32.51±0.31* - 30.13±1.36* -
3.2.3 各组大鼠血清cAMP、cGMP 含量比较
造模结束后,与对照组比较,甲状腺片组血清cAMP 含量升高,差异有统计学意义(P<0.05),符合肾阴虚证临床症状。 与对照组比较,联合组血清cGMP 含量升高,差异有统计学意义(P<0.05),符合肾阴虚证临床症状。 见表8。
表8 各组大鼠血清cAMP、cGMP 含量比较(,mol/mL)

表8 各组大鼠血清cAMP、cGMP 含量比较(,mol/mL)
注:cAMP 为环磷酸腺苷,cGMP 为环磷酸鸟苷。与对照组比较,*P<0.05。
组别 只数 cAMP cGMP对照组 20 54.44±9.33 60.95±29.31甲状腺片组 20 63.43±13.02* 53.52±32.74联合组 20 50.57±10.40 95.42±25.19*
4 讨论
肾阴虚证作为中医基本证型之一,多见于骨质疏松症、2 型糖尿病及原发性高血压等疾病[12]。 肾阴虚的形成常见以下几种原因:禀赋不足,肾阴素亏;或情志内伤,五志过极,化火伤阴;或失血耗液,过服壮阳温燥之品,耗伤肾阴。 《素问·六节藏象论》曰:“肾者,主蛰,封藏之本,精之处也,其华在毛,其充在皮。”肾阴不足,使机体失去濡养,则表现为毛发枯燥,形体消瘦;肾阴亏虚,阴虚不能制阳,阳气上亢而虚热内生,虚邪在里,发为潮热,手足濈濈汗出,五心烦热,颧红面赤;阴虚火旺,膀胱化源不足,则见小便短赤;阴液不足,大肠失去濡润,则大便干结。
目前,肾阴虚证模型制备方法有甲状腺素类激素、肾上腺素类激素、温燥性中药灌胃以及行劳伤阴等方法[13-15],且实验对象多为啮齿类哺乳动物[16],又因临床肾阴虚证患者多为女性[17],故本实验采用雌性小鼠、大鼠作为模型载体进行研究。 温燥性中药灌胃造模是最为符合中医病因的造模方法,制备的模型为病因模型,但因其造模时间比较长,造模后体温升高不明显等原因,在实际应用中该造模方法使用较少[16]。行劳伤阴法制备肾阴虚模型主要是利用长时期超负荷运动,造成动物体内阴气大量损耗,阴不制阳,阳气亢盛,从而表现出体温升高、体质量降低、大便干燥等症状。 该造模方法在病因上比较符合临床,且人为干扰较少,但由于造模时间难以把控,且容易出现阳虚现象,故而限制了该造模方法的应用[18]。 大剂量给予甲状腺素或肾上腺皮质激素等激素造模方法属于病理模型制备方法,此两种造模方法制备的模型可以反映出临床肾阴虚症状,且具有造模时间短、操作方便、模型稳定等优势,在实际应用中较为普遍[19]。因此,本研究针对上述两种肾阴虚模型制备方法进行比较。
本实验研究结果显示,与对照组比较,各组小鼠分别灌胃甲状腺片、甲状腺片联合利血平以及氢化可的松后,均能引起小鼠体质量降低,且体质量变化率差异有统计学意义。 同时,给予大鼠甲状腺片及甲状腺片联合利血平后,体质量同样明显降低。 这可能是因为体内高甲状腺素含量,使得机体蛋白质、糖原和脂肪分解增加,基础代谢率升高,身体产热量增加,小鼠体质量下降,体温显著升高[20]。 小鼠和大鼠面温及尾温实验结果显示,给予甲状腺片能够很好地模拟出临床肾阴虚患者潮热汗出的现象,但给予氢化可的松后,小鼠面温和尾温变化不明显,未能表现出肾阴虚证潮热颧红、五心烦热的症状。 给予小鼠甲状腺片及利血平灌胃可能会引起小鼠子宫、卵巢和肾上腺脏器指数发生变化,这可能与肾上腺能神经介质水平降低,负反馈性调节体内性激素水平升高,促使卵巢分泌更多的性激素,导致卵巢生理性增大相关[21]。 过量皮质激素可能会导致肾上腺组织发生皮质变薄、球状带和束状带变小、体积缩小、部分坏死等不良反应,故而实验结果显示氢化可的松组肾上腺脏器指数降低[7]。
现代研究发现,肾阴虚与下丘脑-垂体-靶腺轴(甲状腺、肾上腺)有关,环核苷酸(cAMP,cGMP)是细胞间第二信使,正常机体中cAMP 和cGMP 相互拮抗、相互制约,处于动态平衡状态,参与调节生物体不同的生理活动及生化代谢[22-24]。cAMP、cGMP 的平衡失调,会引起细胞功能明显改变,导致疾病的发生[25]。 血清cAMP 和cGMP 含量变化是目前判断肾阴虚证最常用的客观指标[9,26]。 实验结果显示,与对照组比较,甲状腺片组小鼠和大鼠血清cAMP 含量显著上升,差异有统计学意义。 联合组小鼠血清cAMP含量变化无明显差异,但cGMP 含量显著降低,且差异有统计学意义。 在大鼠实验中,实验结果显示,血清cGMP 含量显著升高,从而反映了联合组造模虽然可以减少模型制备时间,但模型稳定性有降低的风险。 本实验结果显示,小鼠给予氢化可的松灌胃后,血清cAMP、cGMP 含量虽有升高及降低趋势,但与对照组比较,差异无统计学意义,故而氢化可的松灌胃制备的肾阴虚证模型表征较差,且氢化可的松制备肾阴虚模型需要注意给药剂量及给药时间,低剂量可造成肾阳虚模型,而高剂量可制备肾阴虚动物模型[3,27]。 同时,肾上腺皮质类药物制备肾阴虚动物模型时,有时会出现前期表现为肾阴虚而后期表现为肾阳虚的现象,具有模型稳定性差的隐患[28]。
综上所述,甲状腺片灌胃小鼠、大鼠均可以较好地制备肾阴虚动物模型,肾阴虚模型表征明显,稳定性高,操作简单,且对子宫、卵巢、肾上腺等脏器影响较小,而甲状腺片联合利血平及氢化可的松灌胃造模具有一定的局限性。 因此,甲状腺片灌胃小鼠、大鼠是一种比较理想的肾阴虚模型制备方法,可用于中医药相关领域的深入研究。

