EPO、IL-1β、MMP-9/TIMP-1与烧伤患者瘢痕评分、创面愈合时间关系及对创面愈合质量的预测价值
王之学,肖继州,于强,杨书培,郭延民


[摘要]目的:探讨促红细胞生成素(Erythropoietin,EPO)、白介素-1β(Interleukin-1β,IL-1β)、基质金属蛋白酶-9/基质金属蛋白酶抑制剂-1(Matrix metalloproteinase-9/Tissue inhibitor of metalloproteinase-1,MMP-9/TIMP-1)与烧伤患者瘢痕评分、创面愈合时间关系及对创面愈合质量的预测价值。方法:选取2018年5月-2021年1月筆者科室收治的113例深Ⅱ度烧伤患者,采用削痂植皮联合外用重组人粒细胞-巨噬细胞刺激因子治疗,根据创面愈合质量分为良好组(n=88)、不良组(n=25),比较两组基线资料及治疗前、治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1,应用Pearson分析治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1与温哥华瘢痕量表(Vancouver scar scale,VSS)、创面愈合时间关系,采用多因素Logistic回归方程分析创面愈合质量的相关影响因素,采用受试者工作特征曲线(Receiver operating characteristic,ROC)及ROC下面积(Area under the curve,AUC)分析治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1,预测创面愈合质量价值。结果:不良组创面愈合时间、VSS评分数值均高于良好组(P<0.05);不良组治疗5 d、10 d后EPO低于良好组,IL-1β、MMP-9/TIMP-1高于良好组,差异均有统计学意义(P<0.05);治疗5 d、10 d后EPO与VSS评分、创面愈合时间呈负相关(P<0.05);治疗5 d、10 d后IL-1β、MMP-9/TIMP-1与VSS评分、创面愈合时间呈正相关(P<0.05);将创面愈合时间、VSS评分控制后,治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1仍与创面愈合质量相关(P<0.05);治疗10 d后EPO、IL-1β、MMP-9/TIMP-1的AUC大于治疗5 d后,且EPO、IL-1β联合MMP-9/TIMP-1的AUC大于任一单一指标。结论:EPO、IL-1β、MMP-9/TIMP-1与烧伤患者瘢痕评分、创面愈合时间、创面愈合质量有关,联合检测能为临床预测创面质量提供有效参考,并有望成为促进创面愈合、提高愈合质量的一个干预靶点。
[关键词]EPO;IL-1β;MMP-9/TIMP-1;烧伤;VSS评分;创面愈合时间;创面愈合质量
[中图分类号]R622 [文献标志码]A [文章编号]1008-6455(2023)04-0012-05
The Relationship of EPO,IL-1β,MMP-9/TIMP-1 with Scar Score,Wound Healing Time and Predictive Value of Wound Healing Quality in Burn Patients
WANG Zhixue,XIAO Jizhou,YU Qiang,YANG Shupei,GUO Yanmin
(Department of Burn Surgery,Liaocheng Second People's Hospital,Liaocheng 252600,Shandong,China)
Abstract: Objective To investigate the relationship between erythropoietin (EPO),interleukin-1β (IL-1β),matrix metalloproteinase-9/matrix metalloproteinase inhibitor-1 (MMP-9/TIMP-1) and scar scores of burn patients and the relationship between wound healing time and the predictive value of wound healing quality. Methods A total of 113 patients with deep second-degree burns admitted to our hospital from May 2018 to January 2021 were selected and treated with scab skin grafting combined with topical recombinant human granulocyte-macrophage stimulating factor.They were divided into good groups according to the quality of wound healing (n=88),poor group (n=25),compare the baseline data of the two groups,before treatment,5 days after treatment,and 10 days after treatment for EPO,IL-1β,MMP-9/TIMP-1,and Pearson analysis treatment 5 The relationship between EPO,IL-1β,MMP-9/TIMP-1 and Vancouver Scar Scale (VSS),wound healing time after 10 days of treatment,and the related influencing factors of wound healing quality analyzed by multivariate logistic regression equation.The receiver operating characteristic curve (ROC) and the area under the ROC (AUC) were used to analyze the value of EPO,IL-1β,MMP-9/TIMP-1 in predicting the quality of wound healing after 5 days of treatment and 10 days after treatment. Results The wound healing time and VSS score of the bad group were higher than those of the good group (P<0.05); the EPO of the bad group was lower than that of the good group after 5 days of treatment and 10 days after treatment,and IL-1β and MMP-9/TIMP-1 were higher than the good group,the differences were statistically significant (P<0.05); EPO was negatively correlated with VSS score and wound healing time after 5 days of treatment and 10 days of treatment (P<0.05); IL-1β,MMP-9/ TIMP-1 was positively correlated with VSS score and wound healing time (P<0.05); after controlling the wound healing time and VSS score,EPO,IL-1β,MMP-9/TIMP-1 after 5 days of treatment and 10 days after treatment It is still related to the quality of wound healing (P<0.05); the AUC of EPO,IL-1β,MMP-9/TIMP-1 after 10 days of treatment is greater than that of 5 days after treatment,and EPO,IL-1β combined with MMP-9/TIMP- The AUC of 1 is greater than any single index. Conclusion EPO,IL-1β,MMP-9/TIMP-1 are related to the scar score,wound healing time,and wound healing quality of burn patients.The combined detection can provide an effective reference for clinical prediction of wound quality,and is expected to promote wound healing and improve healing an intervention target for quality.
Key words: erythropoietin; interleukin-1β; matrix metalloproteinase-9/Tissue inhibitor of metalloproteinase-1; burns; vancouver scar scale; wound healing time; wound healing quality
燒伤创面愈合时间、愈合质量与患者住院时间、住院费用及出院后心理压力、生活质量等密切相关,故研究烧伤创面愈合质量、愈合时间的相关机制,早期预测创面愈合质量意义重大[1]。新生血管形成、炎症反应、细胞外基质合成与分解是创面愈合时间及质量的关键环节,其中丰富新生血管可为创面愈合提供充足养分,炎症反应是创面愈合必经环节,细胞外基质合成与分解是肉芽组织修复过程的一项重要生理活动,因此推测能反映以上过程的指标可能有助于创面愈合情况的评估。EPO是骨髓中血红细胞前驱细胞因子,能促进红细胞产生和血管新生,烧伤治疗后EPO会升高[2]。IL-1β系炎症细胞因子,在烧伤创面中表达高于正常皮肤[3]。MMP-9可降解细胞外基质,TIMP-1是MMP-9特异性抑制剂,MMP-9/TIMP-1可反映两者平衡状态,在压疮创面愈合过程中,MMP-9/TIMP-1呈降低趋势,对创面愈合具有一定预测价值[4-5]。本研究通过观察EPO、IL-1β、MMP-9/TIMP-1动态变化,探讨各指标在创面愈合中作用及应用价值,以期为临床缩短创面愈合时间,提高创面愈合质量提供参考,现报道如下。
1 资料和方法
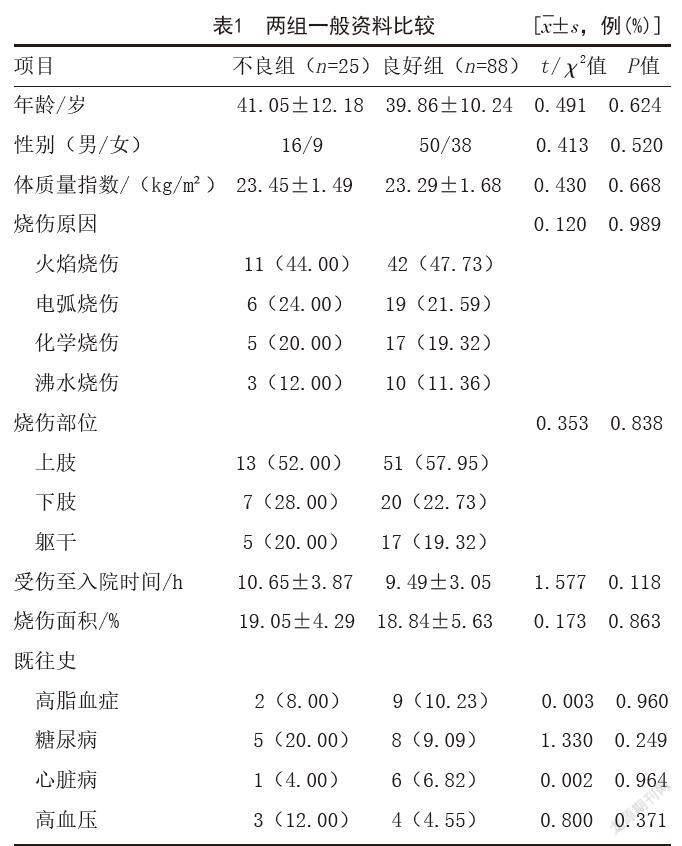
1.1 一般资料:选取2018年5月-2021年1月笔者科室收治的113例深Ⅱ度烧伤患者为研究对象,采用削痂植皮联合外用重组人粒细胞-巨噬细胞刺激因子治疗,根据创面愈合质量分为良好组(n=88)、不良组(n=25),两组年龄、性别、体质指数、烧伤原因、烧伤部位、受伤至入院时间、烧伤面积、既往史比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 纳入标准:深Ⅱ度烧伤者;单个肢体烧伤;无急性心脑血管疾病;无严重外伤史。
1.3 排除标准:放射性烧伤者;妊娠期女性;合并感染类疾病者;皮肤病者;肾、肺、心功能严重不全者;不能配合治疗者;血液系统疾病者;长期应用免疫抑制剂者。
1.4 方法
1.4.1 治疗方法:采用削痂植皮联合外用重组人粒细胞-巨噬细胞刺激因子治疗,先清创,待皮下水肿界限清晰时开始植皮。以2 cm间距经创面痂下点状注射1:20万单位肾上腺素盐水肿胀液,滚轴刀削除创面变性真皮,创面颜色与正常接近后电凝止血,冲洗创面,用自体大张中厚皮片移植,供皮区止血后覆盖藻酸盐敷料,并在创面涂抹外用重组人粒细胞-巨噬细胞刺激因子,2~3 d换药1次,同时给予抗生素常规预防感染。
1.4.2 分组方法:治疗后6个月,根据创面愈合质量进行分组,创面愈合质量优、良者归入良好组,创面愈合质量差者归入不良组。评价标准:烧伤部位愈合,皮肤颜色与正常皮肤相当,无瘢痕、色素沉着者为优;烧伤部位愈合,色素沉着面积小,轻微瘢痕者为良;烧伤部位皮肤色素沉着和增生性瘢痕明显者为差。
1.5 观察指标
1.5.1 VSS评分、创面愈合时间:治疗后6个月,应用VSS[6]评估瘢痕情况,包括色泽、厚度、柔软度、血管分布等,总分15分,分值与瘢痕增生程度呈正相关。创面愈合标准:创面双氧水试验阴性、创面完全由上皮组织覆盖、无渗出物。
1.5.2 EPO、IL-1β、MMP-9、TIMP-1水平:于治疗前、治疗5 d、10 d后分别采集患者肘部静脉血5 ml,3 000 r/min离心15 min,分离上清,-20℃下保存待测。采用酶联免疫吸附法和酶标仪(美国Ray Biotech Inc公司Eonc型)检测EPO、IL-1β、MMP-9、TIMP-1水平。
1.6 统计学分析:采用SPSS 24.0分析数据,计量资料以(x?±s)表示,行t检验;不同时间点、组别交互作用下EPO、IL-1β、MMP-9/TIMP-1采用重复测量方差分析法检验;计数资料以[例(%)]表示,行χ2检验;应用Pearson分析治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1与VSS评分、创面愈合时间关系;采用多因素Logistic回归方程分析创面愈合质量的相关影响因素;采用ROC及AUC分析治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1预测创面愈合质量价值,以P<0.05为差异有统计学意义。
2 结果
2.1 两组VSS评分、创面愈合时间比较:治疗后6个月,不良组创面愈合时间、VSS评分数值均高于良好组(P<0.05)。见表2。
2.2 两组EPO、IL-1β、MMP-9/TIMP-1比较:EPO、IL-1β、MMP-9/TIMP-1在组间、时间及组间和时间交互作用下比较,采用重复测量方差检验,差异有统计学意义(P<0.05)。组内比较:两组IL-1β治疗5 d后升高,治疗10 d后呈降低趋势(P<0.05);两组EPO治疗5 d、10 d后较治疗前升高(P<0.05),MMP-9/TIMP-1较治疗前降低,差异均有统计学意义(P<0.05)。组间比较:两组治疗前EPO、IL-1β、MMP-9/TIMP-1比较,差异均无统计学意义(P>0.05);不良组治疗5 d、10 d后EPO低于良好组,IL-1β、MMP-9/TIMP-1高于良好组,差异均有统计学意义(P<0.05)。见表3。
2.3 EPO、IL-1β、MMP-9/TIMP-1与VSS评分、创面愈合时间的关系:以两组治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1为源数据,应用Pearson进行相关性分析。结果显示,治疗5 d、10 d后,EPO与VSS评分、创面愈合时间呈负相关(P<0.05),IL-1β、MMP-9/TIMP-1与VSS评分、创面愈合时间呈正相关(P<0.05)。见表4。
2.4 多因素分析:因变量为创面愈合质量是否良好,良好=0,不良=1;自变量为治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1,低于两组均值赋值1,高于两组均值赋值2。两组治疗5 d后EPO、IL-1β、MMP-9/TIMP-1均值分别为13.72 U/L、20.97 ng/ml、20.89,治疗10 d后EPO、IL-1β、MMP-9/TIMP-1均值分别为18.44 U/L、16.81 ng/ml、16.96。应用多因素Logistic回归分析,结果显示,将创面愈合时间、VSS评分控制后,治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1仍与创面愈合质量相关(P<0.05)。见表5。
2.5 EPO、IL-1β、MMP-9/TIMP-1预测创面愈合质量的ROC:阳性样本为不良组治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1;阴性样本为良好组治疗5 d、10 d后EPO、IL-1β、MMP-9/TIMP-1,绘制ROC曲线。结果显示,治疗10 d后EPO、IL-1β、MMP-9/TIMP-1的AUC大于治疗5 d后,且EPO、IL-1β联合MMP-9/TIMP-1的AUC大于任一单一指标。見图1、表6。
3 讨论
目前尚缺乏预测创面愈合质量的方法。EPO具有多种功能,除促进红细胞生成外,在组织缺氧条件下,可结合受体,抑制细胞凋亡,诱导新生血管形成[7-8]。本研究显示,不良组治疗5 d、10 d后EPO低于良好组,与VSS评分、创面愈合时间呈负相关,提示EPO越高,创面愈合越快,创面愈合质量越高。Wu SH等[9]报道,每周一次EPO治疗能预防和改善烧伤后肌肉萎缩,促进创面愈合,提高创面愈合质量;王乡宁等[10]研究显示,与创面愈合较慢者比较,创面愈合较快者治疗后2周、治疗后4周EPO升高,均证实了EPO在创面愈合速度和质量中起到重要作用。一方面EPO促进新生血管形成作用,另一方面EPO能通过改善氧化应激,抑制创面氧化应激反应,为创面愈合创造条件[11]。结合本研究结果推测,对创面愈合不良患者,注射EPO可能有利于促进新生血管形成,为肉芽组织、创面微循环、创面修复等创造条件,从而加快创面愈合,改善创面愈合质量,但受限于观点的新颖性,仍需后续报道的进一步论证。ROC分析显示,治疗10 d后EPO预测创面愈合不良的AUC为0.816,大于治疗5 d后,且大于0.8,提示检测治疗10 d后EPO预测创面愈合不良的价值较高,能为临床提供有效参考信息。
炎症反应是创面愈合的必经阶段,适当的炎症反应可清除坏死细胞,加快愈合,但过度炎症反应则可导致瘢痕组织过度增生、延缓创面愈合。IL-1β是炎症反应中常见一种细胞因子,邱荣等[12]报道,瘢痕增生组织中IL-1β表达高于正常皮肤,与增生性瘢痕形成有关。且在慢性难愈性创面中,IL-1β明显升高,是导致创面迁延未愈的重要原因[13]。本研究发现,两组IL-1β治疗5 d后升高,治疗10 d后呈降低趋势,这种变化趋势与创面愈合经历的三个阶段相符,且良好组低于不良组,表明IL-1β与烧伤创面愈合质量有关。烧伤创面常有大量坏死、变性组织、血小板和纤维蛋白沉淀形成的止血血凝块,可导致局部炎症反应,释放IL-1β等炎性细胞因子,导致IL-1β升高,且大量合成的IL-1β又可介导白介素-6、肿瘤坏死因子-α的合成与释放,加重局部炎症反应,从而影响创面愈合时间和愈合质量[14]。治疗5 d、10 d后IL-1β预测创面愈合不良的AUC分别为0.629、0.775,呈递增趋势,提示治疗10 d后IL-1β预测价值较高,预测信息更具参考性。因此在创面愈合过程中,应动态监测炎症反应情况,若能巧妙把控好炎症反应,使其既能及时清除坏死细胞,又能避免过度炎症反应引起的包含组织过度增生,可保证创面在最短时间内,以较高的质量愈合。
MMP-9、TIMP-1可调节细胞外基质合成、分解,其中MMP-9作用底物主要是胶原和明胶,起到降解作用,TIMP-1则能抑制MMP-9活性[15-16]。现阶段关于MMP-9/TIMP-1在烧伤创面愈合中变化的研究较少,本研究显示,与良好组比较,不良组治疗5 d、10 d后MMP-9/TIMP-1升高,并与VSS评分、创面愈合时间呈正相关,表明MMP-9/TIMP-1与创面瘢痕情况、愈合时间及愈合质量有关。皮肤烧伤形成创面后,MMP-9被激活,形成初始蛋白水解环境,TIMP-1处于低表达状态,为创面凝血、创面收缩、软组织再生、新肉芽形成提供条件,故烧伤初期MMP-9/TIMP-1较高,治疗后创面经历凝血期、炎症期,随着创面愈合和炎症消退,TIMP-1被激活,TIMP-1升高,抑制了MMP-9表达,MMP-9表达量降低,即MMP-9/TIMP-1降低,因此MMP-9/TIMP-1降低是创面愈合的一个标志物[17]。后续ROC分析显示,治疗5 d、10 d后MMP-9/TIMP-1预测创面愈合不良的AUC分别为0.797、0.819,呈现出一定预测价值,但治疗10 d后EPO、IL-1β联合MMP-9/TIMP-1的AUC最大,所以建议联合检测治疗10 d后EPO、IL-1β、MMP-9/TIMP-1,为临床预测创面愈合质量提供更可靠的参考。由于大多深Ⅱ度烧伤患者6个月内创面愈合情况已基本稳定,故本研究观察时间为6个月,而各指标对更长期的预测效果尚不明确,这是本研究不足所在,有待后续的研究探讨。
综上,EPO、IL-1β、MMP-9/TIMP-1与烧伤患者瘢痕评分、创面愈合时间、创面愈合质量有关,联合检测能为临床预测创面质量提供有效参考,并有望成为促进创面愈合、提高愈合质量的一个干预靶点。
[参考文献]
[1]苏永涛,顾国明,隋颖,等.慢性难愈合创面早期防控体系建设探索[J].中国烧伤创疡杂志,2021,33(3):185-188.
[2]黄新灵,周忠志,邹梅林,等.远红外频谱照射联合水凝胶敷料治疗烧伤创面的效果及对血清EPO和TGF-α表达的影响[J].中国美容医学,2020,29(8):96-101.
[3]王瑶,周薇,沈犁,等.穿心莲内酯增强庆大霉素对小鼠烧伤创面感染的防治研究[J].重庆医科大学学报,2020,45(2):200-205.
[4]Li H,Shi K,Zhao Y,et al.TIMP-1 and MMP-9 expressions in COPD patients complicated with spontaneous pneumothorax and their correlations with treatment outcomes[J].Pak J Med Sci,2020,36(2):192-197.
[5]王越,李贤,赵伟,等.Ⅲ期和Ⅳ期压疮患者创面愈合过程中基质金属蛋白酶9与其抑制剂蛋白表达及两者比值变化[J].中华烧伤杂志,2019,35(10):746-751.
[6]Lee K C,Bamford A,Gardiner F,et al.Burns objective scar scale (BOSS):Validation of an objective measurement devices based burn scar scale panel[J].Burns,2020,46(1):110-120.
[7]Hamed S,Belokopytov M,Ullmann Y,et al.Interim results of the remeded'or study:a multicenter,single-blind,randomized,controlled trial to assess the safety and efficacy of an innovative topical formulation of erythropoietin for treating diabetic foot ulcers[J].Adv Wound Care (New Rochelle),2019,8(10):514-521.
[8]Wu S H,Lu I C,Lee S S,et al.Erythropoietin attenuates motor neuron programmed cell death in a burn animal model[J].PLoS One,2018,13(1):e0190039.
[9]Wu S H,Lu I C,Tai M H,et al.Erythropoietin alleviates burn-induced muscle wasting[J].Int J Med Sci,2020,17(1):33-44.
[10]王鄉宁,黄雷,邓利,等.烧伤患者肢体Ⅲ度创面组织恢复过程中EPO、TGFβ1及受体表达[J].东南大学学报(医学版),2019,38(1):118-125.
[11]Imam R A,Rizk A A.Efficacy of erythropoietin-pretreated mesenchymal stem cells in murine burn wound healing:possible in vivo transdifferentiation into keratinocytes[J].Folia Morphol (Warsz),2019,78(4):798-808.
[12]邱荣,雷可,李艳,等.Toll样受体4与炎性细胞因子在烧伤后增生性瘢痕组织中的表达及临床意义[J].陕西医学杂志,2020,49(12):1543-1548.
[13]汪涟,郭菲,闵定宏,等.炎症与修复相关细胞因子基因在临床慢性难愈性创面中差异表达的分析[J].中华烧伤杂志,2019,35(1):18-24.
[14]Oryan A,Alemzadeh E,Eskandari M H.Kefir accelerates burn wound healing through inducing fibroblast cell migration in vitro and modulating the expression of IL-1?,TGF-?1,and BFGF genes in vivo[J].Probiotics Antimicrob Proteins,2019,11(3):874-886.
[15]Yu J,Sun G,Chen Y,et al.CEACAM1 inhibited IκB-α/NF-κB signal pathway via targeting MMP-9/TIMP-1 axis in diabetic atherosclerosis[J].J Cardiovasc Pharmacol,2020,76(3):329-336.
[16]Wieczór R,Wieczór A M,Kulwas A,et al.Coexistence of proangiogenic potential and increased MMP-9,TIMP-1,and TIMP-2 levels in the plasma of patients with critical limb ischemia[J].J Zhejiang Univ Sci B,2019,20(8):687-692.
[17]宋美毅,李贤.基质金属蛋白酶9、基质金属蛋白酶抑制剂1在大鼠Ⅲ期、Ⅳ期压疮创面组织中的表达及意义[J].护理研究,2020,34(21):3759-3763.
[收稿日期]2021-07-22
本文引用格式:王之学,肖继州,于强,等.EPO、IL-1β、MMP-9/TIMP-1与烧伤患者瘢痕评分、创面愈合时间关系及对创面愈合质量的预测价值[J].中国美容医学,2023,32(4):12-16.

