水热法制备MnO2活化过硫酸盐降解水中的四环素
杜蕊含,尚 丹,蒋 欣,王 洋,康春莉
(1.吉林大学 新能源与环境学院,长春 130012; 2.中国科学院东北地理与农业生态研究所 湿地生态与环境重点实验室,长春 130102)
四环素类抗生素(tetracycline antibiotics,TCs)是一类广谱抗生素,生产和使用量均较大[1].常见的TCs包括四环素(tetracyclines,TC)、土霉素(oxytetracycline,OTC)和金霉素(chlortetracycline,CTC).人体和动物摄入的TCs只有部分被吸收利用,剩余部分会以代谢物的形式排放到环境中,导致环境污染,因此,有效处理TCs是当前急需解决的环境问题.高级氧化技术(advanced oxidation processes,AOPs)依靠反应中产生的强氧化自由基快速有效地降解有机污染物,是一种有效的废水处理方法[2],目前利用Fenton氧化和电化学氧化等技术处理TCs废水已取得了较好的效果[3-5].

相对于其他过硫酸盐的非均相活化剂,锰基材料具有在地壳中含量丰富、价格便宜、环境友好和低毒性等优势.Liang 等[16]首次将锰基材料(MnO2)用于过硫酸盐的活化,并发现其具有良好的活化性能.之后,越来越多的锰氧化物(MnOx)被用作过硫酸盐的活性剂.MnOx是废水处理中传统且经济有效的吸附剂和氧化剂[17],在活化PMS/PS方面表现出极大的潜力[18].其中,MnO2具有较强的氧化性,能够活化PMS/PS,高效去除有机污染物[18-19].MnOx表面的Mn(Ⅱ)、Mn(Ⅲ)和Mn(Ⅳ)之间的转化是PMS激活的主要因素[18-20].由于不同的电子和几何排布,因此不同晶相结构MnO2的催化活性也有差异.Huang等[18]合成了不同结构的MnO2(隧道结构的α-,β-,γ-MnO2和层状结构δ-MnO2),发现不同相结构MnO2对PMS降解污染物的活化顺序不同.此外,对不同形貌和晶相MnO2活化PMS的能力进行了对比,发现 MnO2的结晶度是影响催化反应活性的主要因素[21-22].水热法是合成MnO2的经典方法,通常采用无机锰(Ⅱ)盐与其他无机盐反应制备,包括Mn(AC)2[18],MnCO3[23],MnCl2[24]和MnSO4[25]等.但无机锰(Ⅱ)盐的种类对制备出的MnO2活化PMS的影响尚不清楚.
MnO2在活化PMS/PS高效去除有机污染物的应用较多,但关于MnO2活化PMS降解TCs的研究目前尚未见文献报道.基于此,本文以常见的四环素类抗生素(TC,OTC和CTC)为目标污染物,采用MnSO4,MnCl2和Mn(NO3)23种无机锰(Ⅱ)盐作为原材料,通过水热反应制备MnO2,并对其活化PMS降解不同种类的TCs效果进行研究.分析无机锰(Ⅱ)盐种类对所制备MnO2活化能力的影响机理,考察污染物初始质量浓度、催化剂投加量、PMS浓度、溶液pH值以及共存阴离子对TCs降解的影响,提出MnO2活化PMS降解TCs的作用机理,为SR-AOPs处理TCs的实际应用提供理论依据.
1 材料与方法
1.1 试 剂
高锰酸钾(KMnO4)购自天津新通精细化工有限公司,硝酸锰(Mn(NO3)2)和无水乙醇(CH3CH2OH)购自北京化工厂,一水合硫酸锰(MnSO4·H2O)、氯化亚锰(MnCl2·4H2O)和叔丁醇(C4H10O)购自国药集团,甲醇(CH3OH)购自费希尔化学品公司,迭氮钠(NaN3)购自天津风船化学试剂有限公司,盐酸四环素(C22H24N2O8·HCl)、盐酸土霉素(C22H24N2O9·HCl)和盐酸金霉素(C22H23ClN2O8·HCl)购自美国Aladdin公司.所有试剂均为分析纯试剂,实验用水为自制超纯水(≥18.2 MΩ·cm).
1.2 MnO2的制备与表征
MnO2制备方法参考文献[26].将0.002 4 mol MnSO4/MnCl2/Mn(NO3)2与0.001 6 mol KMnO4溶解于15 mL自制蒸馏水中,磁力搅拌0.5 h,倒入反应釜中,密封,于150 ℃反应6 h,待反应结束后,冷却至室温,固体产物分别用蒸馏水和无水乙醇洗涤,在6 000 r/min下用高速离心机离心5 min,固体于70 ℃干燥得到最终产物MnO2.
1.3 MnO2的表征
用X射线衍射仪(XRD,D8 ADVANCE型,德国Bruker公司)分析产物的晶型结构、晶型参数和衍射面等信息.用扫描电子显微镜(SEM,XL-30 ESEM FEG型,美国Fei公司)观察材料的表面形貌.用X射线光电子能谱(XPS,Thermo ESCALAB 250型,美国赛默飞世尔科技公司)分析元素的价态.
1.4 TCs降解实验
在锥形瓶中加入100 mL的50 mg/L TC(或OTC或CTC)溶液和0.1 g/L的MnO2催化剂,充分搅拌均匀后,加入PMS溶液使其浓度为0.15 mmol/L并开始计时.分别在5,10,20,30,45,60 min时准确移取1 mL反应液,加入1 mL的1 mol/L甲醇终止反应,用0.22 μm滤头过滤,以待测试.
1.5 分析方法
用高效液相色谱仪(HPLC,LC-20A型,日本岛津实验器材有限公司)测量TCs的浓度.色谱柱为InertSustain C18柱(4.6 mm×150 mm,5 μm),流动相中的水相和有机相为0.01 mol/LV(草酸)∶V(乙腈)=3∶1,流速为1.0 mL/min,进样量为20 μL,柱温为25 ℃.TC,OTC和CTC的检测波长分别为355,355,365 nm.
2 结果与讨论
2.1 MnO2的XRD和SEM表征

图1 样品MnO2的XRD谱Fig.1 XRD patterns of sample MnO2
将KMnO4分别与MnSO4,MnCl2和Mn(NO3)2为原材料制备的MnO2命名为MnO2(1),MnO2(2)和MnO2(3),图1为3种MnO2的XRD谱.由图1可见,3种MnO2的XRD谱中衍射峰明显且尖锐,表明制备的MnO2的结晶度和纯度均较高.由曲线a可见,在2θ=12.7°,18.0°,25.5°,28.7°,36.6°,37.5°,41.9°,49.8°,52.7°,56.1°,60.1°,65.3°,69.4°,72.9°处出现了明显的衍射峰,通过MDI Jade 5软件进行对比分析,这些峰与MnO2的PDF 44-0141标准卡片吻合,分别对应(110),(200),(220),(310),(400),(211),(301),(411),(440),(600),(521),(002),(541)和(312)晶面,为α-MnO2[19].曲线b和曲线c的出峰位置较一致,且峰强度相当.曲线a中存在的衍射峰在曲线b,c上均存在,但峰强度减弱,而曲线b,c在22.1°处明显多出一个峰.比对证明该峰属于γ-MnO2的峰(PDF 44-0142),因此MnO2(2)和MnO2(3)除了含有α-MnO2外,还含有一定数量的γ-MnO2.研究表明,不同原料和合成条件制备的MnO2在晶相和结晶度方面均具有明显差异[21,24],5种晶型的MnO2均有可能生成.
图2为3种MnO2的SEM照片.由图2(A),(D)可见,MnO2(1)由直径约为50 nm、长短不同的纳米棒构成.由图2(B),(E)和图2(C),(F)可见,MnO2(2)和MnO2(3)的形貌较相似,主要由纳米棒状结构组成,但在纳米棒上出现了一些小的纳米片.结合XRD谱,出现片状结构可能是由于生成了一部分γ-MnO2所致.

图2 样品的SEM照片Fig.2 SEM images of samples
2.2 MnO2催化性能的对比
3种MnO2的催化效果如图3所示.由图3可见: 60 min内MnO2对TC的去除率较低,小于5%; 单独的PMS对TC有较好的去除能力,去除率为38.2%,这是因为PMS本身具有一定的氧化能力,可氧化去除污染物; 加入MnO2催化剂后,体系对TC的去除效果明显提升,3种MnO2催化PMS去除TCs的最高去除率分别为56.8%(MnO2(1)),47.1%(MnO2(2))和51.9%(MnO2(3)).显著性差异分析表明,MnO2(1),MnO2(2)和MnO2(3)活化PMS降解TC的3组数据间具有显著性差异,P值均小于0.05.以KMnO4和MnSO4为原材料制备的MnO2(1)略好于MnO2(2)和MnO2(3)的催化效果.由表征分析结果可知,MnO2(1)的结晶性为α-MnO2,而MnO2(2)和MnO2(3)除含有α-MnO2外,还含有一定数量的γ-MnO2.MnO2的PMS活化能力取决于它的价态、形貌和晶相[27],结晶较多的MnO2更具反应性,不同晶型的MnO2活化PMS的顺序为:α-MnO2>γ-MnO2>β-MnO2>δ-MnO2[18],所以MnO2(1)具有最好的降解效果.由于MnO2(2)和MnO2(3)的结构组成与形貌相近,因此其催化效果也相近.在后续实验中,以催化效果最佳的MnO2(1)为催化剂进一步开展研究.
2.3 MnO2催化PMS去除TC的机理
2.3.1 活性氧基团的作用


图3 不同体系降解效果的对比Fig.3 Comparison of degradation effectsof different systems
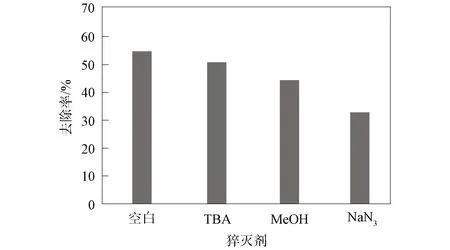
图4 不同猝灭剂对TC降解的影响Fig.4 Effects of different quenching agents on degradation of TC
2.3.2 反应前后XPS对比

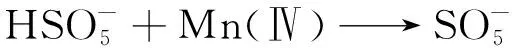
(1)


(2)


图5 样品的XPSFig.5 XPS of samples
2.3.3 催化机理分析

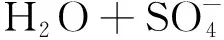
(3)


(4)
反应生成了1O2[38]; ·OH通过自反应生成1O2[39]的反应式为

(5)

2.4 MnO2催化去除TC的影响因素
2.4.1 MnO2投加量、PMS浓度和TC初始质量浓度的影响

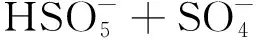
(6)
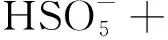
(7)

(8)
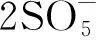
(9)
综上,选择0.15 mmol/L的PMS和0.10 g/L的MnO2作为最佳试剂用量.在PMS和MnO2用量一定的条件下,当TC初始质量浓度从25 mg/L增加到100 mg/L时,60 min内降解率从79.5%下降到40%(图6(C)),为方便对比分析,后续实验中TC的质量浓度均为50 mg/L.

图6 不同实验参数对TC降解的影响Fig.6 Effects of different experimental parameters on degradation of TC
2.4.2 pH值的影响


(10)
导致自由基自消耗,进而影响与TC的反应.
当初始pH=9时,体系的TC去除效果最佳,为63.4%.自由基猝灭实验结果表明,1O2是该体系降解TC的主要活性物质,在碱性条件下反应过程中会产生更多的1O2[39],从而提高了去除效果.
2.4.3 共存离子的影响

(11)
溶液为碱性可提高PMS的催化活性,从而提高TC的去除率.
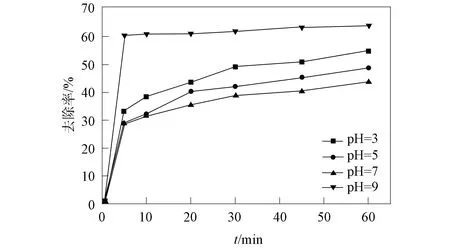
图7 初始pH值对TC降解的影响Fig.7 Effects of initial pH values on degradation of TC

图8 不同离子对TC降解的影响Fig.8 Effects of different ions on degradation of TC
2.5 催化剂的重复利用性
在每次反应结束后,将分离得到的催化剂用适量蒸馏水洗涤,离心、干燥后,重新用于催化反应.MnO2的重复利用性如图9所示.由图9可见,MnO2循环使用5次后TC去除率由55.8%降为50.9%,仅下降4.9%,表明所制备的MnO2催化剂具有良好的重复利用性.去除率略有下降的原因可能是因为有少量锰离子溶出或有少量污染物占据了催化剂活性位点[40].
2.6 MnO2催化PMS去除不同TCs
为检验 MnO2在实际应用中的潜力,比较MnO2/PMS体系对TC,OTC和CTC的去除效果,结果如图10所示.虽然TC,OTC和CTC的分子结构基本相同,但所含基团存在一定的差异,导致去除效果不同.由图10可见: CTC的去除效果最佳,达到75.1%; OTC的去除效果最差,为45.3%.这是由于CTC的结构中比TC多一个—Cl,降解时易脱氯,因此较活泼; 而OTC比TC多一个—OH,羟基间易形成缔合物使其难以吸附在催化剂的表面,从而抑制其降解[46].虽然体系对3种TCs的去除率不同,但所制备的MnO2能有效催化PMS去除水中多种TCs.
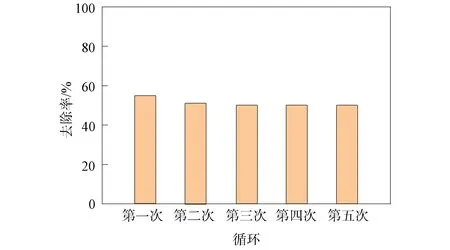
图9 MnO2的循环试验Fig.9 Cyclic experiment of MnO2

图10 不同TCs的降解效果Fig.10 Degradation effects of different TCs
综上所述,本文采用水热法,分别利用MnSO4,MnCl2和Mn(NO3)2为原料制备MnO2,并将其用于活化PMS降解TCs,通过材料表征和模拟实验,分析了无机锰(Ⅱ)盐种类对所制备MnO2活化能力的影响机理,考察了污染物初始质量浓度、催化剂投加量、PMS浓度、溶液pH值以及共存阴离子对TC降解的影响,提出了MnO2活化PMS降解TCs的作用机理.结果表明,以MnSO4为原料制备的MnO2为α-MnO2晶相,结晶度较高,具有最佳催化效果,在60 min内对50 mg/L TC的去除率为56.8%.催化剂和PMS投加量的增加均会促进TC降解,催化剂在碱性条件下以及有阴离子共存的溶液中具有良好的适应性.通过猝灭实验和反应前后XPS分析,发现TC的去除机理包括自由基途径和非自由基途径,1O2是主要活性物质,催化过程中MnO2通过Mn(Ⅳ)/Mn(Ⅲ)循环活化PMS.MnO2催化剂性能稳定,使用5次后,去除率仅下降4.9%.在最佳条件下,MnO2/PMS对CTC和OTC的去除效果分别为75.1%和45.3%,表明MnO2/PMS对TCs具有普遍的适用性.

