缓释淀粉对于重症急性胰腺炎合并应激性高血糖患者血糖变异性的影响
张 泓, 李 磊, 吴璟奕, 黄 洁
(上海交通大学医学院附属瑞金医院重症医学科,上海 200025)
重症急性胰腺炎(severe acute pancreatitis, SAP)是发病急骤、病情进展快、并发症多,死亡率高的一种常见危重病[1]。由于此疾病早期发生强烈的全身应激反应,故易引起机体内环境急剧变化,其中应激性高血糖是比较常见的并发症[2]。过度升高的血糖不仅会激活更多的炎症因子,而且也会影响胰腺炎的治疗效果及预后[3]。因此,有效平缓地控制血糖变化是管理重症急性胰腺炎重要的组成部分[4]。目前临床上急性胰腺炎患者使用的肠内营养制剂多以麦芽糖糊精等短肽作为主要成分,由于易于分解吸收,故容易造成使用后血糖明显升高[5],高血糖会增加感染等不良事件发生[6]。研究表明,相对于平均血糖价值来说,血糖的变异性是患者死亡的独立影响因素,降低患者的血糖变异性是血糖管理的核心内容[7]。因此,合理的肠内营养应用,不仅需要给机体提供必要的能量来源,改善肠道微生态,同时也应该在血糖管理(尤其血糖变异性)方面发挥重要作用。
含缓释淀粉的肠内营养乳剂,采用木薯淀粉、谷物淀粉和果糖作为糖类的来源,并加入膳食纤维,是糖尿病和应激性高血糖患者理想的营养制剂。本研究回顾性分析重症急性胰腺炎合并应激性高血糖患者应用含(或者不含)缓释淀粉的制剂进行肠内营养支持,重在探讨治疗过程中其对血糖变异性、营养指标及预后的影响。
1 资料与方法
1.1 一般资料
选择2018年1月—2021年12月上海交通大学医学院附属瑞金医院重症医学科收治的重症急性胰腺炎合并应激性高血糖患者149例,其中男性98例,女性51例;年龄2082岁,平均(52.3±7.6)岁;入选标准: SAP诊断标准符合2019年世界急诊外科学会关于急性胰腺炎国际指南中的诊断和分级标准[8]。年龄>18岁患者。应激性高血糖: 入院时至开始肠内营养前,至少出现1次随机血糖>11.1 mmol/L。排除标准: (1) 存在肠内营养禁忌证;(2) 对肠内营养制剂成分过敏: (3) 肠内营养治疗<1周;(4) 近期存在降糖类药物、激素类药物治疗史;(5) 既 往存在糖尿病、肾上腺功能性疾病、甲状腺亢进等影响机体血糖代谢的病史。
1.2 研究分组
根据入选患者在治疗过程中,以是否使用含缓释淀粉的制剂进行肠内营养支持分组,持续滴注含缓释淀粉营养制剂(瑞代,能量密度为0.9 kcal/mL,由华瑞制药有限公司生产)的72例患者为观察组,持续滴注标准型营养制剂(整蛋白型或者短肽型,能量密度为1 kcal/mL,由纽迪西亚有限公司生产)的77例患者为对照组。两组患者的年龄、性别、体重指数(body mass index, BMI)、入科急性生理慢性健康评分(APACHE Ⅱ评分)、序贯器官衰竭评分(SOFA评分)、胰腺炎发病的原因等一般资料比较差异均无统计学意义(均P≥0.05),说明两组资料均衡,有可比性,见表1。
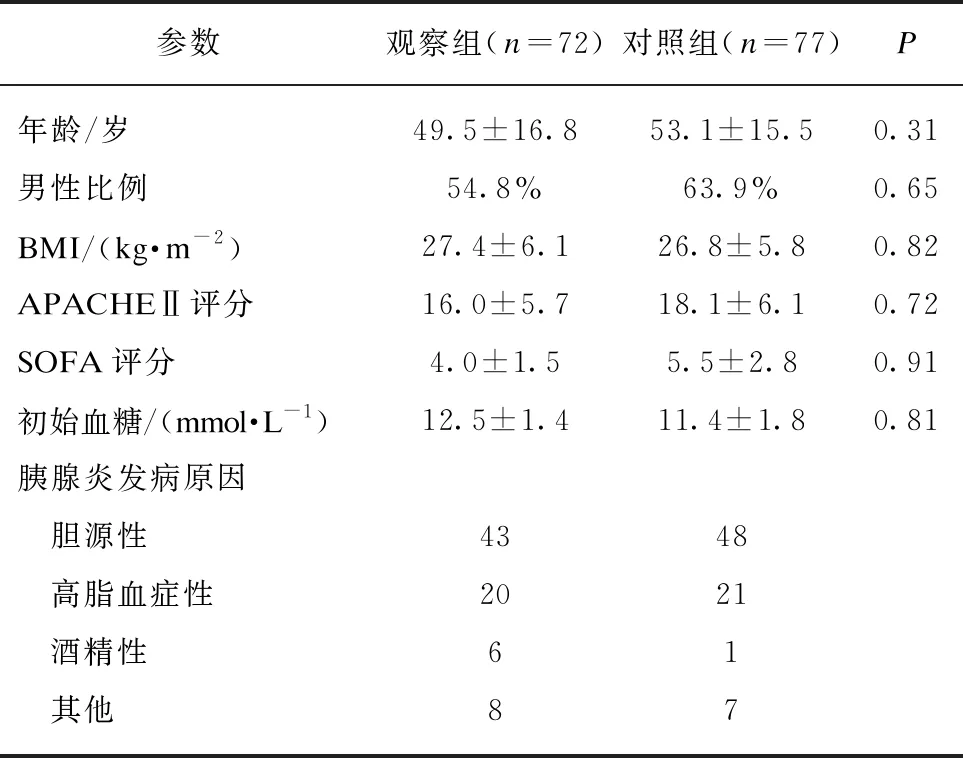
表1 两组入组时一般情况对比
1.3 营养治疗方案
所有患者收治重症医学科后,均予规范化重症急性胰腺炎集束化治疗包括禁食、胃肠减压,疏通肠道,液体复苏,脏器支持,预防感染,降低腹内压等处理。入选所有患者均在肠功能恢复后通过盲插或X线下导引,将鼻肠营养管经胃、幽门插至屈氏韧带以下,经X线确认营养管正确后给予肠内营养。根据患者实际体重计算患者的理想热量,并按理想体重供给热量,初始鼻肠管缓慢鼻饲营养制剂,第1天肠内营养治疗给于30%40%营养供给,第2天增至60%70%,第3天逐步增加80%至足量营养热量,连续营养支持治疗14 d以上。观察组给予含缓释淀粉的营养制剂;对照组给予标准型营养制剂。每日记录肠内营养的剂量及肠内营养过程中不良反应的情况,比如胃肠道耐受性、腹痛、腹泻、腹胀便秘等。每4 h监测毛细血管末梢血糖1次,若患者出现严重高血糖≥15.0 mmol/L,给予皮下注射短效胰岛素治疗,目标血糖控制在1012 mmol/L左右。
1.4 观察指标
统计两组患者治疗前及治疗2周后血糖的变异性[平均血糖(average value of blood glucose, GLU AVE)、血糖标准差(standard deviation of blood glucose, GLU SD)、血糖变异系数(coefficient of variation of blood glucose, GLU CV)、最大血糖波动幅度(mean amplitude of glycemic excursions, GLU MAGE)]。治疗前、后营养指标[血清白蛋白(serum albumin, Alb)、血清前白蛋白(pre-albumin, PA)、血清总蛋白(serum total protein, TP)、血红蛋白(hemoglobin, Hb)]。预后指标(住ICU时间和总住院时间,60、90 d死亡率)。
血糖变异性4个参数计算公式如下:
(1) 平均血糖(GLU AVE): GLU AVE=
∑(血糖值)/标本总数
(2) 血糖标准差(GLU SD): GLU SD=

(3) 血糖变异系数(GLU CV): GLU CV=GLU SD/GLU AVE×100%
(4) 平均血糖波动幅度(GLU MAGE): 计算一天内血糖波动幅度(血糖最高值与最低值之差)的平均值。
1.5 统计学处理
2 结 果
2.1 治疗前后两组血糖变异性比较
治疗14 d时,两组之间血糖变异性(SD、CV、MAGE)的差异具有统计学意义(P<0.05),观察组变异性均低于对照组;而治疗前、后对比发现,两组组内比较差异均无统计学意义(P<0.05);不同肠内营养制剂和时间之间存在交互作用,随着时间延长,两组血糖变异性之间差异性明显放大。而传统评价指标(血糖平均值)在通过统计学分析发现,不管是组间比较还是组内比较,差异均存在统计学意义(P<0.05),难以区分因干预措施还是时间变化引起的差异,见表2。

表2 两组治疗前后血糖变异性参数对比
2.2 两组治疗前后营养指标比较
治疗14 d时,两组之间营养指标比较无统计学差异(P≥0.05);在治疗前后两组内营养指标(Alb、PA、STP)均呈上升趋势,差异均存在统计学意义(P<0.05);不同肠内营养制剂的干预与时间之间并无交互作用。两组HGB治疗前后及组间比较差异均无统计学意义(P>0.05),见表3。

表3 治疗前后两组营养指标参数对比
2.3 两组治疗后预后情况比较
观察组入住ICU天数和总住院天数[(30.1±5.61) d,45.7±7.39) d],均少于对照组[(36.9±7.39) d,(56.1±9.83) d],且差异具有统计学意义(P<0.05)。60、90 d死亡率,观察组[1.4%(1/72),2.6%(3/72)]也明显低于对照组[2.8%(2/77),6.9%(6/77),P<0.05]。
3 讨 论
应激性高血糖是重症患者预后不良最大独立风险因素[9]。关于重症患者的血糖管理目标一直是争论的焦点。2001年,Van den Berghe等[10]提出应用强化胰岛素治疗方法将血糖水平控制在4.46.1 mmol/L,可改善心脏外科的重症患者的病死率。2012年,Krinsley等[11]研究表明对于ICU患者应采用宽松的血糖标准,即空腹血糖控制在810 mmol/L,更加有利于降低死亡率。面对如此争议的目标血糖值范围,2006年,Egi等[12]针对ICU内危重症患者进行血糖回顾性研究发现: 患者血糖波动性与其ICU住院死亡率及住院时间相关,由此最早提出把血糖变异性作为血糖控制的指标。随后大量研究表明,血糖变异度与危重病患者的死亡率具有独立相关性[13-14]。然而,有关糖变异性对重症急性胰腺炎患者预后的影响报道很少。本研究将血糖变异性概念引入重症急性胰腺炎的治疗观察中,通过分析两组常见肠内营养制剂应用后血糖变异参数的变化,验证了血糖变异性与临床预后的关系。本研究发现对照组肠内营养制剂应用后虽然仅使平均血糖轻度上升,但重要的是引起血糖变异性的明显增高;而含缓释淀粉肠内营养制剂应用后不仅使血糖平稳降低,而且更明显的是控制血糖值的起伏,稳定血糖的变异性。最终导致应用含缓释肠内营养制剂的患者明显缩短患者住院时间,降低死亡率。从营养角度分析,虽然含缓释淀粉肠内营养制剂的能量密度低于对照组,但也可以显著提升患者营养水平,两者之间无优劣之分。
血糖变异性是指在一定时间体内血糖波动的程度,可以完整描述近期血糖波动的幅度,较单个随机血糖值,具有更加全面的评估作用。研究提示血糖的快速波动所增加氧化应激比持续高血糖更有害[15],认为波动性高血糖导致细胞内正常糖代谢途径受损,多元醇途径、晚期糖基化终末产物途径、蛋白激酶C途径和己糖胺途径等旁路代谢过度激活,细胞内产生过量活性氧类,造成细胞、组织的结构和功能障碍,导致并发症的发生。除了氧化应激,血糖波动还可诱导神经元损伤,线粒体损伤和凝血功能异常,这些对重症患者均是不利因素[16]。血糖变异性指标可以更加直观地发现血糖的波动速度和幅度,及时控制其可避免过度的应激反应,更有利于平稳的管理血糖变化。目前血糖变异度缺乏明确的定义,常用的变异性指标有GLU AVE、GLU SD、GLU CV、GLU GLI、GLU LAGE和GLU MAGE等[17]。本研究采用了相当容易计算获得的GLU AVE、GLU SD、GLU CV、GLU MAGE作为主要监测指标。其中GLU SD代表了血糖值扩散的度,但容易受平均血糖水平的影响[18]。GLU CV是血糖标准差与随机血糖的比值[19],代表了一种标准化的离散度度量,它描述了血糖水平的扩散,不随平均血糖的变化而变化,可以反映短期内不同血糖水平之间血糖离散的趋势[20]。平均血糖波动幅度,反映1 d内血糖的波动幅度的金标准[17]。
目前大量研究表明,重症急性胰腺炎应用肠内营养治疗,不仅能有效维护肠黏膜功能、减少肠道菌群与毒素移位,还减少感染及其他并发症的发生并且改善预后[21]。研究也发现35%80%的急性胰腺炎患者诊疗过程中会出现高血糖现象[22]。高血糖也是肠内营养最常见的代谢性并发症,与患者病死率和临床不良结局的发生密切相关[23]。国外的研究表明,在肠内营养患者中有大约30%的患者可能会出现高血糖[24],即使在非糖尿病患者中高血糖的发生率为12.0%14.5%[25]。类似的研究也显示脑卒中患者进行肠内营养患者高血糖的发生率为25.0%33.0%[26]。因此,急性胰腺炎在启动肠内营养治疗后出现高血糖的概率更高,我们此前的统计发现大概30%左右应用肠内营养的急性胰腺炎患者会发生应激性高血糖现象。究其原因,不同肠内营养液制剂可能会对急性胰腺炎患者肠内营养发生高血糖产生重要的影响。本次研究也发现相对于含麦芽糊精的肠内营养制剂,含缓释淀粉的肠内营养液可明显减低血糖变异性,其可能存在的机制如下: 首先,缓释淀粉主要是脂肪和淀粉复合物,相对分子质量较大,在胃肠排空的速度慢,有利于延缓糖类的吸收;同时也延缓水解速率和吸收速率,从而出现小幅度缓慢提升血糖;其次,成分中果糖的血糖生成指数低,远远低于葡萄糖及麦芽糊精,它主要经小肠缓慢吸收,在肝脏代谢时也不依赖胰岛素,因此在降低餐后血糖中发挥主要作用;再次,因含有大量可溶性膳食纤维,可维持肠内容物的渗透压,以防肠内营养液被大量迅速吸收,延缓高血糖的发生。而含麦芽糊精的配方由于在体内可被迅速分解为葡萄糖,从而会引起血糖快速升高,因此对于有潜在高血糖的患者是不利的[27]。
本研究是单中心研究,纳入患者数量较少,另一方面未能对SAP严重程度进行分级,也未能对不同病因引起的胰腺炎中血糖变异度差异进一步区分,存在一定局限性,需要进一步在大样本临床研究中得到验证。

