HIRA 基因突变对绵羊颗粒细胞中mRNA和蛋白表达及细胞激素分泌的影响
周 梅,刘秋月,孙 庆,田志龙,向光明,狄 冉,王翔宇,储明星*
(1 中国农业科学院北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖重点实验室,北京 100193;2 安徽省农业科学院畜牧兽医研究所,猪分子数量遗传学安徽省农业科学院重点实验室,畜禽产品安全工程安徽省重点实验室,合肥 230001)
产羔数是绵羊最重要的经济性状之一,其对绵羊繁殖力遗传的贡献为74%—96%[1-3],是衡量母羊生产性能的关键指标。 潘章源等[1]对10 个中国地方绵羊品种进行全基因组重测序,筛选到了组蛋白细胞周期调节(histone cell cycle regulator,HIRA)基因。HIRA基因编码的HIR∕HIRA 蛋白是组蛋白的伴侣蛋白,该蛋白参与各种染色质调节过程,如基因转录和精子染色质的重塑[2-3]。 在真核生物中,DNA 与组蛋白结合形成核小体这种稳定的结构,从而参与各种生物学过程(如DNA 复制、修复和转录,成肌细胞分化,心脏发育和胚胎发育)[4-8]。 研究发现,在小鼠和鱼类胚胎发育过程中,HIRA基因对于组蛋白与DNA的结合尤为重要[9-11]。HIRA基因对于染色质组装过程中H3.3 变异体的沉积至关重要,该基因缺失会影响H3.3∕H4 的置换,并影响精子染色质的组装,从而影响小鼠受精[12-16]。 在小鼠胚胎发生中,HIRA 蛋白失活会引起妊娠中期胚胎死亡[17]。 Buhe 等[9]和Veselovska 等[18]研究发现,HIRA 蛋白对于小鼠卵子发生过程中的转录调控和DNA 甲基化至关重要,原始卵泡细胞中HIRA 蛋白缺失可导致发育严重缺陷,从而使卵母细胞大量死亡。HIRA基因一个点突变可使果蝇雌性不育,阻止受精后精核的解凝,导致父本染色体无法参与后代胚胎发育[19-22]。 郭秋红等[23]研究发现,HIRA基因主要参与受精或胚胎发育过程,对卵子发生或减数分裂并没有显著影响。
HIRA基因mRNA 表达在不同产羔数绵羊繁殖相关组织间显著差异,且该基因的g.71874104G >A 和g.71833755T >C 两个突变位点均与小尾寒羊产羔数存在显著关联[13]。 本试验通过研究g.71874104G >A 和g.71833755T >C 两个突变位点对不同HIRA基因型绵羊卵巢颗粒细胞中mRNA 和蛋白表达水平以及生殖激素浓度的影响,以探究HIRA基因突变与绵羊产羔数之间可能存在的内在联系。
1 材料与方法
1.1 样品采集和RNA 提取
绵羊卵巢组织取自河北南营屠宰场。 采用动物组织∕细胞微量RNA 提取试剂盒[天根生化科技(北京)有限公司]加Trizol(Invitrogen 公司,美国)提取各组织总RNA,使用Nanodrop 2000 检测提取RNA 的浓度和OD 值,并采用1.2%的琼脂糖凝胶电泳检测RNA 完整性。
1.2 引物设计
根据GenBank 提供的绵羊HIRA基因mRNA 的转录本序列(登录号为:XM_012164242.2),利用Primer 3 在线软件设计HIRA基因突变位点分型和荧光定量所需引物,以β-actin(NM_001009784)作为内参基因。 引物由北京天一辉远生物科技有限公司合成,测序由北京华大生物科技有限公司完成。 引物具体信息见表1。

表1 引物信息Table 1 Primer information
1.3 绵羊卵巢颗粒细胞的获取和培养
将绵羊卵巢置于4 ℃的1 ×PBS 缓冲液(Gibco 公司,美国)中带回实验室,用75%(体积分数)乙醇洗涤2 次(每次5—10 s),然后用0.9%(质量分数)的生理盐水洗涤3 次,最后将卵巢置于含有生理盐水+1%(体积分数)青链霉素(Gibco 公司,美国)的混合液中,37 ℃水浴。 小心取出卵巢,用灭菌的10 mL 注射器吸取0.5 mL 完全培养基[完全培养基按照DMEM(HyClone 公司,美国)、胎牛血清(Gibco 公司,美国)和青链霉素分别为84%、15%和1%的体积比例进行配制)],从卵泡(直径>3.0 mm)中吸出含有颗粒细胞的卵泡液样品,将混合液依次打入4 孔板(Costar,Cambridge,MA,USA)中并做好标记,然后置于37 ℃、5%(体积分数)的二氧化碳培养箱中。
1.4 卵巢组织DNA 提取及基因分型
取绿豆大小卵巢组织,利用动物组织DNA 提取试剂盒[天根生化科技(北京)有限公司]提取DNA。通过测序对每个卵巢组织HIRA 基因g.71874104G >A 和g.71833755T >C 位点进行基因分型。
1.5 颗粒细胞激素测定和HIRA 基因表达
待培养皿中细胞密度达到80%左右,将培养液更换为不含血清的培养基,并将该换液时间记为0 h,48 h 时收集细胞培养液,送至北京北方生物科技有限公司利用放射免疫的方法检测细胞培养液中孕酮(P4)和雌二醇(E2)的含量。 剩余的细胞用于提取RNA,利用qPCR 方法检测g. 71874104G >A 和g.71833755T >C 位点不同HIRA 基因型在绵羊颗粒细胞中的mRNA 表达情况。 反应体系为20 μL:SYBR Premix Ex TaqⅡ10 μL,上下游引物各0.8 μL,cDNA 模板2.0 μL,ddH2O 6.4 μL。 反应程序为:95 ℃预变性5 s;95 ℃变性5 s,60 ℃30 s,40 个循环;反应结束后分析熔解曲线。 qPCR 检测利用Roche Light Cycler® R480Ⅱ型荧光定量PCR 仪进行,每个样品重复3 次。
1.6 免疫荧光试验
采用免疫荧光法检测HIRA 蛋白在绵羊卵巢颗粒细胞中的表达。 用4%(质量分数)多聚甲醛固定细胞并用1 ×PBS 清洗3 次后,向清洗后的培养皿每孔加入100 μL 封闭液1[5 mL 封闭液1:500 μL 山羊血清(Abcam 公司,英国) +4.5 mL 1%的BSA(用1 ×PBS 稀释) (北京经日今典科技有限公司) +5 μL 1%Triton-100(用1 ×PBS 稀释) (北京经日今典科技有限公司)],封闭20 min。 吸出封闭液1,加入一抗(Abcam 公司,英国) 100 μL(一抗∶封闭液1 =1∶200),4 ℃冰箱中放置过夜。 吸出一抗,用1 ×PBS 轻柔地清洗3 次。 向清洗后的培养皿每孔加入200 μL 二抗(Abcam,英国)(二抗∶封闭液2 =1∶1 000;5 mL 封闭液2:400 μL 山羊血清+4.6 mL 1%的BSA +5 μL 1% Triton-100),在黑暗中放置1 h。 吸出二抗,用1 ×PBS 轻柔地清洗3 次。 向清洗后的培养皿每孔细胞表面加入15 μL ProLong(Life 公司,美国)和Hoechst(Hoechst AG 公司,德国)混合液,盖上圆形盖玻片,用锡箔纸包好后放置于4 ℃冰箱。 HIRA 蛋白表达阳性率=阳性表达的细胞数∕总细胞数。 共统计18 个样本中HIRA 的表达情况(20 倍镜),包括g.71874104G >A 和g.71833755T >C 位点各3 种基因型,每种基因型设3 个生物学重复。
1.7 数据分析
采用2-ΔΔCt法[24]计算目的基因相对表达量,利用SPSS 20 软件中LSD 法对不同组别之间mRNA 和蛋白表达以及激素浓度进行差异比较分析,所有数据以“平均值±标准误”表示。
2 结果与分析
2.1 不同HIRA 基因型绵羊颗粒细胞mRNA 和蛋白表达
qPCR 检测结果表明(图1),g.71874104G >A 位点各基因型颗粒细胞之间HIRA 的表达量GG 型最高,其次是GA 型,AA 型最低,但三者之间差异均不显著(P>0.05)。 而g.71833755T >C 位点则是TT 型颗粒细胞中HIRA的表达量最高,其次是TC 型和CC 型,且TT 型显著高于TC 和CC 型(P<0.05),TC 和CC 型之间差异不显著。 由图2 可知,HIRA 蛋白在原代培养的绵羊卵巢颗粒细胞的细胞核中呈中度表达。 从表2 可以看出,g.71874104G >A 突变位点GG 型颗粒细胞中HIRA 蛋白表达量最高,其次是AA型,GA 型最低且极显著低于GG 和AA 型(P<0.01);g.71833755T >C 突变位点TT 型颗粒细胞中HIRA蛋白表达量最高,其次是TC 型,CC 型最低,且3 种基因型之间均差异极显著(P<0.01)。
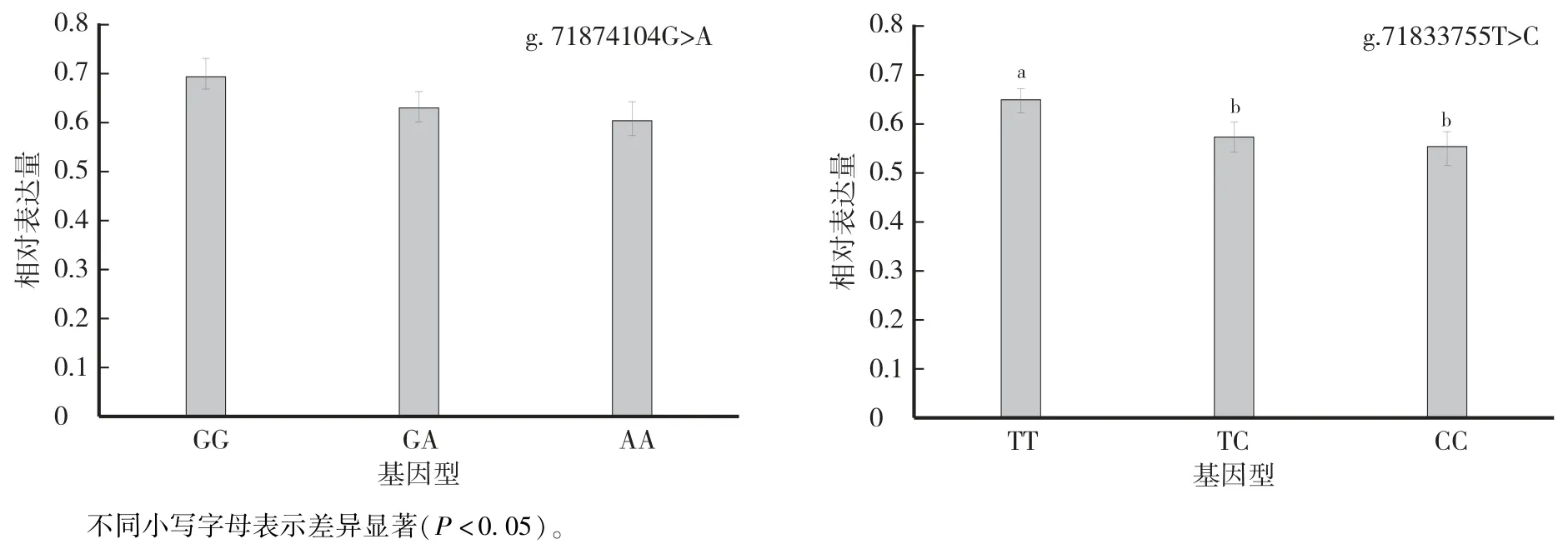
图1 不同HIRA 基因型在绵羊颗粒细胞中的表达Fig.1 Expression of HIRA gene with different genotypes in ovine granulosa cells

图2 绵羊颗粒细胞中HIRA 蛋白表达情况Fig.2 Expression of HIRA protein in ovine granulosa cells

表2 g.71874104G >A 和g.71833755T >C 突变位点不同基因型绵羊颗粒细胞中HIRA 蛋白表达Table 2 HIRA protein expression in ovine granulosa cells with different genotypes of g.71874104G >A and g.71833755T >C mutations
2.2 HIRA 基因突变对绵羊颗粒细胞中重要生殖激素分泌的影响
由图3 可以看出,g.71874104G >A 突变位点各基因型绵羊卵巢颗粒细胞GG 型P4 的分泌量显著高于GA 和AA 型(P<0.05),GA 和AA 型之间无显著差异;GA 型E2 的分泌量显著高于GG 和AA 型(P<0.05),GG 和AA 型之间无显著差异。 g.71833755T >C 突变位点各基因型之间P4 和E2 的分泌量均无显著差异(P>0.05)。
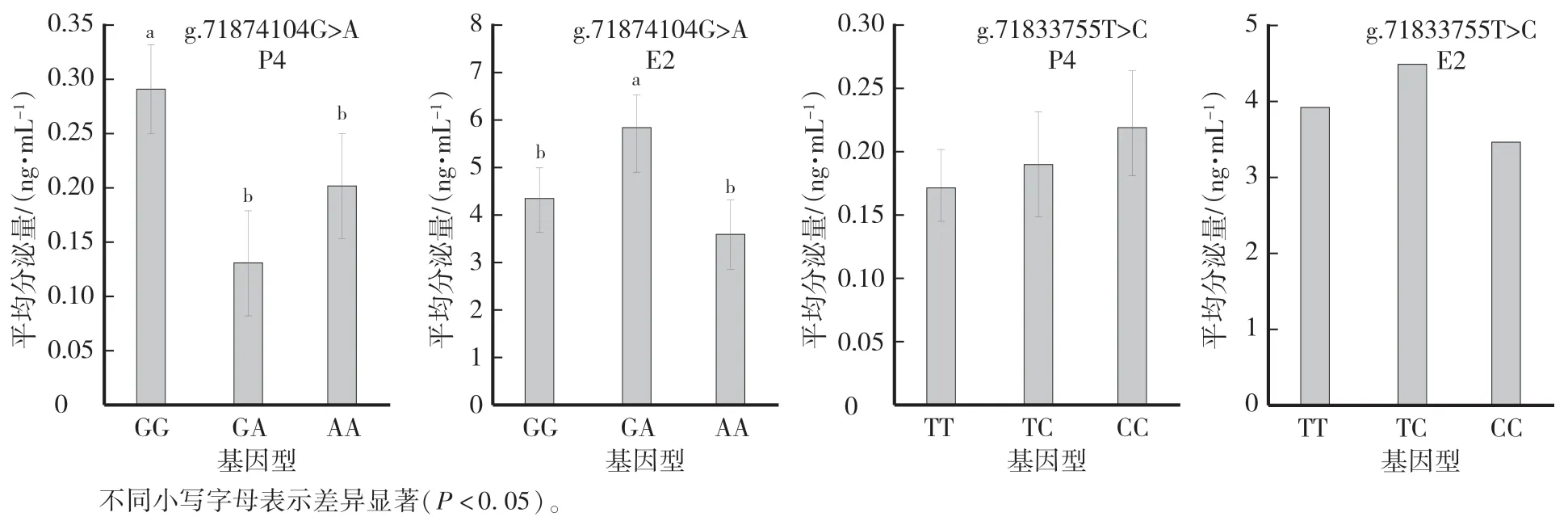
图3 g.71874104G >A 和g.71833755T >C 突变位点不同基因型颗粒细胞激素分泌Fig.3 Hormone secretion of different genotypes of granulosa cells for g.71874104G >A and g.71833755T >C mutations
3 讨论
研究表明,HIRA基因对脊椎动物的胚胎发育至关重要,该基因缺失会导致小鼠胚胎死亡[4,25]。HIRA基因是一个保守的不依赖于DNA 复制的染色质装配因子,在果蝇受精过程中发挥着特殊作用,对受精过程中父本染色质组装尤为重要[26]。 同果蝇一样,小鼠的母本HIRA基因对其发育也尤为重要,它能够将组蛋白变体H3.3 掺入父本基因组中进而参与合子的发育[27-28]。 而HIRA基因缺失则会阻止小鼠精子基因组中的核小体装配,致使雄性原核无法形成,从而导致受精失败[29]。 另有研究表明,HIRA基因突变雌性小鼠虽然可以正常排卵,但在与野生型雄性交配后表现为不育,且野生纯合型和杂合型小鼠之间的排卵数无显著差异[27]。 有趣的是,研究还发现绝大部分杂合子的卵母细胞受精后均能发育至囊胚阶段,而没有突变纯合子的卵母细胞能够发育至二细胞期[27]。 可见,HIRA基因在小鼠胚胎发育过程中发挥着非常关键的作用。
本团队前期研究显示,HIRA基因突变位点g.71874104G >A 和g.71833755T >C 对于小尾寒羊和鲁中肉羊不同胎次产羔数均存在不同程度的影响[2,30]。 突变位点g.71874104G >A 和g.71833755T >C 分别位于HIRA基因的上游调控区和编码区,其中g.71833755T >C 为错义突变位点,该突变导致原本应该编码谷氨酰胺的密码子突变成了编码精氨酸的密码子。 本研究发现,两个突变位点不同基因型颗粒细胞中HIRA 蛋白的表达量存在显著差异。 g.71874104G >A 突变位点不同基因型颗粒细胞中,HIRA 蛋白表达量最低的为GA 型,显著低于AA 和GG 型,但AA 和GG 型之间的表达量无显著差异,个体水平上GA型小尾寒羊的产羔数最高,另外两种基因型之间产羔数差异不显著[2];g.71833755T >C 突变位点不同基因型颗粒细胞中,CC 型蛋白表达量最低,TC 型HIRA 蛋白表达量显著低于TT 型,个体水平TC 型绵羊产羔数最高[2]。 在细胞培养过程中CC 型颗粒细胞的成活力极低,而颗粒细胞的增殖分化是卵泡发育的一个关键环节,其分泌的抑制素可作为一种旁分泌因子抑制邻近卵泡的生长,是优势卵泡募集的重要调节因素[31],因此颗粒细胞成活力极低很有可能会导致优势卵泡无法募集,从而导致绵羊个体无法正常排卵,这与前期发现的CC 型绵羊个体极少一致[2]。 g.71833755T >C 位点受到选择发生突变,但该突变可能与繁殖轴上某个有害突变连锁,会影响绵羊生存状况,在自然选择过程中该突变被清除了。 综上,两个位点的突变杂合子可通过下调其在颗粒细胞中的蛋白表达促进绵羊卵泡发育、受精以及胚胎发育等过程,最终增加产羔数。
4 结论
本研究发现,g.71874104G >A 和g.71833755T >C 位点突变均导致卵巢颗粒细胞中HIRA 蛋白表达发生显著变化,但HIRA基因mRNA 的表达均无明显差异,且仅g.71874104G >A 突变位点对颗粒细胞P4和E2 的分泌有显著影响。 推测HIRA基因的g.71874104G >A 和g.71833755T >C 两个突变位点可能主要通过改变绵羊卵巢颗粒细胞中HIRA 蛋白表达量影响后续的受精和胚胎发育过程,最终影响绵羊的生殖能力。

